查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






原发性肝癌是全球范围内常见的第七大威胁人类健康的恶性肿瘤,致死率高居癌症第3位,其中70%~85%病理类型为肝细胞癌(HCC),我国70%以上HCC继发于HBV感染[1]。原发性肝癌诊疗规范(2017年版)指出,肝癌是我国目前第四常见恶性肿瘤,肿瘤致死率排第3位[2]。HBV相关HCC发生发展涉及若干过程,即从再生结节或不典型增生结节(DN)逐步发展成为HCC。
2017年11月9日中国医学科学院肿瘤医院院长、国家癌症中心主任、中国科学院院士赫捷在中华医学会第十四次全国放射肿瘤学学术年会上阐述,目前我国肿瘤发病居前5位者依次为肺癌、胃癌、肝癌、食管癌和结肠癌。
2009年国际肝细胞肿瘤共识小组将直径≤2 cm的HCC定义为小肝癌(small HCC,sHCC)[3]。根据病理及临床预后,sHCC可分为早期肝细胞癌(eHCC)和进展期肝细胞癌(aHCC)。eHCC为直径≤2 cm的孤立结节,组织分化程度高,无血管侵犯及远处转移;aHCC为中低分化HCC,多侵犯血管。eHCC占HCC的5%~10%,被认为是DN向aHCC的过渡阶段,且最终会进展为aHCC[4-5];主要治疗方式为手术局部切除,5年总体生存率及无复发生存率均高于aHCC,预后较好;eHCC与典型HCC影像学表现不同,仅凭传统影像学方法难以诊断。
国内多位感染与炎症放射学专业委员会专家总结国内外相关文献,结合自身临床经验及循证医学证据对指南及标准的方法学要求,共同确立及推出HBV感染相关eHCC影像学诊断标准,以期为相关科室医生提供指导和诊断依据。
1影像学检查方法
参考国内外相关文献[6-13]及国内临床实践,专家组推荐对HBV相关eHCC进行以下影像学检查。
检查前患者需禁食≥8 h。采用常规超声诊断仪,线阵或凸阵探头,频率3.0~3.5 MHz,行平卧位、左侧卧位或右侧卧位扫查。嘱患者配合呼吸,采用连续扇形扫查法,行右肋间斜切、右肋缘下斜切及纵切、经剑突下横切、纵切和斜切及右季肋间斜切扫查。
检查前患者进行屏气训练。调节超声诊断仪至低机械指数超声造影(CEUS)专用成像条件,团注造影剂后,以生理盐水冲洗时启动计时器,于注射造影剂5~25 s后于患者屏气状态下观察动脉期灌注,之后实时连续观察病灶门静脉期及实质期增强模式,并于获得有效信息后扫查全肝。如局部显像不清,可再次注射对比剂,检查时间为4~6 min。储存动态影像学资料并上传至工作站。
推荐使用16层以上多层螺旋CT扫描仪。嘱患者检查前1周内禁服含金属药物,勿接受消化道钡剂造影;检查当日禁食≥4 h,不禁水。
嘱患者仰卧,双臂上举,足先进,以膈顶为扫描基线,自膈顶扫描至肝脾下缘2 cm。采用螺旋扫描方式,螺距0.6~1.2,参考体质量指数选用管电压需100~120 kV,有效管电流200~300 mAs(或自动毫安技术),转速0.6~0.8 s/rot。根据机型选择不同探测器组合(16×1.500 mm、32×1.200 mm、64×0.625 mm、128×0.600 mm、320×0.500 mm)。建议肝脏扫描层厚≤5.00 mm,FOV(体部)300~350 mm。以标准或软组织重建算法重建。
推荐使用高压注射装置,经静脉团注含碘浓度270~300 mg/ml对比剂,流率2.5~3.5 ml/s,用量参考1.5~2.0 ml/kg体质量,总量70.0~100.0 ml。建议采用对比剂智能跟踪技术或小剂量对比剂测试时间密度曲线等个性化方案;扫描期相和延迟时间采用3期扫描,自开始注射对比剂计时,延迟40 s采集动脉晚期图像,延迟60~70 s采集门静脉期图像,延迟180 s采集延迟期图像。扫描参数及重建方式同平扫。
图像需满足影像学诊断需求,清晰显示肝、脾和胆囊形态及其与周围脂肪组织的分界;平扫图像应可明确分辨肝内血管结构(包括门静脉及肝静脉主干和主支);肝动脉期、门静脉期和延迟期增强图像需准确、清晰显示各期相肝内应强化的血管等结构。
推荐以场强≥1.5T MR仪扫描整个肝脏。检查前禁食6~8 h、禁水≥4 h。训练患者呼气末屏气≥15 s,且每次呼吸深度尽量保持一致。嘱患者仰卧,头先进;采用相控阵表面腹部线圈及呼吸门控进行扫描。
2共识制订方法学
本共识基于循证医学指南及标准制订方法学,参照2011年牛津大学循证医学中心证据分级标准、国际证据质量分级和推荐强度系统工作组推荐意见形成的方法学给出推荐意见。
3推荐检查技术及影像学表现
超声因其无辐射、操作便捷、价格低廉等优势而宜作为筛查的eHCC首选方法(证据级别: Ⅱ,推荐强度: 强)。
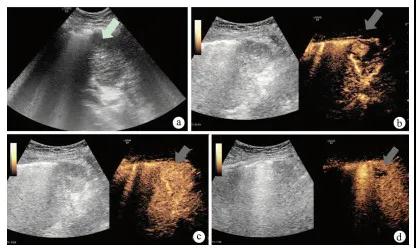
图1 患者女,72岁,肝脏S8段eHCC注:a,二维超声声像图示肝脏S8段低回声结节(箭头);b,注射造影剂16 s后病灶明显增强(箭头);c,注射造影剂26 s后病灶呈等回声(箭头);d, 注射造影剂1 min 8 s病灶呈低回声(箭头)。
对诊断eHCC价值高,建议作为确诊eHCC的影像学检查方法(证据级别: Ⅱ,推荐强度: 强)。见图 2、3。
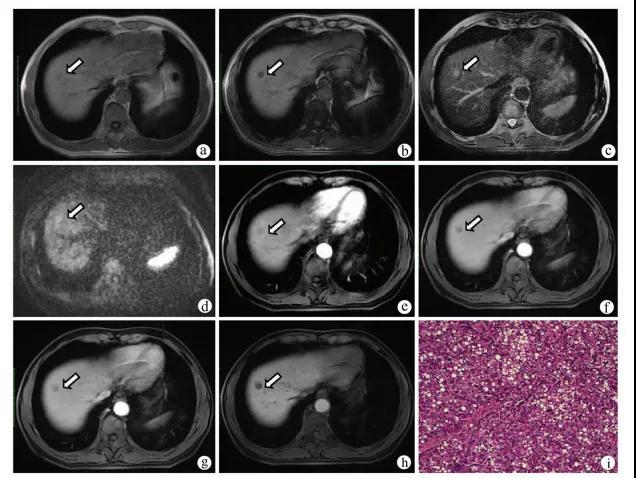
图2 患者男,46岁,HBV感染者,肝硬化合并eHCC注:a,同相位MR T1WI示肝脏S8段等或稍低信号(箭头);b,病灶反相位信号减低,提示其内存在脂肪变性(箭头);c,T2WI呈稍高信号;d,DWI呈稍高信号;e,增强扫描动脉晚期呈等信号(箭头);f、g,门静脉期及延迟期呈低信号(箭);h,肝胆期呈低信号;i,病理学诊断为高分化HCC,其内存在较多脂肪(HE染色,×100)。
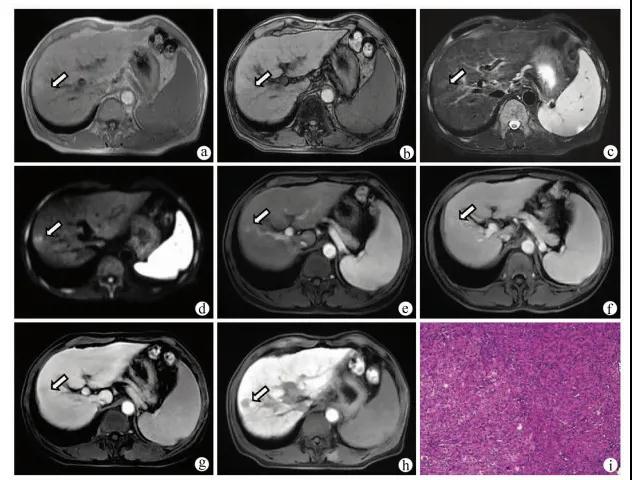
图3 患者男,57岁,肝硬化12年,肝脏S6段结节注:a,病灶同相位呈稍高信号(箭头);b,反相位未见信号减低(箭头);c,T2WI呈稍高信号(箭头);d,DWI呈高信号(箭头);e,增强扫描动脉晚期轻度强化(箭头);f,门静脉期呈稍高信号,持续强化(箭头);g,延迟期强化减低,呈低信号(箭头);h,肝胆期呈低信号;i,病理学诊断为高分化HCC(HE染色,×100)。
eHCC CT表现缺乏特异性,CT宜作为eHCC补充检查方式(证据级别: Ⅱ,推荐强度: 弱)。
4影像学诊断eHCC标准
HBV感染者同时符合上述3.1所列影像学表现。
影像学疑似病例同时符合上述诊断依据中的3.2.2~3.2.5。
病理学诊断高分化HCC且直径≤2 cm。
5相关热点问题共识
根据国际肝脏肿瘤共识小组及WHO消化系统肿瘤分类(2010年版),eHCC为直径≤2 cm的肝内孤立结节,组织分化程度较高,未侵犯血管,无远处转移[3]。eHCC为HCC的早期阶段,反映其多步演变过程中的起始阶段;其大体标本为边缘模糊的结节,具有如下病理学特征: (1)细胞密度增高,超过周围组织的2倍,伴细胞核浆比增高和肝板不规则增厚;(2)结节呈假腺样排列,弥漫脂肪变(约40%可见),其内可见数量不等的汇管区(或门静脉系统);(3)可见数量不等的非配对动脉[3]。eHCC侵犯间质具有特征性,可与高级别DN(HGDN)相鉴别[14-15]。
目前HCC诊疗工作中广泛应用的指南由欧洲肝病学会(EASL)、美国肝病学会(AASLD)及亚太地区肝病学会共同制定[16-18],其认定的HCC标志性影像学诊断特征为动脉期强化、门静脉期和/或延迟期迅速廓清,呈典型“快进快出”强化模式,均为aHCC的特征,未对早期高分化HCC(即eHCC)制定影像学诊断标准,仅EASL和AASLD提出<1 cm病变可因体积过小而无法发现典型影像学特征。
本标准综合国内外相关研究结果认为增强MR检出eHCC的敏感度高于增强CT,应用肝特异性对比剂可提高MR诊断eHCC的效能。eHCC病灶多≤2 cm,平扫不易发现,增强扫描多表现为动脉期无明显强化,仅在门静脉期或延迟期相对周围肝实质而呈低密度或信号;DWI高信号、肝特异性对比剂成像肝胆期低信号可作为诊断eHCC的影像学依据。CEUS检查中eHCC动脉期多富于血供,这与其增强MRI特点有所不同,但具体原因不详,可能与CEUS可实时监测及2种检查对比剂分子结构不同相关,其病理基础则可能与未充分发展的异常供血动脉及血窦内皮毛细血管化、瘤体内窦血管腔与周围肝组织窦血管腔相连有关。
综上,本标准通过总结eHCC的影像学征象,为影像科医师和临床医师提供明确诊断依据,以期提高eHCC检出率及临床诊断符合率,为深入开展eHCC影像组学研究、合成诊疗一体化探针以及制备肝纤维化可逆转期探针提供理论基础,同时有助于制订治疗方案及评估疗效。
中华医学会放射学分会传染病学组,中国医师协会放射医师分会感染影像专业委员会,中国研究型医院学会感染与炎症放射学专业委员会,等. 乙型肝炎病毒相关早期肝细胞癌影像学检查与诊断标准共识[J]. 临床肝胆病杂志, 2021, 37(4): 787-791.
查看更多