4 消化道重建方式与手术操作
4.1 前切除术(anterior resection,AR)及低位前切除术(low anterior resection,LAR)的消化道重建
4.1.1 适应证 保证远端切缘≥(1~2)cm;具备行结肠直肠吻合条件;术前括约肌功能良好;无急性、慢性结肠梗阻以及肿瘤肉眼残留等相对禁忌证。
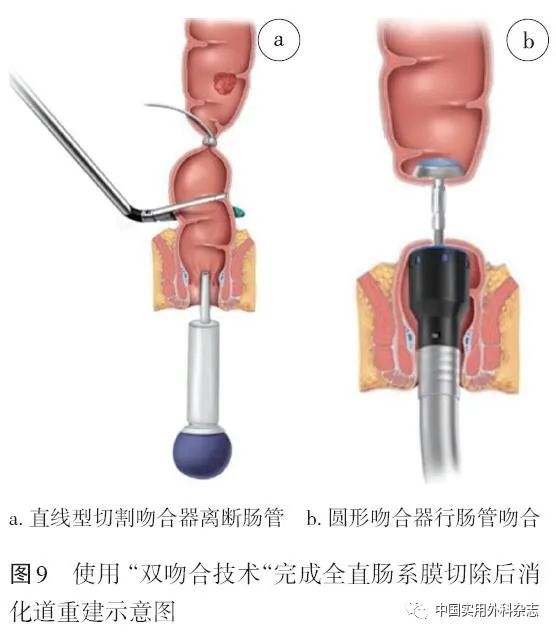
4.1.2 操作步骤 (1)环形裸化显露直肠肌层。(2)采用锁扣捆扎带、棉带、阻断钳等阻断肿瘤远端直肠,彻底冲洗直肠以清除脱落肿瘤细胞。(3)使用直线型切割吻合器(尽量少)切断直肠,保证远端切缘≥1 cm(图9a)。(4)小切口取出标本,采用吲哚菁绿(ICG)近红外光成像法或切开边缘血管等方法判断血供。(5)可选择结直肠端端吻合、端侧吻合及“J”型储袋直肠吻合等吻合方式。根据肠腔直径选用25~33 mm圆形吻合器,中心杆自钉合线旁穿出,对合钉砧完成吻合,检查吻合环完整性以及有无出血、漏等(图9b)。(6)视风险因素行转流性造口,可留置肛管减压。
推荐意见5:使用 “双吻合技术”完成AR及LAR的消化道重建,应充分游离、裸化肠管,减少组织溢出,用尽量少的切割次数,闭合、离断肠管,选用适合肠腔直径的圆形吻合器,完成无张力吻合。
4.2 经自然腔道取标本手术(NOSES)消化道重建
4.2.1 适应证 (1)肿瘤侵犯肠管<1/2周,环周径<3 cm。(2)肿瘤未侵出浆膜或直肠固有筋膜(肿瘤分期≤T3期)。(3)BMI<30。
4.2.2 操作步骤
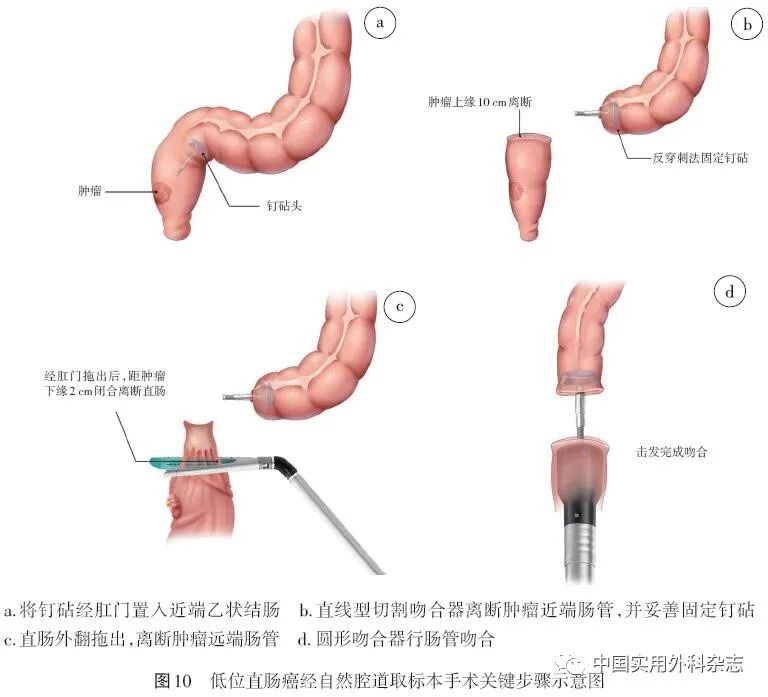
4.2.2.1 低位直肠癌NOSES消化道重建 (1) 在肿瘤近端预切线环形裸化乙状结肠,于肿瘤对侧将钉砧经肛门置入近端乙状结肠(图10a)。(2)使用腔内直线型切割吻合器于预切线处切断乙状结肠。(3)使用反穿刺法将钉砧妥善固定于乙状结肠断端(图10b)。(4)使用卵圆钳将远端直肠外翻拖出体外,在肿瘤远端1~2 cm处切断直肠(图10c),移除标本,将直肠残端送回腹腔,经肛门置入圆形吻合器,中心杆自钉合线旁穿出,对合钉砧,预压组织15 s后,击发完成吻合(图10d)。
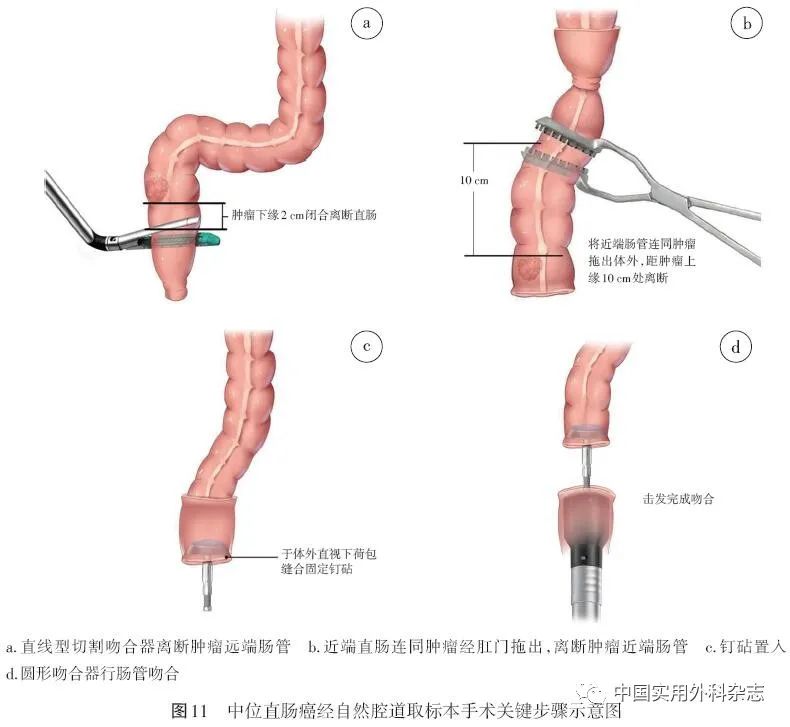
4.2.2.2 中位直肠癌NOSES消化道重建 (1)使用腔内直线型切割吻合器于肿瘤远端预切线处离断直肠(图11a),沿闭合线切开直肠残端,将近端直肠连同肿瘤经肛门拖出体外。(2)在体外,于肿瘤近端乙状结肠预切线处缝合荷包(图11b),切断乙状结肠,移除标本,置入钉砧,收紧荷包(图11c),冲洗消毒后送回腹腔。(3)使用腔内直线型切割吻合器再次闭合直肠残端,经肛门置入圆型吻合器,中心杆自钉合线旁穿出,对合钉砧,预压组织15 s后,击发完成吻合(图11d)。
推荐意见6:应严格掌握NOSES适应证,在遵守无菌、无瘤原则的前提下,置入钉砧并取出标本;在保护好肛门功能的同时,完成消化道重建。 4.3 超低位直肠癌ISR消化道重建
4.3.1 适应证 (1)病理学检查证实肿瘤组织分化良好。(2)术前影像学分期cT1~cT2的低位直肠癌,若术前分期提示为cT3,可行新辅助治疗,实现降期后施行ISR。(3)可获得至少1 cm远端切缘。(4)术前肛门功能良好。
4.3.2 操作步骤
4.3.2.1 腹部组 ISR腹部操作应尽量保留左结肠动脉,直肠周围按照后-前-侧-侧的顺序进行游离,前壁游离至齿线水平,后方切断Hiatal韧带,两侧游离至肛提肌裂孔水平进入内外括约肌间隙。
4.3.2.2 会阴组 将肛门充分牵开,在肿瘤远侧1~2 cm处确定下切缘,依次切开黏膜、黏膜下层及内括约肌层,在括约肌间隙进行“自下而上”的剥离,与经腹游离平面汇合。将直肠及其系膜经腹部切口或经肛门拖出,于肿瘤近端预切线处离断乙状结肠,移除标本。将近侧乙状结肠断端与肛管行结肠-肛门吻合(间断缝合),建议常规行转流性末端回肠造口。
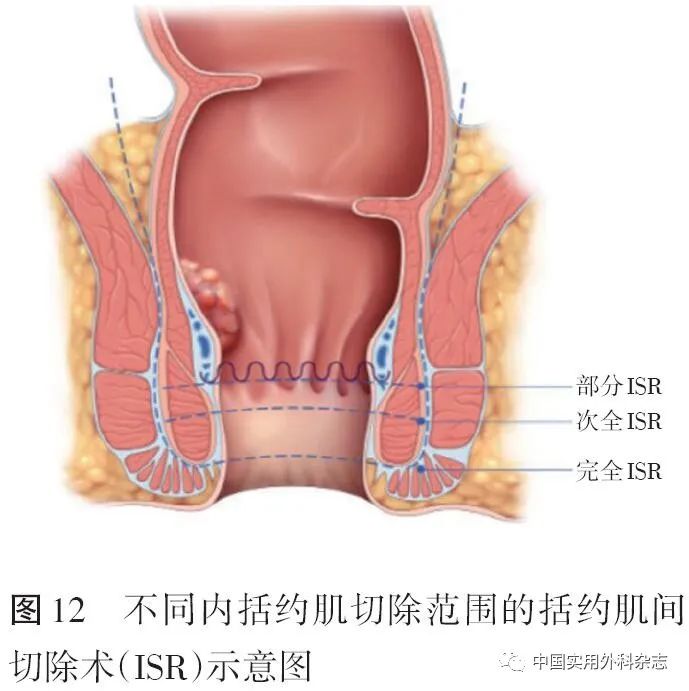
根据不同的内括约肌切除范围,ISR包括以下3种术式:经括约肌间部分切除术,即在齿状线附近离断内括约肌,又称为“部分ISR”;经括约肌间次全切除术,即在括约肌间沟和齿状线之间离断内括约肌,又称为“次全ISR”;经括约肌间完全切除术,即经括约肌间沟完全切除内括约肌,又称为“完全ISR”。在确保安全切缘的情况下,应该尽可能保留齿状线以改善术后肛门功能(图12)。
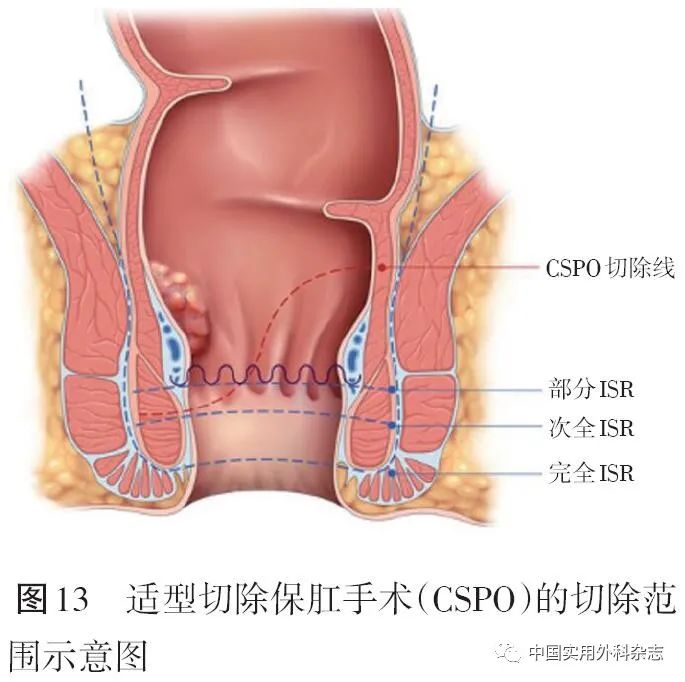
ISR在切除内括约肌的同时,将不可避免的损伤肌间神经,影响肛门功能。以肿瘤远端1 cm作为肿瘤侧切除线,以高于肿瘤侧切除线2~3 cm作为肿瘤对侧切除线,利用对侧多保留的肠壁与近端肠管吻合的方法进行适型切除保肛手术(CSPO)或改良的部分ISR,可以更好的保留肛门功能。见图13。
推荐意见7:ISR消化道重建推荐结肠-肛管间断手工吻合,常规行转流性造口。对于某些环周径较小的肿瘤,CSPO或改良的部分ISR可以更好的保护肛门功能,须在严格掌握适应证的前提下施行。
4.4 肠道“J”型储袋的制作以及储袋-直肠或储袋-肛管重建技术
4.4.1 适应证 回肠储袋-肛管吻合用于全结直肠切除后消化道重建。
4.4.2 操作步骤 (1)靠近回盲部离断回肠,确定能否完成储袋-肛管吻合。(2)游离肠系膜上血管。(3)确认储袋长度,采用直线型切割吻合器击发2次构建“J”型储袋体部(图14a)。(4)去除储袋顶部盲端,完成储袋-肛管吻合(图14b)。(5)检查储袋吻合口张力情况,进行测漏试验,放置引流。
推荐意见8:应根据病变具体情况和患者自身条件,确定合适的系膜长度和储袋类型,完成无(低)张力回肠储袋-肛管吻合,以改善肛门功能。 4.5 转流性肠造口还纳技术 由于肿瘤位置、新辅助治疗、手术技术和术者习惯的影响,直肠癌LAR的转流性肠造口率为10%~50%,其中永久性造口率为10%~30%,有70%~90%的患者接受了造口还纳手术。造口还纳并发症包括伤口感染、吻合口漏、吻合口狭窄、出血等。
4.5.1 适应证 吻合口愈合,无梗阻和狭窄;括约肌功能良好;无肿瘤局部复发;患者全身情况可耐受手术。
4.5.2 操作要点 (1)沿造口边缘连续缝合关闭造口,避免术中污染。(2)沿造口肠管边缘游离进入腹腔,注意合并造口旁疝可能。(3)游离造口边缘两侧5~10 cm肠管,在预吻合处游离系膜,可以选择手工吻合、吻合器端侧吻合、吻合器端端吻合。完成吻合后关闭系膜裂孔。(4)可吸收缝线连续缝合关闭腹直肌鞘。(5)切口缝合可采用直接间断缝合(放置引流与否)、开放伤口二期缝合、宽松全层缝合、荷包缝合和十字缝合等。荷包缝合即沿切口皮下边缘做一荷包缝合,打结时保留中央孔隙(0.5 cm)用于伤口引流。“十”字缝合采用类似整形外科技术降低切口张力,又保留了切口中央孔隙用于伤口引流 。
推荐意见9:转流性造口还纳手术前必须确保符合适应证;造口还纳在术后3周即可实施,建议在确保无肿瘤局部复发后手术;手工吻合和器械吻合均可安全用于造口还纳;与开放手术相比,腹腔镜手术无明确优势;荷包缝合和“十”字缝合能够明显降低切口感染发生率,“十”字缝合可能更具有优势。