查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





布拉格治疗是针对晚期难治性肿瘤患者的后线治疗策略,将放射治疗与PD-1抑制剂单抗及粒细胞巨噬细胞集落刺激因子(GM-CSF)联合应用,其本质是一种免疫综合治疗。而布拉格3.0治疗是针对HER2表达的晚期实体瘤患者,采用维迪西妥单抗(RC48-ADC)联合放疗、PD-1/PD-L1抑制剂、粒细胞巨噬细胞集落刺激因子(GM-CSF)和白介素-2(IL-2)治疗模式,产生高效的肿瘤特异性免疫治疗,实现了布拉格治疗的疗效增敏。
本文分享病例为晚期十二指肠腺癌患者,多线治疗失败后,采用RC48 ADC联合布拉格治疗(布拉格3.0研究,NCT05115500),实现了较好的挽救治疗效果。
病例提供者:陈伟武医师、徐美玲主治医师 苏州大学附属第二医院(核工业总医院)
病例资料
01
患者基本信息
患者老年男性,72岁,因“十二指肠癌术后4年余,化疗、靶向、免疫、放疗等多线治疗1年余后进展”入院,既往无相关基础疾病;否认吸烟、饮酒史;否认肿瘤相关家族史。
02
既往诊疗过程
患者2019年7月因“体检发现十二指肠占位3周”,遂于2019年7月30日至我院普外科行“腹腔镜下胰十二指肠切除术”,术后病理示:十二指肠中-低分化腺癌,侵及固有肌层外纤维脂肪组织,胃周淋巴结(1/13)见癌转移。免疫组化示:MSH2(+)、MSH6(+)、MLH1(+)、PMS2(+)、Her-2(2+)、FISH阴性。故诊断为十二指肠腺癌,分期为pT3N1M0 ⅢA期(UICC第八版)。术后规律行GS方案辅助化疗6周期,具体为:“吉西他滨1800mg d1、8+替吉奥60mg d1-14 q3w”,后规律复查未见肿瘤复发与转移。
2022年7月出现肝右叶转移,遂2022年7月25日起予一线“纳武利尤单抗360mg d1+紫杉醇(白蛋白结合型)200mgd1、8 q3w”联合“仑伐替尼12mg qd”治疗4周期。期间患者出现肾功能不全,予以停用仑伐替尼,后续“纳武利尤单抗+紫杉醇(白蛋白结合型)”治疗2周期,疗效评估PR;后予以“肝动脉化疗栓塞术+肝脏恶性肿瘤微波消融术”联合“纳武利尤单抗”治疗。2023年2月肝右叶转移灶局部复发,PFS为7个月。
2023年2月21日再次行“肝转移灶微波消融术”,效果不佳;遂于2023年4月3日起行二线“放疗联合PD-1抑制剂治疗”,具体为:肝转移灶立体定向放射治疗(DT为:48Gy/8Gy/6f)+帕博利珠单抗200mg d1 q3w治疗4周期,疗效评估SD,期间出现肝脓肿,予以对症治疗后好转。2023年7月出现肝脏及肝门淋巴结多发转移,PFS为3个月。
2023年7月24日起行三线治疗,具体为伊匹木单抗100mg d1+德曲妥珠(DS8201)400mg d1治疗2周期后评估肝内新增多发转移灶,肿瘤指标进行性增高,疗效评估PD。
2023年9月6日起行布拉格3.0治疗(RC48 ADC联合布拉格治疗挽救HER-2阳性晚期难治性实体瘤的临床多中心研究)模式治疗,至2023年12月02日已完成4周期治疗(PRaG3.0 A2B2),肿瘤指标进行性下降,影像学评估提示病灶较前减小。
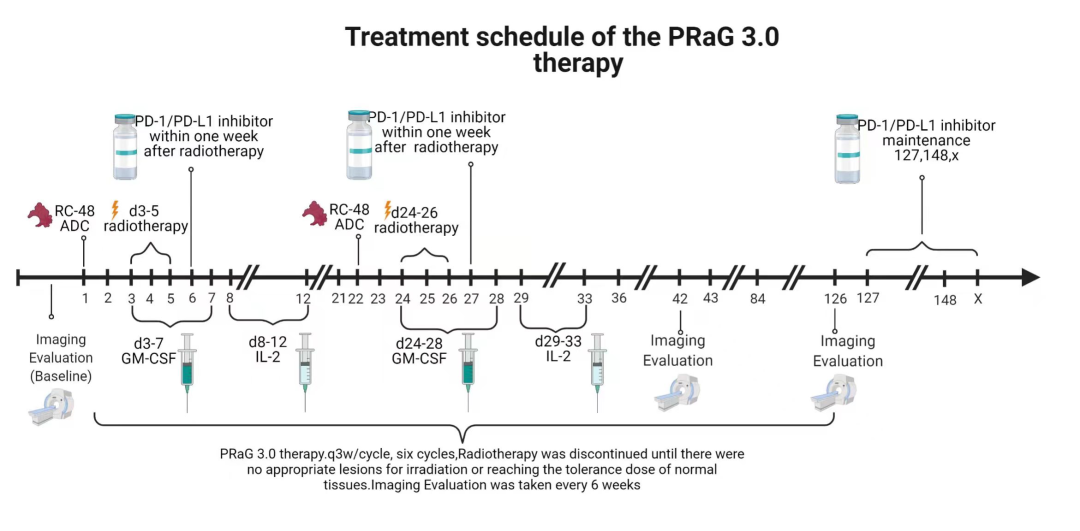
图1:布拉格3.0治疗方案流程图
免疫激活阶段(A阶段治疗模式:RC48 ADC+放疗+PD-1/PD-L1抑制剂+GM-CSF、IL-2);免疫巩固阶段(B阶段治疗模式:RC48 ADC+PD-1/PD-L1抑制剂+GM-CSF、IL-2);免疫维持阶段(C阶段治疗模式:PD-1/PD-L1抑制剂)。
03
临床治疗情况及疗效评价
患者系十二指肠腺癌术后、辅助化疗后出现肝转移,后经化疗联合靶向及免疫治疗、介入联合免疫治疗、放疗联合免疫治疗、DS8201联合双抗免疫治疗等多线治疗一年后疾病进展,考虑到患者免疫治疗耐药、ADC治疗失败后尚无有效治疗手段,同时结合患者HER-2(++),遂行RC48 ADC联合布拉格治疗,该治疗主要包括3个阶段(见图1),予RC48 ADC(维迪西妥单抗120mg d1)联合肝门、肝右叶转移灶大分割放疗d3-5(见图2)、皮下注射GM-CSF(200μg,qd3-7)序贯IL-2(200万IU,qd8-12),静脉注射免疫检查点抑制剂(卡度尼利单抗375mg d6),该治疗方案每3周重复一次,患者治疗2周期后影像学显示肝内病灶较前缩小且出现不同程度的坏死(见图3),肿瘤指标出现显著下降(见图4),此后进入不接受放射治疗的免疫巩固B阶段,治疗过程中未出现2级以上不良反应。
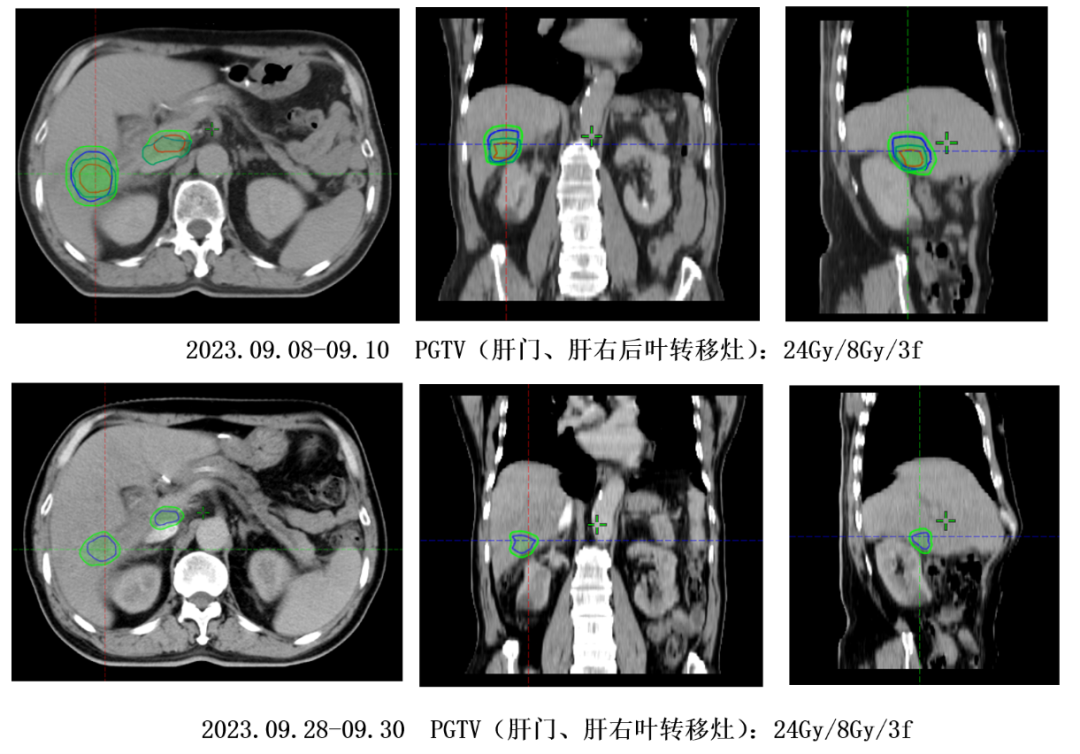
图2:放射治疗靶区图
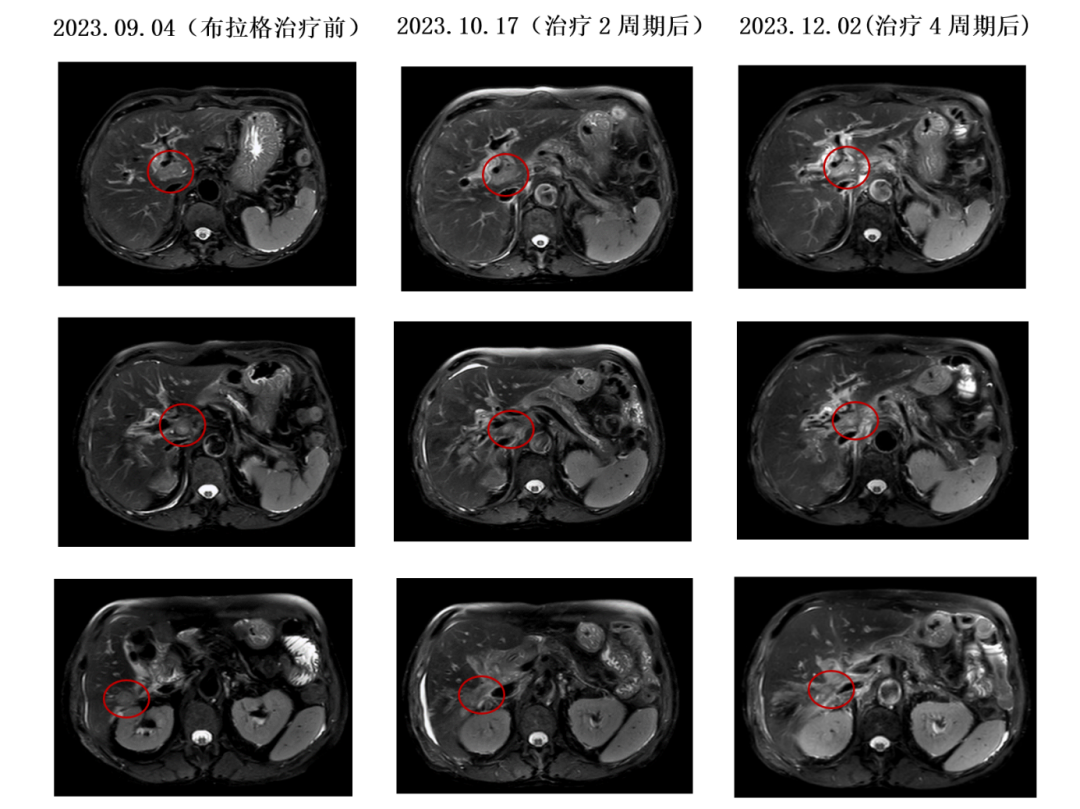
图3:布拉格治疗前后病灶MRI图像对比图
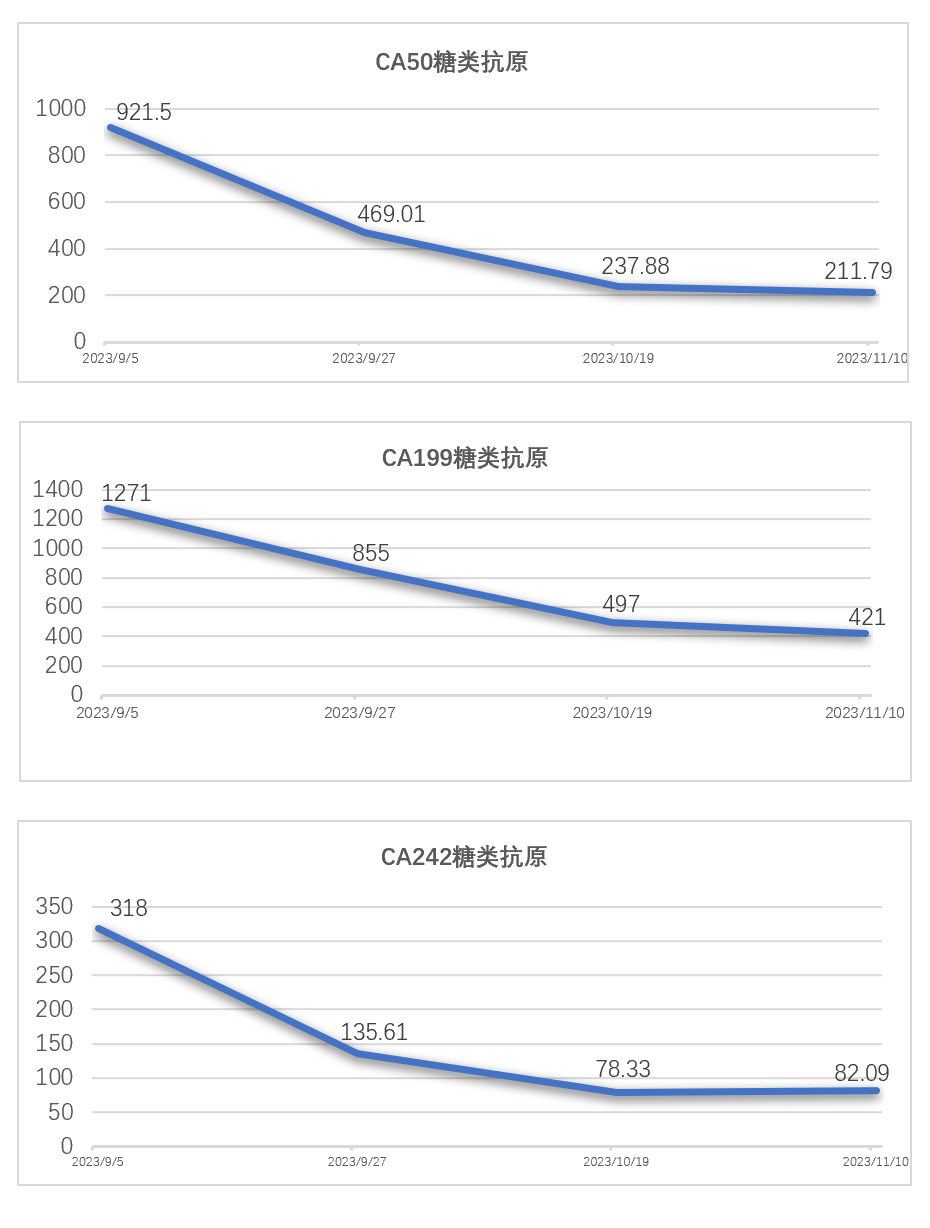
图4:布拉格治疗前后肿瘤指标变化趋势图
张力元教授点评
维迪西妥单抗是一种靶向HER2的抗体偶联药,可以特异性地识别和结合肿瘤细胞表面的HER2抗原,快速释放出细胞毒药物,即微管相关抑制剂(Monomethyl auristatin E,MMAE),从而高效杀伤肿瘤细胞,并能产生旁观者效应。基于维迪西妥单抗的药物作用机制,以及放疗和免疫治疗的特点,三者可能存在协同作用。本课题组在布拉格治疗的基础上增加了维迪西妥单抗的应用,试图实现以下三点。
1. 点面结合,广泛抗原暴露,产生更多的免疫应答效应,克服肿瘤异质性。放疗主要针对大肿块照射,不仅可造成肿瘤相关抗原释放,而且减少肿瘤负荷;而维迪西妥单抗以全身肿瘤细胞表面的HER2抗原为靶点,精准识别并杀伤肿瘤细胞,促进更多肿瘤抗原释放,增强免疫应答。
2. 抗微管类ADC药物可提高放疗疗效,通过维迪西妥单抗与放疗联合应用可产生放疗的增敏作用。
3. 维迪西妥单抗与PD-1/PD-L1抑制剂联合使用,具有协同增效的抗肿瘤活性,有助于形成有效的抗肿瘤免疫应答。基于以上理论基础,维迪西妥单抗的加入可能会放大肿瘤的免疫应答效应,维迪西妥单抗联合布拉格治疗有望进一步提高HER2表达的晚期难治性实体瘤的疗效。
本案例中,患者采用多线治疗,甚至在“DS8201”治疗失败后,继续采用适合剂量的RC48 ADC联合布拉格治疗再挑战,抗肿瘤获益明显。原因可能为:ADC类药物本质是细胞毒药物,单药使用疗效有限,而布拉格3.0治疗本质是免疫综合治疗,采用放疗与RC48 ADC点面结合更高效地促进肿瘤相关抗原的释放,源于放疗主要针对大肿块照射释放抗原,而RC48 ADC以全身肿瘤细胞表面的HER2抗原为多靶点,精准识别并促进更多异质性肿瘤抗原的释放。
此外,RC48 ADC作为布拉格增敏剂,与推荐剂量相比,剂量较小,耐受性较好,总体安全性良好。布拉格3.0治疗靶向HER-2表达(包括低表达)晚期难治性实体瘤(包括妇科肿瘤和胰腺癌),该研究的初步结果已于2023年中华放射肿瘤学年会上进行口头汇报,由衷地期望该研究入组早日完成、研究结果早日揭晓,为晚期肿瘤患者带来更好的获益。

陈伟武 医师
苏州大学附属第二医院(核工业总医院) 医师

徐美玲 主治医师
苏州大学附属第二医院(核工业总医院) 放疗科主治医师
江苏省免疫学会放射与免疫专委会委员
中华医学会第十八次全国放射肿瘤学年会口头报告
CRTOG第四届放射免疫(IR)病例分享全国总决赛冠军
中华医学会杂志社举办的“免疫放疗”病例全国总决赛冠军
点评嘉宾:张力元教授 苏州大学附属第二医院(核工业总医院)

张力元 教授
苏州大学附属第二医院(核工业总医院)主任医师/教授/博导
苏州大学附属第二医院(核工业总医院)院长助理
苏州大学附属第二医院(核工业总医院)肿瘤诊疗中心执行主任
苏州市政协医药卫生组副组长
中国肿瘤放射治疗联盟放射免疫工作委员会副主任委员
中国肿瘤放射治疗联盟放射免疫青年工作委员会主任委员
中华医学会放射肿瘤学分会放射生物学组委员
中国研究型医院学会2023年度“研究型人才”
江苏省免疫学会放射与免疫专委会主任委员
江苏省医学重点人才
江苏省“333”人才(第二层次)
主持4项国自然基金项目
苏州市魅力科技人物
苏州市卫生领军人才
查看更多