查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肝细胞癌(HCC)占原发性肝癌的 85%~90%,严重威胁国民的生命和健康。我国初诊 HCC患者多数为中晚期,已无法手术切除,系统性治疗是主要治疗手段。
近年来,HCC 系统治疗取得突破性进展,特别是以免疫检查点抑制剂(ICI)为代表的免疫治疗打破了分子靶向药物的单一治疗格局,而免疫治疗联合抗血管生成靶向治疗的策略更显示出优效性。
免疫治疗带来希望的同时,不良反应也需要加以注意。
ICI带来的免疫治疗特有的免疫相关不良反应(irAEs)为免疫系统激活所导致,它的机制和管理
方法与化疗和靶向治疗都完全不同,并无法预测。
irAEs 常累及皮肤、结肠、内分泌器官、肝脏和肺脏
等,大多数为G1/2,但是极少数情况下比较严重,甚至危及生命(<1%),比如免疫性肠炎、免疫性肺炎、免疫性肝炎以及免疫性心肌炎等。
与 程序性细胞死亡蛋白‑1(PD‑1)及其配体(PD‑L1)抗体抑制剂相比,细胞毒性T淋巴细胞相关蛋白 4(CTLA‑4)抗体抑制剂任何级别和≥G3 不良反应的发生率都更高。
PD‑1/PD‑L1 抑制剂的不良反应不存在剂量依赖性,荟萃分析显示任何级别和≥G3不良反应的发生率分别为 66% 和 14%,而 PD‑1 抑制剂≥G3 不良反应风险比 PD‑L1 抑制剂更高(OR=1.58)。
CTLA‑4抑制剂的不良反应发生呈剂量依赖性,荟萃分析显示任何级别和≥G3不良反应的发生率分别为 72% 和 24%。
免疫治疗常见不良反应主要包括以下几方面:
(1)皮肤:皮疹、黏膜炎;
(2)心脏:血压升高、免疫性心肌炎;
(3)消化道:恶 心、呕吐、腹泻、肠炎;
(4)内分泌异常:甲状腺炎、甲状腺功能异常、肾上腺功能异常;
(5)肺部:免疫性肺炎;
(6)肾脏:肾功能异常或不全;
(7)肝脏:转氨酶或胆红素升高、肝功能异常。
HCC 患者 ICI治疗后 irAEs 的整体发生与其他肿瘤患者无明显的差异,但免疫性肝炎有所增加。HCC 患者 PD‑1 单抗治疗后 14%~26% AST 升高(≥G3∶5%~10%),9%~24% ALT 升高(≥G3:2%~~6%);免疫双抗治疗后13%~20%AST 升高(≥G3∶4%~16%)8%~16%ALT升高(≥G3∶6%~8%)。
反应性皮肤毛细血管增生症(RCCEP) 为卡瑞利珠单抗特有的 irAEs,在 HCC治疗中发生率为 66.8%(均 G1/2),联合阿帕替尼或化疗则明显减少至 22.0%~29.5%。
HCC通常是在肝硬化背景下发生,患者可能伴有多种系统不适或者器官功能不全表现,并可能随着病情进展更加明显。这些症状和检查异常可能与irAEs的表现重叠,导致irAEs诊断和治疗的困难,不能及时识别而造成治疗的延误,或者过度诊断而不适当地中断ICI 治疗。因而,HCC 免疫治疗前应做好充分的基线情况评估,有助于irAEs的鉴别诊断,形成最佳治疗决策。
基线检查主要包括:
(1)一般情况:体格检查、询问患者的自身免疫性疾病、内分泌疾病及感染性疾病乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和人免疫缺陷病毒(HIV)等疾病史、个人史、家族史等;
(2)影像学检查:胸、腹和盆腔 CT 或者 MRI 检 查;
(3)血液学检查:血常规、生化、凝血功能、甲胎
蛋白、异常凝血酶原、感染性疾病筛查:HBV 血清
标志物五项、HCV 抗体(如肝炎标志物阳性,查
HBV‑DNA、HCV‑RNA)、HIV 抗体和抗原、淀粉酶、脂肪酶等;
(4)甲状腺功能检查,包括促甲状腺激素、游离甲状腺素等;
(5)垂体和肾上腺:早晨 8 点血浆皮质醇、促肾上腺皮质激素等;
(6)心脏:心电图、超声心动图、肌钙蛋白(cTn)、利钠肽(BNP)、肌红蛋白(Mb)或肌酸激酶(CK)、肌酸激酶同工酶(CK‑MB)、D‑二聚体;
(7)对怀疑脏器已有病变的患者结合临床补充其他附加检查。
ICI治疗前需完善病史、体格检查、实验室和影像学等检查,对肿瘤病情和基本器官功能进行评估(Ⅰb,A)。
毒性监测包括 ICI 治疗中监测和治疗后随访。部分毒性出现时间较晚,甚至在 ICI治疗结束后才出现。目前认为,ICI治疗结束后,应至少监测症状1 年。建议每次随访时均进行临床症状及不良事件症状的评估,包括体格检查、治疗期间定期复查血常规、生化、心电图、心肌酶谱和监测甲状腺功能、垂体和肾上腺功能、影像学检查等。
ICI 治疗中需评估临床症状体征,定期和不定期复查实验室指标和脏器功能评估,复查影像学检查,治疗后进行随访,警惕 irAEs,包括治疗结束后延迟出现的毒性(Ⅰb,A)。
对 于 HBV 相 关 性 HCC,只 要HBV‑DNA 可检测到,均应抗病毒治疗;对于HBsAg阳性的 HCC,即使 HBV-DNA 阴性,也应接受核苷(酸)类药物抗病毒治疗。对于病毒载量过高的患者,免疫治疗前应先进行抗病毒治疗降低病毒载量,建议治疗前HBV‑DNA<2000 U/ml;免疫治疗期间,每1~2个月复查HBV‑DNA(Ⅱb,A)。
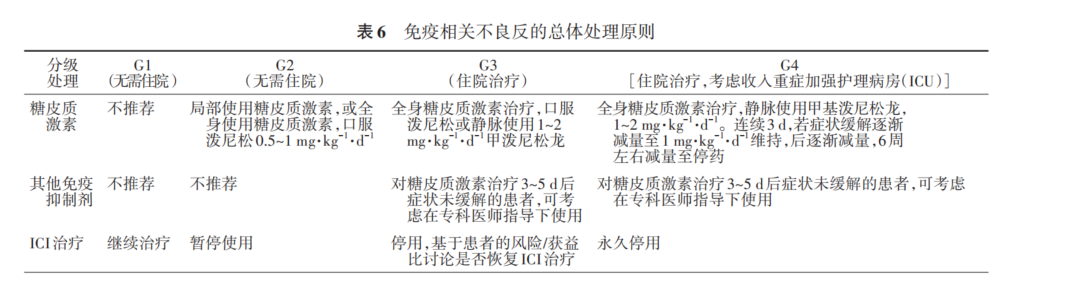
关于免疫治疗相关毒性的管理,目前已有多个国内外指南和共识,包括中国临床肿瘤学会(CSCO)《免疫检查点抑制剂相关的毒性管理指南》,美国国立综合癌症网络(NCCN) 《免疫疗法相关毒性管理》,欧洲临床肿瘤协会(ESMO)《免疫治疗毒性管理》等。CSCO《免疫检查点抑制剂相关的毒性管理指南》(2019)对于 irAEs 的总体处理原则按 4 级毒性划分进行分级管理。
糖皮质激素是大部分 irAEs 治疗的主要手段,在需要使用时应早期给予,延迟使用(>5 d)可能会影响部分irAEs的转归。
为了防止irAEs的反复,激素减量需缓慢进行,一般需>4周,有时会持续6~8周或更长。对于心脏、肺、肝和神经系统毒性,有时来时凶险,则首选高剂量糖皮质激素。对于甲状腺功能减退、糖尿病等一些内分泌毒性,采用替代激素治疗,而不需要糖皮质激素治疗。G2皮肤和内分泌毒性可继续ICI治疗。糖皮质激素治疗无效的情况下可考虑其他免疫抑制剂,包括英夫利西单抗、麦考酚酯、他克莫司及抗胸腺细胞球蛋白等。英夫利西单抗有潜在的肝脏毒性,在免疫性肝毒性患者中不考虑使用。
因irAEs中断ICI治疗后重启ICI治 疗 即 再 挑 战 ,其 导 致 irAEs 发 生 率 为 18%~52%,包括原 irAEs 复发或出现新的 irAEs。文献报道免疫性肝炎、肺炎、结肠炎的患者重启ICI治疗和再挑战使用 CTLA‑4 抑制剂可能 irAEs 发生率更高。除少数情况外,G2 irAEs 经处理降为≤ G1,且泼尼松剂量≤10 mg/d(或等效剂量),可考虑重启ICI。
重度和危及生命的irAEs,尤其是G3/4的心脏、肺、神经毒性,必须永久停用此类 ICI 治疗。对于初始 ICI治疗应答的患者,鉴于疗效持续性和毒性风险,ICI重启可能并不推荐。
重启ICI治疗尽量选择不同类型的ICI治疗药物,如将CTLA‑4抑制剂改为PD‑1/PD‑L1抑制剂。针对不同器官的irAEs重启ICI治疗的指征可能有所不同,遵循指南建议。关于免疫治疗肝毒性的 ICI 重启,国内外指南在G3 毒性再挑战推荐上存在差异。对于 G3 免疫性肝毒性(ALT/AST=5~20 倍正常上限或总胆红素> 3倍正常上限),特别是胆红素升高,ICI再挑战需特别谨慎。
ICI 治疗的再挑战需要从风险和获益两个角度出发,结合初始免疫治疗 irAEs 的类型、严重程度和疗效,有无其他肿瘤替代治疗方法等综合考虑(Ⅲ,A)。
内容家选自《肝细胞癌免疫治疗中国专家共识(2021版)》
查看更多