查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






解放军总医院消化内科令狐恩强教授
又是一年盘点季,中国医学论坛报社特别策划了“中国医学年度网络盛典”,邀请医学领域40余位知名专家梳理学科年度进展。
在过去的几年,由于技术的进步,消化内镜新技术及临床应用呈井喷式发展。2017年,消化内镜又有哪些新进展?在2018年1月4日播出的“消化肝病专场”中,我们邀请到解放军总医院消化内科令狐恩强教授对该领域进行盘点。在本期《消化·肝病周刊》,令狐教授又为广大读者撰写了盘点文章,详见D1-4版。
超声内镜的诊断应用
2017年,超声内镜(EUS)诊断方面出现了多项重要的技术进展,EUS应用范围进一步扩大,诊断精度进一步提高,从而对临床产生了直接影响。
1. EUS引导下胆管镜的应用
2017年,解放军总医院消化内科令狐恩强团队的一项研究显示,经EUS穿刺针芯将胆管镜送进胰腺囊性肿瘤的囊内,观察囊内结构,以诊断囊性肿瘤性质。研究结果显示,树枝状血管多见于浆液性囊腺瘤,乳头结构多见于黏液性囊腺瘤。该项技术明显提高了胰腺囊性肿瘤术前精确诊断。
2. 经穿刺针芯的共聚焦内镜技术
经穿刺针芯的共聚焦内镜技术(n-CLE)能够实现“活体光学活检”,目前已经应用于胰腺癌、胰腺囊性病变和淋巴结疾病的诊断。国内外nCLE的研究主要仍集中应用于胰腺囊性病变的鉴别诊断,尤其是鉴别胰腺囊性病变的良恶性,以及鉴别胰腺囊性肿瘤的性质是黏液性的还是非黏液性的方面,诊断的准确度很高。
在2017年最新的一项盲法临床研究中,研究者选取29例胰腺囊性病变患者的nCLE资料,由6名有30例以上nCLE经验的EUS专家进行评估,并与外科术后病理结果进行对照。发现nCLE诊断胰腺囊性病变的敏感性、特异性及准确性分别为95%、94%和95%。
但是,目前nCLE并不能完全取代EUS引导下的细针穿刺(EUS-FNA),研究样本量较少。然而,该技术在FNA无法确诊的病例中,能够起到很好的补充诊断作用。如果能够将nCLE与囊内镜、囊液分析以及EUS-FNA一起联合应用,则可更为准确地的诊断胰腺囊性肿瘤。
3. EUS引导下囊内活检术
EUS引导下的囊内活检术是经过19 G的穿刺针的孔道,将微型活检钳送到胰腺囊性病变的腔内,进而在EUS的引导下,对囊壁进行活检取材,实现组织病理学的诊断(图1)。
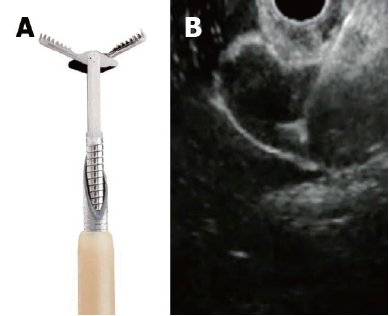
图1 EUS引导下的囊内活检(A:张开的微型活检钳;B:在EUS下,活检钳经穿刺针孔道送至囊性病变腔内)
初步的小样本研究结果显示,该技术诊断胰腺囊性肿瘤的特异性很高,但是敏感性较低。因此,该项技术可以对EUS-FNA和囊液的细胞学检查进行有益的补充。
4. EUS引导下门静脉穿刺术
EUS引导下穿刺门静脉是目前EUS诊断领域的一个新的热点。
已经有学者进行了初步的动物实验研究,对EUS穿刺门静脉后可以开展的技术进行探索,例如门静脉压力梯度的测定,门体分流术置入支架,对门静脉栓子进行穿刺活检和门脉造影术等(图2)。

图2 EUS引导下门静脉穿刺活检
目前已经有临床报告,在EUS引导下穿刺门静脉后,留取血液标本进行分子学检查,对肿瘤进行分子学分期,以指导临床治疗方案的选择。
超声内镜的治疗应用
EUS引导下的微创治疗是EUS技术发展的热点,在该领域,2017年又出现了多项突破性的新技术。
1. EUS引导下聚桂醇消融术治疗胰腺囊性肿瘤
胰腺囊性肿瘤的治疗,传统以外科手术治疗为主,但外科手术创伤大,并发症多,且有一定死亡率。解放军总医院消化内科令狐恩强团队开展了EUS引导下应用聚桂醇消融术治疗胰腺囊性肿瘤的开创性临床研究,对胰腺囊性肿瘤进行微创治疗。
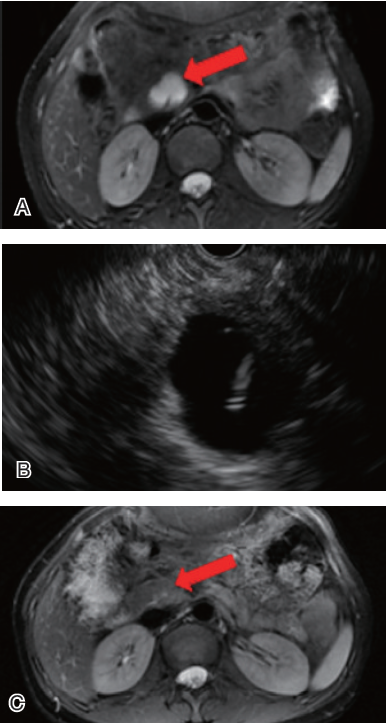
图3 EUS引导下消融术(A:术前磁共振成像,胰头有2.8 mm×2.4 mm囊性病变;B:EUS引导下聚桂醇消融;C:术后胰头病变消失)
该研究针对小的胰腺囊性肿瘤进行EUS引导下聚桂醇消融术,术后肿瘤明显缩小率为79.3%,完全消失率为51.7%(图3)。未发生严重并发症,轻症胰腺炎发生率为6.1%。该研究初步证实了EUS引导下应用聚桂醇消融术治疗胰腺囊性肿瘤的可行性、安全性和有效性。该技术为胰腺囊性肿瘤的治疗提供了一种全新的治疗方法。
2. EUS引导下胆管引流术
EUS引导下胆管引流术(EUS-BD)作为经内镜逆行胰胆管造影术(ERCP)手术失败患者的补救方案逐渐受到重视。目前有肝胃吻合术(HGS)和胆总管十二指肠吻合术(CDS)两种方法,但究竟哪种方法更好,尚存争议。
一项最新的荟萃分析纳入了对比HGS和CDS的10项研究,共434例患者,CDS和HGS手术成功率分别为94.1% 和93.7%[比值比(OR)=0.96],临床成功率分别为88.5%和84.5%(OR=0.76)。 二者不良事件发生率无差异(OR=0.97)。研究者认为,EUS-CDS和EUS-BD同样安全和有效,均有很高的手术成功率和临床成功率。具体方式的选择取决于患者的解剖学结构。
3. EUS引导下胃肠吻合术
EUS引导下胃肠吻合术(EUS-GJ)是一种治疗胃流出道梗阻(GOO)的有效方法(图4),可使患者避免接受外科手术治疗。腹腔镜下胃空肠吻合术(Lap-GJ)是治疗GOO的传统标准术式。

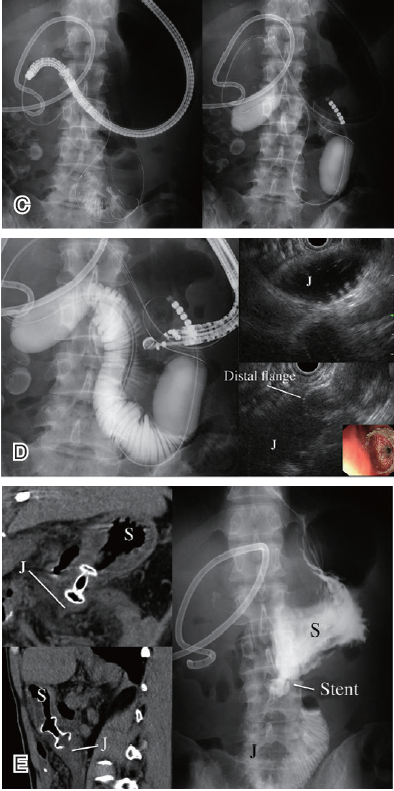
图4 EUS引导下胃肠吻合术(A:EUS引导下胃肠吻合术,箭头A为胃十二指肠吻合术,箭头B为胃空肠吻合术; B:带电切功能的支架释放系统; C:EUS引导下双球囊法胃肠空吻合术,左图经胃镜将导丝置入,右图沿导丝置入双球囊导管并冲开球囊; D:一步法EUS引导下双球囊法胃肠吻合术,左图X线下盐水和造影剂填充后显影的扩张的空肠,右上图EUS下可见扩张的空肠,右下图EUS下见支架远端侧翼张开,右下角图内镜下见支架近侧端侧翼张开; E:EUS引导下双球囊法胃肠吻合术后,左图CT下显示金属支架连接胃和空肠,右图上消化道造影消失造影剂由胃顺畅流入空肠。)
一项最新的多个国家合作的临床研究纳入了54例患者,对比EUS-GJ和Lap-GJ两种术式。结果显示,EUS-GJ的手术成功率为100%,Lap-GJ为88%(P=0.11),Lap-GJ的不良事件为41%,EUS-GJ为12%(P=0.0386)。
研究者认为,尽管EUS-GJ组患者的病情更加复杂,但两组的疗效相似,EUS-GJ组的不良事件发生率更低。因此,EUS-GJ是安全、有效的GOO微创治疗方法。
4. EUS引导下治疗胆囊疾病
EUS引导下胆囊引流术被广泛报告用于治疗急性胆囊炎。一项研究采用EUS引导下胆囊穿刺后,置入金属支架,建立胃或十二指肠球部与胆囊间的通道,经该通道实现胃-胆囊吻合术和十二指肠-胆囊吻合术,可用于胆囊结石、胆囊息肉等疾病治疗。
一项研究纳入7例胆囊结石患者,经EUS引导下胃-胆囊吻合术(3例)和十二指肠-胆囊吻合术(4例),成功进行了7例胆囊结石取出术和2例胆囊息肉切除术。该研究中还对5例合并胆总管结石者同时进行了十二指肠乳头切开术。术后4周,胆囊结石无残留,且胆囊功能良好。该研究初步显示EUS引导下治疗胆囊结石和胆囊息肉可行、安全和有效。
内镜隧道技术
内镜隧道技术是通过内镜在消化道黏膜下建立位于黏膜肌层与固有肌层间的一条通道,并经该通道进行黏膜层侧和固有肌层侧病变的诊疗(图5)。内镜隧道技术主要包括:对黏膜侧病变的治疗技术内镜黏膜下隧道法剥离术(ESTD),对固有肌层侧的治疗技术经口内镜肌切开术(POEM)和黏膜下隧道内镜下切除术(STER)。
图5 内镜隧道技术模拟图
1. G-POEM
目前应用POEM治疗贲门失弛缓症已十分成熟,中远期疗效良好。近来有研究将POEM拓展到胃,切开幽门括约肌治疗难治性胃轻瘫,即G-POEM。
所谓胃轻瘫就是因人体胃部动力不足,胃肠蠕动能力下降,导致胃排空障碍而使得食物在胃部停留时间延长。
胃轻瘫除了发生在贲门癌等近端胃术后患者中,同时也是糖尿病并发症之一,因高血糖导致神经系统麻痹,使幽门产生痉挛,长时间处于收缩状态,食物无法通过幽门到达小肠,长期如此,导致胃部蠕动变差,胃动力不足,就产生了胃潴留,表现出胃食管反流、腹胀、腹痛、呕吐等症状。而通过内镜隧道技术切开幽门括约肌,增大胃流出道,使胃内容物通过幽门可有效治疗胃轻瘫,改善患者症状。
目前国内外有少量文献报告G-POEM,初步研究显示其近期疗效尚可,中远期疗效及大宗病例研究尚有待于进一步研究。
2. STER与外科手术的比较
以前,经食管隧道切除食管及贲门固有肌层肿瘤的研究主要集中在内镜手术方法、适应证和并发症等方面。随着STER的手术越来越多,技术越来越成熟,许多学者认为STER已取代外科及腔镜手术成为食管及固有肌层肿瘤的治疗首选。
对STER和胸腔镜手术进行比较的随机对照研究显示,STER的手术时间显著短于胸腔镜手术,且经STER治疗的患者术后疼痛评分明显低于胸腔镜手术治疗者。在病变整块切除率和并发症发生率方面,STER和胸腔镜手术间无统计学差异。
对于<3.5 cm的病变,STER和外科胸腔镜均可达到100%的整块切除率,但STER在操作时间及术后疼痛方面更具优势。
因此,直径<3.5 cm的病变适合STER治疗,而直径>3.5 cm的病变因STER术中的隧道腔内操作空间不充足,手术时间会延长,并发症发生率增加,适合胸腔镜切除。
人工智能的应用
人工智能因其强大的自学能力,已被用于医学领域。在消化内镜方面,人工智能的应用在近几年得到广泛重视,也标志着内镜技术的发展进入了智能时代。目前关于人工智能在消化内镜应用的研究主要集中在磁控胶囊胃镜、胃肠镜检查肠息肉的检出及智能治疗内镜方面。
1. 磁控胶囊胃镜
磁控胶囊胃镜系统包括胶囊内窥镜、体外磁控系统、便携记录器和电脑工作站。通过ESNavi软件可对病变大小进行测量,并可进行远程阅片及数据的储存。
磁控胶囊胃镜云阅片系统通过互联网提升信息传输和处理效率,将检查覆盖区域从点拓展到面,实现检查与诊断功能分离,依托消化道智能影像采集技术和互联网,践行分级诊疗。
利用云平台技术连接医生、检查者和检查机构,实现资源共享,解决医疗资源的不平衡。在云平台系统上还可实现现有医疗资源的整合,通过信息共享,实现有限医疗资源的动态共享与重构。
另外,利用大数据和人工智能技术还可降低阅片成本,实现智慧医疗,解决胶囊胃镜普查带来的阅片量激增的问题。安翰磁控胶囊胃镜检查中,通常1个病例就可以产生2万多张影像,每年产生数10亿的影像数据,而医生精力有限,海量数据带来数据处理和精准化分析等新的挑战,采用人工智能技术进行分析处理,可提高疾病筛查准确性和效率。
2. 胃肠镜检查
为解决高水平内镜医生的不足、提高内镜操作效率及精确度,解放军总医院消化内科与中国科学院沈阳自动化研究所机器人学国家重点实验室共同研发了“软式内镜操控机器人”,并于2017年12月20号在解放军总医院内镜中心成功进行了世界首例胃镜检查。检查过程中操作顺利,镜下图像清晰,操作准确性不亚于人工操作。这也意味着内镜从人工操作进入智能化时代,提示内镜发展的新革命已到来。
3. 肠息肉的检出
肠息肉可分为增生性息肉、腺瘤性息肉,其中腺瘤性息肉需要内镜下切除,而增生性息肉可随访观察。在肠镜检查中,由于肠腔面积大、褶皱多,部分肠息肉不在内镜医师的视野内以及受限于内镜医师的经验,肠息肉的漏诊在所难免。国内外已有用人工智能来提高肠息肉的检出及鉴别(图6)。
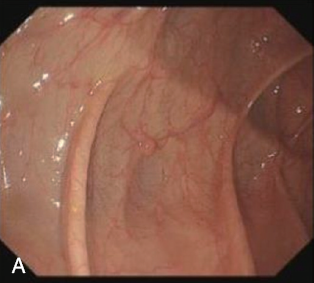
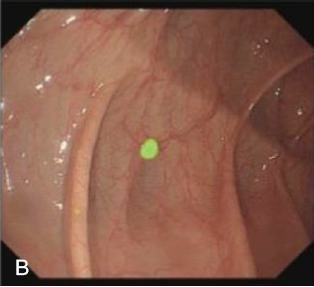
图6 人工智能肠镜检出肠息肉(A:常规肠镜;B:人工智能肠镜)
美国学者研究通过分析14000幅肠镜图像(其中1/3为息肉,2/3为非息肉)的特征,并对计算机进行训练。计算机检出肠息肉准确率可达98.65%,灵敏度可达98.79%,特异度可达98.52%。
我国香港的一项研究通过分析1104幅非息肉白光和窄带内镜(NBI)图像、826幅息肉NBI图像(其中263张为增生性息肉,563张为腺瘤)的特征,并训练计算机,再对比研究人工智能和内镜医师鉴别肠息肉的水平,二者准确率相似(87.3%对 86.4%),但人工智能的灵敏度(87.6% 对77.0%)和特异度(85.9% 对74.3%)更高。
这些研究表明人工智能可辅助内镜医生对肠息肉的诊断。智能结肠息肉检测还获得了美国2017 年美国胃肠病学会(ACG)国际奖。
4. 智能治疗内镜
在传统内镜治疗中,医生采用转盘工具将内窥工具导入患者体内,经常要用一种“扭曲的”姿势来完成手术,还可能会长时间受X射线辐射。而智能治疗内镜不仅用远程操作的方式避免了这些情况,而且还可以增加治疗的精确程度。
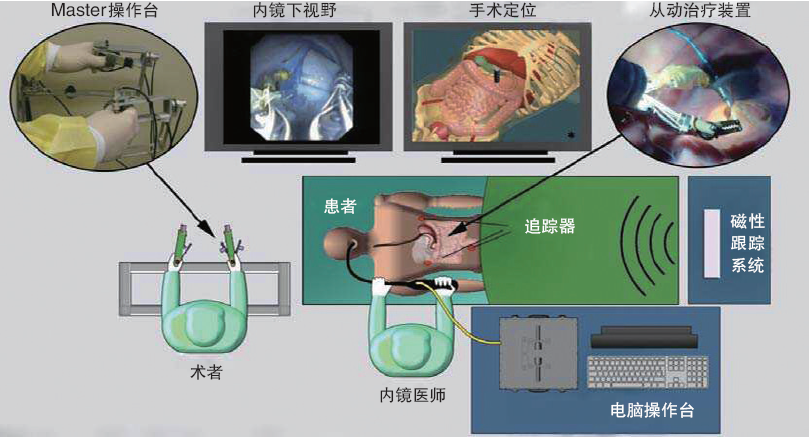
图7 智能内镜操控机器人“MASTER”示意图
新加坡研发的智能内镜操控机器人“MASTER”(图7)在猪体内进行了内镜黏膜下剥离术(ESD)试验研究(图8),其中15例体外实验,5例体内实验。术后显示所有病变均完整切除,无出血及穿孔等并发症,证明了智能治疗内镜的精准性及可行性。
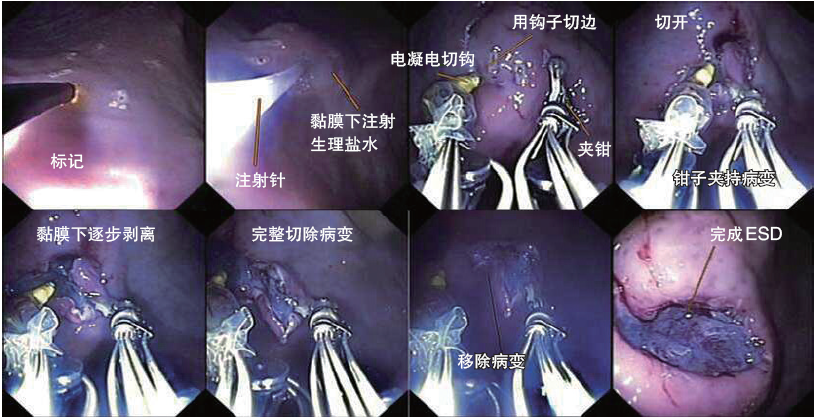
图8 “MASTER”进行ESD术的过程
新近研究的ARES 机器人向实现远程操控的方向持续发展,医生可先通过 2D 的 计算机体层摄影(CT )扫描生成 3D 图像,通过电磁感测器、加速器和自动影像追踪器等,对设备进行定位,提高手术精确程度,且不需要借助外部成像来引导内视镜,手术人员也能避免暴露在有害的 X 光辐射下。
ARES 机器人通过人体自然开口(尤其是口腔),来解决包括消化系统在内的种种疾病。据《科技纵览》(IEEESpectrum)报告,这款机器人系统目前至少已开展了1次成功的临床手术。
内镜下减重术
目前肥胖和代谢疾病已成为全球公共卫生健康问题。与传统外科减重手术相比,内镜下减重手术具有微创、可逆性和可重复性强等优势。根据手术作用原理,内镜下减重手术可分为限制摄入型手术、吸收不良型手术和混合型手术。
1. 胃内球囊术
胃内球囊术 可以通过减少胃内容积和引起早饱感,该手术目前已经成为内镜下减重手术的常用术式之一。
在一项对胃内球囊术进行的系统评价中,研究者对3068例患者进行了评价,结果显示,在球囊被取出时,患者多余体重减少的百分比(EWL)为31.2%,且2型糖尿病、高血压以及高血脂等合并症得到明显缓解。但球囊取出后患者体重是否反弹,目前尚无定论。
2. 内镜下袖状胃成形术
内镜下袖状胃成形术是基于OverStitch的内镜下一种缝合系统,对胃壁可进行一系列间断或连续的全层胃组织缝合,使胃形成袖状而减少胃容量(图9)。
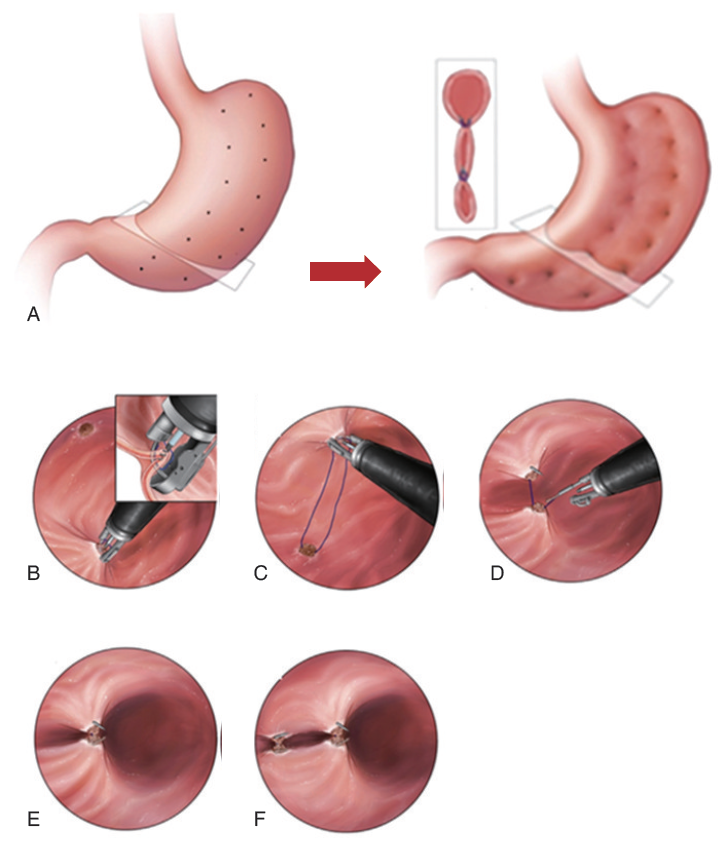
图9 内镜下袖状胃成形术示意图(A:示意图;B-F:通过对胃壁进行全层缝合,使胃形成袖状从而减小胃容量。)
有研究报告,术后1年,患者平均体质指数(BMI)从(37.7± 4.6)kg/㎡ 降至(30.9 ± 5.1)kg/㎡。相对于传统减重手术,该技术不需要切除胃组织,长期随访未出现BMI反弹。
但是,该术式目前尚不能作为独立的减重手术,而是被作为一种治疗手段参与到肥胖症的多学科综合治疗中。
3. 内镜下十二指肠空肠旁路袖管术
内镜下十二指肠空肠旁路袖管术是内镜下吸收不良型手术的典型代表。该技术在内镜下将一条袖管置入胃肠道内,从十二指肠延伸至近段空肠。它创造了一个吸收屏障,延迟食物与消化酶的混合,从而产生与胃旁路术相似的减重效果。
在一项多中心随机对照试验中,研究者对31名接受旁路袖管术的肥胖者和15名饮食控制肥胖者进行观察,发现在EWL以及糖化血红蛋白等指标上,手术组均明显优于饮食控制组。但是,由于袖管置入术难度大,存在肝脓肿等并发症风险,目前仍有待进一步研究。
内镜早癌筛查
各类恶性肿瘤中,消化道恶性肿瘤的发病率一直居高不下。为减少消化道肿瘤带给人类的痛苦,我们不仅要致力于疾病的治疗,更要注重疾病的早期筛查。消化内镜在消化道早癌筛查方面至关重要。
一项来自日本的研究表明,消化内镜对早期胃癌的检出率可高达80%。虽然应用图像增强技术后对胃早癌的检出率与白光内镜相比无统计学差异,但仍然建议在胃早癌的筛查中同时应用白光内镜和图像增强技术。
一项澳大利亚学者的研究结果表明,对炎症性肠病患者进行结肠镜监测,可减少结直肠癌发病率。
在消化内镜检查中,对于息肉等小病变,会有一定的漏检率。近期有研究显示,一种计算机辅助系统可利用彩色小波和内镜视频的特征来提高胃肠道息肉的检出率,且可以帮助区分结肠腺瘤和增生性息肉。
《中国医学论坛报》2018年1月25日D1-4版
查看更多