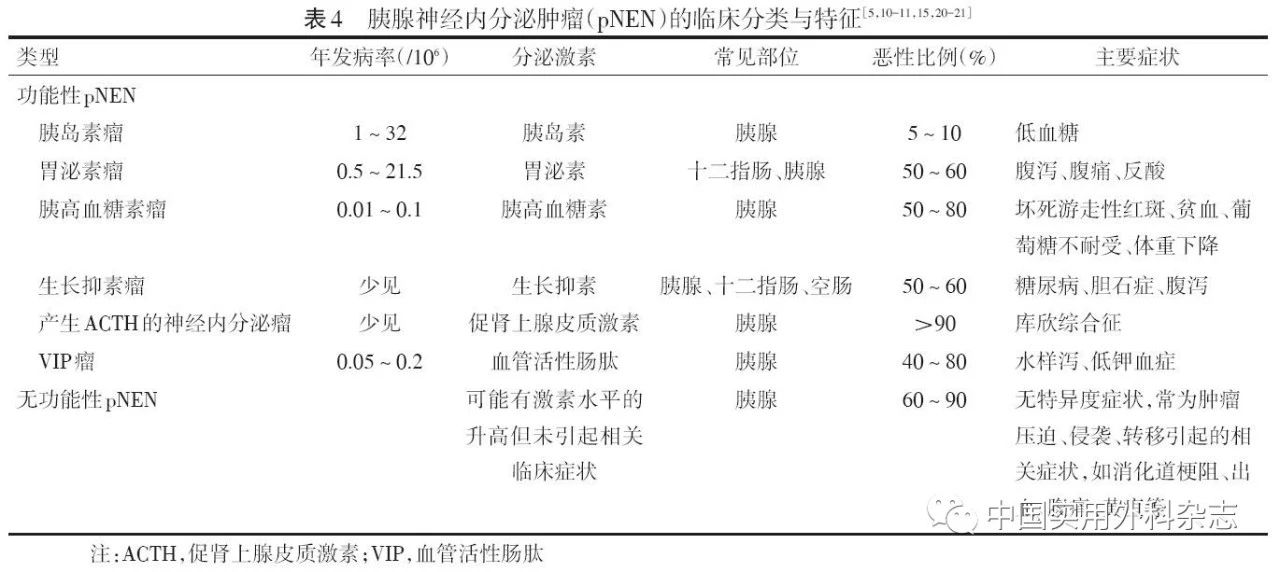
3.1 临床特点 功能性pNEN患者常合并激素分泌增多引起的相应临床症状或特征性体征,如胰岛素瘤多引起Whipple三联征,胰高血糖素瘤可引起皮肤坏死游走性红斑,ACTH瘤可导致满月脸、水牛背、皮肤紫纹等库欣综合征表现。无功能性pNEN患者多无特异度症状,常因肿瘤的占位效应、侵犯邻近器官、出现远处转移所导致的相关症状为首发表现。遗传相关性pNEN患者常发病年龄小、存在肿瘤家族史、合并其他器官肿瘤或存在相关异常表现。
3.2 外周血生物标记物检查 血清(血浆)嗜铬粒蛋白A(chromogranin A,CgA)是神经内分泌肿瘤最重要的通用肿瘤标记物,其不仅可用于协助诊断,亦可用于评估部分患者的疗效及预后。CgA诊断神经内分泌肿瘤的灵敏度和特异度可达73%和95%,联合检测CgA及胰腺多肽可进一步提高诊断的灵敏度。CgA对神经内分泌肿瘤的诊断效能可能受肿瘤种类、原发灶部位、肿瘤分化程度、肿瘤负荷、肿瘤分泌功能、患者临床状态、实验室检测方法等因素的影响。如血浆CgA水平对神经内分泌癌患者诊断的准确率较低,胰岛素瘤患者的血浆CgA水平升高亦不显著,而合并高血压、肾功能不全、肝硬化、质子泵抑制剂(proton pump inhibitors,PPI)服用史等患者的CgA水平存在异常升高。因此,临床上对CgA检测的应用及结果解读需要更加谨慎和全面。
在部分高级别神经内分泌瘤或神经内分泌癌患者中神经元特异性烯醇化酶(neuron specific enolase,NSE)显著升高,且NSE的基线水平及治疗后变化与患者预后显著相关,可能有助于神经内分泌癌及晚期高级别神经内分泌瘤患者的诊断及随访。血清降钙素原水平在G3级神经内分泌瘤和神经内分泌癌患者中多升高,且与疗效及预后密切相关,故亦可用于此类患者的疾病监测。甲胎蛋白、癌胚抗原、CA125、CA19-9等肿瘤标记物在部分G2、G3级pNEN患者中升高明显,且对肿瘤的转移、复发及患者的不良预后有一定的预测价值。此外,NETest作为基于外周血mRNA测序、分析技术的新型检查手段,对神经内分泌肿瘤的诊断准确率可达95%~96%,在疗效监测方面亦有出色表现,在未来有可能取代传统生物学标记物检查。
3.3 功能性pNEN的实验室检查 诊断功能性pNEN时,应根据肿瘤类型有针对性地进行生化指标、相应激素的检测,甚至进行激发试验。
对疑诊胰岛素瘤的患者,若血糖≤3.0 mmol/L(或≤550 mg/L)时,胰岛素水平>3.0 μU/mL、C肽浓度≥0.6 μg/L、胰岛素原水平≥5 pmol/L,即可诊断为内源性高胰岛素血症;必要时还可进行72 h饥饿试验进一步明确诊断。此外,诊断过程中应注意鉴别其他可能导致低血糖的疾病,如胰岛素自身免疫综合征、胰岛细胞增生症和其他非胰岛素原因导致的低血糖(如肾上腺皮质功能不全、营养不良等)。
对疑诊为胃泌素瘤的患者,若患者空腹血清胃泌素水平超过正常值上限的10倍且胃液pH≤2,则支持该诊断;若患者同时合并难治性消化性溃疡等症状,则可诊断为卓-艾综合征。然而,对于胃液pH≤2但空腹血清胃泌素水平低于正常值上限10倍的患者(约占60%),尚需要检测其他标记物,或检测基础胃酸排出量,或进行促分泌试验(如胰泌素刺激试验、钙剂刺激试验)等协助诊断(2A,Ⅱ级推荐)。服用PPI可使患者空腹血清胃泌素水平升高,故应至少在检查前1周停止使用,但需谨慎评估停药时机,以避免加重消化性溃疡导致出血、穿孔。此外,对于所有胃泌素瘤患者,均应在初诊和随访中检测甲状旁腺激素、血钙和催乳素,以协助筛查MEN1。
对于其他罕见功能性胰腺神经内分泌肿瘤,应根据患者临床症状进行相应激素的检查,如怀疑为胰高血糖素瘤应检测胰高血糖素,怀疑为产生ACTH的神经内分泌瘤应检测血浆ACTH、24 h尿游离皮质醇、血浆皮质醇分泌昼夜节律并进行地塞米松抑制试验。
3.4 影像学检查 影像学检查是pNEN诊断、定位、分期及疗效评估的重要手段,并可协助肿瘤定性及鉴别诊断。每种影像学检查均有各自的优势,通过联合应用多种检查手段进行优势互补,可提高pNEN诊断的准确率,并为治疗方案及随访计划的制定提供更多有效信息。常用的影像学检查方法包括CT、MRI、常规体表超声、超声造影、内镜超声(endoscopic ultrasound,EUS)、术中超声、生长抑素受体显像(somatostatin receptor imaging,SRI)、正电子发射型计算机断层显像-CT(positron emission tomography-computed tomography,PET-CT)及选择性血管造影等。
多期增强CT检查对pNEN的诊断及分期具有重要意义,可作为多数pNEN患者的首选影像学检查方法。多期增强CT检查对pNEN原发灶诊断的灵敏度和特异度平均为82%和96%,对肝转移灶诊断的灵敏度和特异度平均为84%和92%。此外,CT检查在预测肿瘤病理学分级、评估疗效等方面亦有重要作用。基于增强CT图像特征及患者临床信息的影像组学方法在预测pNEN的病理学分级方面的准确度很高,且肿瘤的CT图像特征及治疗后改变对疗效评估亦有重要意义。胰岛素瘤的最大径通常较小、强化方式多样,约有24.9%的胰岛素瘤在常规增强CT图像中表现为等强化。相比之下,灌注CT检查可捕捉到一过性高强化的肿瘤并为等强化的肿瘤提供定位信息,灌注CT+常规CT检查诊断胰岛素瘤的灵敏度和特异度分别为94.6%和94.7%,优于单独使用常规CT检查;但上述扫描方案增加了患者的辐射剂量、对比剂用量及扫描时间,而通过自定义容积图像处理后的灌注CT对胰岛素瘤的诊断优于常规CT检查,且图像质量不劣于甚至优于常规CT检查,有望单独用于胰岛素瘤的诊断。此外,灌注CT图像亦可显示pNEN的微血管密度,且与患者预后相关。对肌酐清除率低(<30 mL/min)、对造影剂过敏等患者,可行其他影像学检查协助诊断;对于多发神经内分泌肿瘤(如MEN1)及常伴发胰腺外病灶的神经内分泌肿瘤(如胃泌素瘤等),需联合其他检查手段以进行充分评估。
MRI及弥散加权成像技术(diffusion-weighted imaging,DWI)同样是诊断、鉴别、评估pNEN的有效手段。由于其对最大径较小的pNEN及pNEN肝转移灶有较高的检出率,故可作为CT检查的补充手段。MRI(含DWI)对胰岛素瘤的检出率与灌注CT检查相当,但对肿瘤显示更佳,且能较好地反映肿瘤与主胰管的关系;小视野DWI的图像质量及对胰岛素瘤(尤其对最大径<1.5 cm的胰岛素瘤)的检出率相较常规全视野DWI又有进一步提高。MRI检查对胃泌素瘤的诊断灵敏度亦较高。在疾病评估方面,MRI检查对pNEN淋巴结转移有一定的预测价值,而应用肝胆特异度对比剂还可进一步提高MRI检查对肝脏转移灶的检出率。此外,对怀疑合并脑转移或骨转移的pNEN患者,亦可首选MRI检查。
常规体表超声检查易受多种因素的影响,故对pNEN原发灶的诊断价值有限,但其诊断肝转移灶的灵敏度和特异度较高。超声造影对组织灌注敏感,可协助pNEN的诊断及鉴别诊断,也可提高病灶穿刺活检的诊断准确率。EUS对pNEN的检出率平均可达86%,是诊断pNEN的灵敏方法,且具有一定的鉴别诊断价值。对于难以定位的胰岛素瘤和胃泌素瘤,推荐采用EUS仔细检查胰腺和十二指肠。同时,EUS引导下的细针穿刺活检对pNEN的诊断具有重要意义;基于EUS的局部介入治疗和黏膜下切除治疗,是最大径较小或位于特殊部位(如十二指肠等)的pNEN的有效治疗方法(2A,Ⅱ级推荐)。此外,通过EUS可以判断肿瘤与胰管及邻近血管的关系,进而评估手术可行性并指导选择手术方式。术中超声对pNEN的检出率亦较高,但其主要临床价值在于术中再次筛查并除外多发pNEN,以及在肿瘤局部切除或剜除手术中对pNEN进行精确定位,避免损伤胰管。
SRI主要包括单光子生长抑素受体闪烁显像和利用68Ga标记新一代生长抑素类似物(somatostatin analogue,SSA)的PET-CT。SRI是G1、G2级pNET的重要检查手段(2A,Ⅰ级推荐),亦可用于部分G3级pNET的检查(2A,Ⅱ级推荐)。SRI可能检出常规CT和MRI无法发现的病灶,因而在肿瘤的全身性评估、除外胰腺外病灶、制定治疗方案方面发挥作用。68Ga-SSA(包括DOTA-TATE、DOTA-NOC、DOTA-TOC等)结合PET-CT可提高神经内分泌瘤诊断的灵敏度。常规SRI诊断胰岛素瘤的灵敏度较低,可以胰高血糖素样肽-1受体为靶点,以提高肿瘤的检出率(2A,Ⅱ级推荐)。18F-FDG PET-CT诊断增殖缓慢的pNET(通常为G1或G2级)的灵敏度较低,但对增殖活跃的G3级pNET、pNEC及转移性pNEN具有较好的诊断灵敏度及分期价值。此外,18F-FDG PET-CT对肿瘤的生物学行为有一定预测价值,肿瘤对18F-FDG的摄取率越高,常提示其Ki-67指数越高、侵袭性越强,进而在选择治疗方案和判断患者预后等方面发挥作用。
选择性血管造影、经动脉钙剂刺激肝静脉取血检测胃泌素和胰岛素等检查手段因具有创伤性,现已很少使用,仅在其他影像学检查未能定位的pNEN患者中有一定诊断价值(2A,Ⅱ级推荐)。
3.5 病理学检查 病理学检查是诊断pNEN的金标准,推荐对所有pNEN病理标本进行HE染色、Ki-67/MIB1染色及其他免疫组化染色,并按肿瘤组织分化程度和细胞增殖活性进行分类和分级。神经内分泌肿瘤具有很强的时间及空间异质性,故对肿瘤原发灶及转移灶应力争分别进行组织学活检;对临床显著进展或病理学检查结果与临床判断不符的肿瘤,建议再次活检;对于异质性较高的肿瘤,可在PET-CT等影像学检查的指导下进行多点活检。
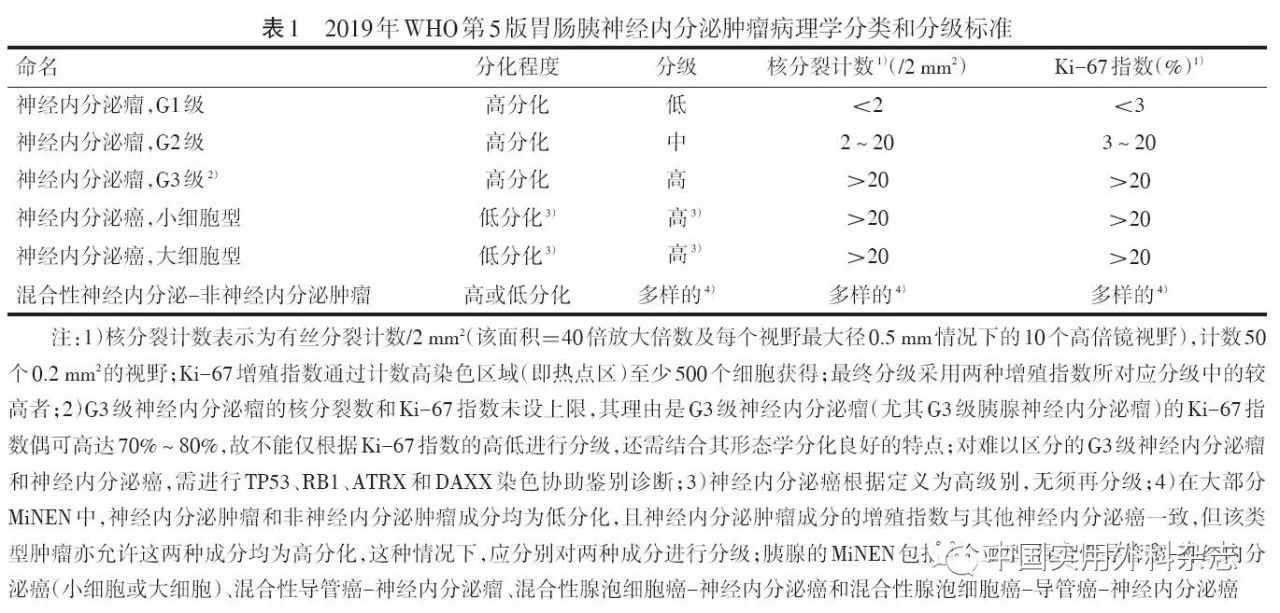
推荐采用有丝分裂计数和Ki-67指数两项指标判断细胞增殖活性,若两者不一致,则推荐采用分级较高者(表1)。手术标本比EUS引导下细针穿刺获得的标本具有更高的病理诊断价值,后者可通过增加穿刺次数以保证诊断的准确性。若活检标本取材有限(如<10个高倍视野),则推荐优先采用Ki-67进行评估分级,并备注有丝分裂计数(如:X个/Y个高倍视野)。其他免疫组化检查中,必做项目包括CgA、突触素(synaptophysin,Syn);选做项目包括SSTR2、CD56、MGMT、特定激素(如胰岛素、生长抑素、胰高血糖素、胃泌素等);神经内分泌瘤与神经内分泌癌鉴别诊断的相关项目包括TP53、RB1、DAXX、ATRX等。对于原发灶不明的转移性神经内分泌肿瘤,Isl1和PAX8阳性对肿瘤为胰腺来源具有一定提示意义。需要注意的是,功能性pNEN的诊断必须结合患者的临床症状和诊断性生化指标结果,特定激素的免疫组化检测结果并不能作为临床诊断的充分或必要条件。
3.6 遗传相关性pNEN 遗传肿瘤综合征常表现为常染色体显性遗传,故患者的肿瘤家族史对诊断具有重要价值。对肿瘤家族史阴性的pNEN患者,若其同时合并甲状旁腺、垂体、神经系统、视网膜、肾、肾上腺、皮肤等部位的肿瘤或异常表现,亦应高度怀疑此诊断。此外,遗传肿瘤综合征的致病基因主要包括MEN1、VHL、NF1和TSC1/2等,故患者的基因检测结果亦可协助此类疾病的诊断(2A,Ⅱ级推荐)。
综上所述,pNEN的诊断内容主要包括:(1)肿瘤的功能特点与遗传相关性;(2)肿瘤的分期;(3)肿瘤的病理学分类与分级。对功能性pNEN,可结合患者的激素过量症状或体征,选择相应的生化指标和激素水平检查。对遗传相关性pNEN,可结合患者的肿瘤家族史、其他器官合并肿瘤的情况及基因检测结果综合进行诊断。CgA、NSE等生物标记物通常用于协助诊断,并主要用于疗效监测和预后判断。影像学检查的重点在于评估肿瘤的位置、大小、数量及远处转移情况,具体检查方法和技术需根据肿瘤的特征进行选择。通常推荐首先进行CT或MRI检查,可结合灌注CT检查提高胰岛素瘤的检出率。对多发或较难定位的肿瘤,可通过EUS检查胰腺和十二指肠。核医学检查结果常受肿瘤相关受体表达丰度及肿瘤细胞增殖活跃程度的影响,SRI和68Ga-SSA PET-CT通常适用于中低级别的pNET,并可指导肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)等治疗方案的选择;18F-FDG PET-CT通常适用于高级别pNET及pNEC。病理学检查应包括肿瘤的分化、分级及细胞增殖水平[有丝分裂计数和(或)Ki-67指数],并至少进行CgA和Syn的免疫组化检测。