查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肺癌是中国乃至全球发病率和死亡率最高的恶性肿瘤,中国的肺癌发病率和死亡率均高于全球。中国国家癌症中心数据显示,2014年全国恶性肿瘤估计新发病例380.4万,其中肺癌78.1万例。2000-2014年全球癌症生存率变化趋势监测研究报告(CONCORD-3)显示,中国肺癌发病占所有癌症的22.6%,而5年生存率仅19.8%,与美国等发达国家有较大差距。
继靶向治疗后,肿瘤免疫治疗又为抗肿瘤治疗带来了新的革命性进展。在欧美国家,越来越多的基于大型Ⅲ期临床研究的循证医学数据证明免疫检查点抑制剂(PD-1/PD-L1单抗)在黑色素瘤、肺癌、泌尿系统肿瘤等数十个瘤种的治疗上能为患者带来生存获益,并获得国内外药监管理部门的快速审批。在国内,2018年我们迎来了4个PD-1单抗的获批,2019年将会有更多PD-1/PD-L1单抗获批进入临床应用。
在肺癌治疗领域,2018年,基于KEYNOTE-407和KEYNOTE-189两项重磅Ⅲ期临床研究结果,美国食品与药物管理局(FDA)正式批准帕博利珠单抗联合含铂标准化疗方案一线治疗鳞状非小细胞肺癌(NSCLC)适应证以及非鱗状NSCLC的拓展适应证。我国国家药品监督管理局(NMPA)也已分别于2018年9月12日和2018年10月31日正式受理了上述两个适应证的申请,并给予加速审批的认定,这意味着我国肺癌一线治疗即将迎来首个PD-1单抗。
在此背景下,未来的肺癌免疫治疗格局将如何改变?临床应如何合理规范使用PD-1单抗?PD-1单抗是否都相同?免疫联合化疗为什么要早用?一般疗程多长?
2019年1月6日,在CSCO肿瘤免疫治疗高峰论坛上,北京大学肿瘤医院方健教授、中国医学科学院肿瘤医院李峻岭教授和北京协和医院王孟昭教授接受了记者的专访。三位中青年专家对免疫治疗所展示的不同态度令人印象深刻,有兴奋,也有担忧,更有平和,但都畅谈了各自鲜明的观点,有相同,也有相左。

方健教授
KEYNOTE研究改变肺癌治疗格局
KEYNOTE系列研究结果都非常出色,也使帕博利珠单抗成为肺癌免疫治疗的标杆药物。尽管免疫治疗用于肺癌一线的临床研究有不少失败的先例,但KEYNOTE-407研究和KEYNOTE-189研究结果显示,帕博利珠单抗一线治疗晚期鳞状和非鳞NSCLC,相比传统化疗,显著提升了患者的总生存(OS)获益(图1~2)。

图1 KEYNOTE-407研究:帕博利珠单抗联合化疗方案一线治疗鳞状NSCLC较化疗有更优越的生存获益,死亡风险降低36%

图2 KEYNOTE-189研究:帕博利珠单抗联合化疗方案一线治疗非鳞NSCLC较化疗带来更优越的生存获益,死亡风险降低51%
值得注意的是,这两项研究都允许接受化疗的对照组患者在出现疾病进展后使用免疫治疗药物,即二线交叉,但测试组仍然显示OS有显著改善。这样的研究设计非常有胆量,可能也是基于研究者对帕博利珠单抗的信心。这是两项能够改变肺癌诊疗指南的研究结果,也将改变目前的治疗模式。
无需检测PD-L1,肺癌治疗更方便
帕博利珠单抗联合化疗一线治疗鳞状和非鳞状NSCLC的适应证一旦获批,意味着只要没有禁忌证的晚期NSCLC患者(EGFR/ALK驱动基因突变阴性),只要经济上可以承受,帕博利珠单抗联合化疗就可能会替代当前的化疗方案,成为一线标准治疗方案,这也是KEYNOTE-407研究和KEYNOTE-189研究对于晚期肺癌治疗的重要意义。
这两项研究的另一个重要意义在于,无论肺鳞癌还是非鳞癌,无论是PD-L1高表达 (TPS≥50%),还是低表达,或表达阴性,帕博利珠单抗联合化疗方案都能带来OS获益(图3~4),这意味着医生不需要让患者先检查PD-L1表达,就可以直接给予一线免疫联合化疗。
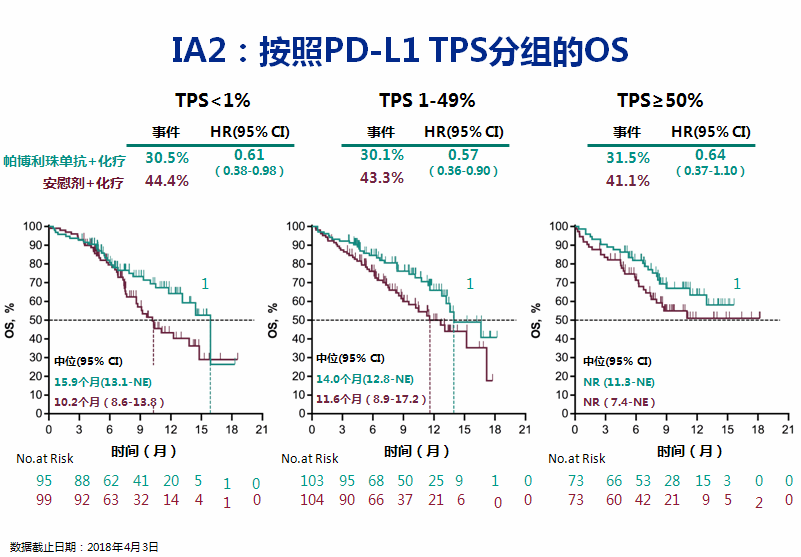
图3 KEYNOTE-407研究:无论PD-L1表达情况如何,帕博利珠单抗联合化疗方案一线治疗鳞状NSCLC较化疗都带来更优越的生存获益
尽管表达“劣势”的人群的治疗效率低一些,但也不能剥夺他们延长生命的机会。也就是说PD-L1检测是可以筛选出一些免疫治疗的优势人群,但对于预测治疗疗效,这一检测结果已不能决定是否给予PD-1单抗治疗了。
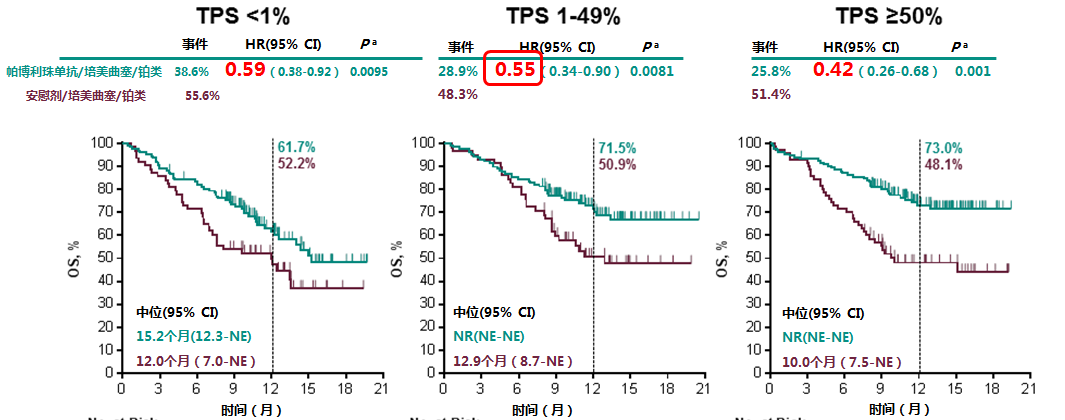
图4 KEYNOTE-189研究:无论PD-L1表达情况如何,帕博利珠单抗联合化疗方案一线治疗非鳞状NSCLC较化疗都带来更优越的生存获益
不同PD-1单抗不宜替换
同样是PD-1/PD-L1单抗,结构相似、作用机制也相似,但在没有自身的循证证据情况下,是不宜相互替换的。KEYNOTE系列研究取得了巨大成功,原因是其药物作用机制和临床试验设计都有独到之处,主要原因可能是作用机制,而药物结构的细微差异,可能也影响了疗效。
 李峻岭教授
李峻岭教授
免疫治疗给肿瘤医生带来新挑战
肿瘤免疫治疗是这几年新兴的一种肿瘤治疗手段,在使用PD-1单抗之前,要掌握两点,第一是要规避它的风险,就是治疗方案不要给患者带来进一步的伤害。这种伤害可能表现在以下方面:
● 如果一例晚期肺癌患者可以从PD-1单抗治疗中获益,如PD-L1高表达患者(TPS免疫组化≥50%),就应直接使用帕博利珠单抗。但是如果没有给患者推荐这一治疗方案,从某种意义上说也给患者带来了伤害,因为他没有获得这一延长OS的机会。
● 反之,如果患者不适合使用这种药物,如具有MDM2基因扩增的患者,使用免疫治疗可能还会有超进展的风险,这也是给患者带来了很大伤害的可能。
因此,在临床实践中,医生必须熟悉免疫治疗药物的循证医学证据,不断更新知识库,并且在用药过程中密切监测不良反应,早发现、早处理,避免给患者带来伤害。
不同厂家的PD-1单抗有差异
多个同类药物获批进入临床, 可能引发广泛的临床使用,但可能出现的滥用现象会令人担忧。
同为PD-1单抗,不同厂家的药物还是存在差异的。临床医生应该参考免疫治疗药物的Ⅲ期临床研究数据和国内外权威临床诊疗指南, 严格依据国内外药品监督管理部门批准的适应证来使用PD-1/PD-L1单抗。
如果一系列Ⅲ临床研究为我们带来了可靠的肺癌治疗循证医学证据,其治疗不同病理类型肺癌的适应证和带来的OS获益都是明确的,那医生就有“底气”给予推荐。
免疫联合化疗方案要尽早
合适的患者,免疫治疗应尽早使用,原因如下:
● 首先,患者早期一般状况好,治疗后生存时间长(图5)。
● 其次,治疗肿瘤的过程也是肿瘤细胞逃避打击的过程,最后“活下来”的肿瘤细胞都较难治;而尚未接受治疗的肿瘤没有经过药物的“洗礼”和筛选,处于原始状态,所以应在治疗一开始使用疗效较强的药物尽量给予肿瘤细胞毁灭性打击,这样后续就有时间清扫战场,如残存的主病灶可以进行局部放疗、后续维持治疗等,在肿瘤负荷低的情况下,患者可以获得更长期的生存。
● 第三,免疫联合化疗有可能规避或减少超级进展的发生。
● 第四,化疗药物作用快,免疫治疗作用慢,而化疗快速杀灭肿瘤细胞后,可以大量释放肿瘤抗原,这样有助于免疫治疗发挥作用。
● 第五,免疫联合化疗可以使肿瘤负荷很快降低,在这种情况下,疗效也会更好。
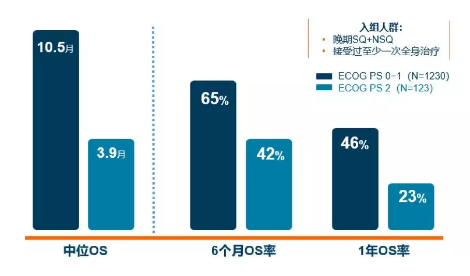
图5 2016年,在世界肺癌大会上公布的临床试验结果显示,PD-1单抗治疗功能状态评分(PS)为0或1的患者(功能状况好),相较治疗PS 2(功能状况差)的患者,可带来更优越的生存获益
目前,免疫治疗也在进行术后辅助治疗、新辅助治疗等的探索,已经慢慢渗透到肺癌治疗的各个阶段。希望未来免疫治疗能使越来越多的患者获益。

王孟昭教授
有关PD-1单抗和PD-L1单抗的疗效
PD-1单抗与PD-L1单抗的作用机制大致相同,都是阻断PD-1与PD-L1的结合,因此,理论上二者作用不会有太大差异;但两者也会有些细微差异。例如,肿瘤细胞除表达PD-L1外,也表达PD-L2。理论上PD-1单抗对PD-1和PD-L1信号途径阻断得更为彻底。但PD-L2的作用很弱,其在肿瘤免疫逃逸中的作用并不明确,所以免疫检查点仍以PD-1/PD-L1作为主要通道起作用。
有关PD-L1的检测
PD-1/PD-L1单抗二线治疗化疗失败后的患者一般不需要检测。但如果是一线应用免疫治疗,可能还是需要检测;尤其是单用帕博利珠单抗时,必须要进行检测。但如果帕博利珠单抗与化疗联合使用,目前来看可不必检测。
有关免疫联合化疗的协同作用
免疫治疗与化疗可能会存在协同作用。理论上,化疗杀伤肿瘤会释放新的抗原,而免疫治疗依赖肿瘤抗原呈递;此外,肿瘤细胞中的免疫细胞,会阻碍正常免疫细胞的进入,而通过化疗杀伤肿瘤后,有助于正常免疫细胞执行(消灭肿瘤)功能。不过,基于目前的数据,尚不能判断免疫治疗与化疗的作用是协同还是叠加。
哪些患者不宜首选免疫治疗
对于EGFR或ALK突变患者,目前不主张加用免疫治疗,因为靶向治疗也有多种选择,而免疫治疗在这些患者中的疗效并不肯定,却又会增加副作用。如果对靶向治疗都已耐药,而患者又不能耐受化疗,此时也可以考虑免疫治疗。
PD-1单抗要用多久
目前有两种停药的模式,一种是将免疫治疗使用至疾病进展,另一种是使用2年后停药,这两种模式都是公认可以接受的。
查看更多