查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





病例分享
刘伟康 医师
北京大学第一医院肝胆胰外科主治医师,医学博士
擅长肝胆胰外科疾病的微创治疗和综合治疗
基本情况
男性,62岁。因“上腹胀、腹痛、皮肤巩膜黄染伴血糖升高1月余”入院。
既往史
既往高血压3年余,口服药物控制可;新发糖尿病;右冠脉支架置入术后。
辅助检查
外院核磁示:十二指肠壶腹部可疑混杂T2WI稍高信号影,边界不清。考虑胰头区占位。
外院EUS:胰头及壶腹区可见低回声肿块,切面约20X19 mm,边界不清,回声不均,累及十二指肠且分界不清,胰头胰管截断伴后方扩张,最大直径约7-8 mm,胆总管胰腺段受压狭窄,胆总管十二指肠后段管壁环周增厚,以上胆总管扩张约10 mm。考虑为胰头、壶腹部低回声肿块累及十二指肠壁,十二指肠狭窄,胆总管扩张,胰管扩张。
生化检查:TBIL 136 μmol/L;DBIL 77 μmol/L;ALP 148 IU/L;γ-GGT 412 IU/L。
腹盆部增强CT检查:胰头占位,考虑恶性,胰腺癌?累及十二指肠降段可能性大,继发主胰管、肝内外胆管扩张;腹膜后及肠系膜根部多发略增大淋巴结。
图1 术前检查腹部CT
治疗经过
10-10 患者接受Whipple术,术后病理显示壶腹部中分化腺癌,侵犯十二指肠肠壁全层、胰腺实质及胆总管壁,有脉管癌栓及神经侵犯。(淋巴结)胰周9/15可见癌转移。
10-13 腹腔引流增多,引流液淀粉酶高,感染指标升高,考虑胰瘘和腹腔感染,持续予注射用头孢哌酮钠舒巴坦钠抗感染,生长抑素、人血白蛋白(5日,每日2支)等治疗。
10-17 血红蛋白水平下降,CT显示出血可能,感染指标升高,腹腔持续引流出淡血性液;考虑为胰瘘、腹腔出血、感染可能。加用万古霉素抗感染,输血浆。
图2 术后复查CT(10-17)
10-18 超声提示胃大弯侧及肝周积液,行超声引导下穿刺置管引流,记为腹腔穿刺引流管(胃大弯侧),引出暗血性液体,并送引流液培养;予患者胆肠前、胰肠后引流管各退出1 cm左右。
10-21 血常规显示白细胞水平高、血红蛋白水平低,开腹探查,清除血块和脓性液体,放置多根引流管,行空肠造口术,术后转入SICU,引流液培养出屎肠球菌。
图3 开腹探查前CT(10-21)
10-21至10-24,予注射用亚胺培南西司他丁钠、替考拉宁、醋酸卡泊芬净联合抗感染,间断输注红细胞和血浆。
10-25 返回外科病房。血红蛋白稳定,感染指标好转。继续注射用亚胺培南西司他丁钠+替考拉宁+卡泊芬净抗感染治疗,保肝、利胆、持续予与人血白蛋白(5日,每日2支)、生长抑素治疗。
10-26 感染指标升高,留取胃后引流管液体培养出产气克雷伯菌,完善相关试验,冲入生理盐水后次日感染指标稳定。
10-27 复查CT示术区出血及渗液,范围较前明显减小。
图4 复查CT(10-27)
10-28 腹腔引流减少(共300 ml),拔除盆腔引流,拔除皮下引流肠内营养,肠内营养乳剂20 ml/h,禁食水。
11-07 上调肠内营养量,拔除腹腔穿刺引流管,冲入和冲出多根引流管相应液体,夜间高热,考虑CVC感染,拔除CVC,降级改用左氧氟沙星。
图5 复查CT(11-07)
11-09 引流管引出血性液伴血凝块,考虑吻合口瘘相关再发出血,予凝血酶散腹腔灌注止血(夹闭30 min)。输注红细胞3 u+血浆400 ml。重症医学科会诊换头孢他啶+伏立康唑+利奈唑胺抗感染。
11-10 复查CT提示包裹性积液,行CT引导下穿刺置管引流。血红蛋白水平低,输血时高热,考虑非溶血性发热性输血反应,予地塞米松、赖氨匹林,热退,完善血G/GM试验(后回报阴性)。
图6 复查CT(11-10)
11-11 再发高热,体温39.6℃,无寒战,CT穿刺抽液培养出屎肠球菌(VRE)、产气克雷伯菌(敏感菌)、嗜麦芽寡氧单胞菌(头孢他啶耐药),考虑腹腔感染所致发热,升级为注射用亚胺培南西司他丁钠+替考拉宁+伏立康唑(口服)。
11-17 体温稍高,腹泻,调整抗感染方案,予肠内营养,联合白蛋白及肠外营养支持治疗。
11-24 停止所有抗感染药物,拔除引流管。
11-28 仍间断低热,自行热退,WBC 16.6X109/L,调整抗生素为头孢他啶+替加环素,腹膜后上引流出乳糜样液(似肠内营养液)。
11-30 复查CT,自胃后下引流注入碘海醇造影剂,经胰肠吻合口进入肠道,反流至胆管。
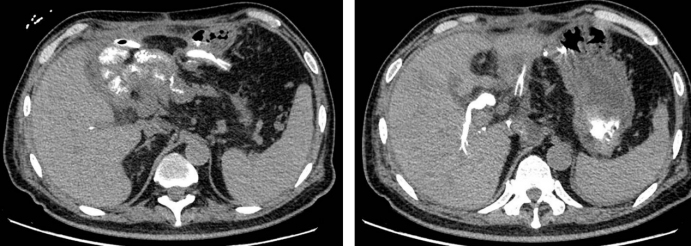
11-28至12-11 持续使用头孢他啶+替加环素,患者未再发热。
12-12 调整抗感染方案米诺环素(口服)+利奈唑胺(口服),WBC 12.40X109/L,PCT 0.10 g/ml,HGB 126 g/L,ALT 40 IU/L,AST 43 IU/L,TBIL 35.7 μmol/L。
12-16 发热38℃,联用注射用亚胺培南西司他丁钠抗感染。
12-19 腹腔引流量大(日均700-800 ml),予醋酸奥曲肽注射液后减至210 ml。
12-23 血象正常,停用注射用亚胺培南西司他丁钠及醋酸奥曲肽注射液,注射注射用醋酸奥曲肽微球20 mg q3w。
12-29 拔除胰肠吻合口前下引流。
01-20 开始PD-1+AG方案进行化疗。
02-17 完成第二周期D8次化疗后出院。
AG + PD1治疗两周期后肿瘤进展,肝脏多发转移,后在当地医院化疗方案改为奥沙利铂+替吉奥+仑伐替尼。
病例点评
马永蔌 教授
北京大学第一医院 肝胆胰外科 副主任医师
专注肝胆胰疾病的临床与基础研究
德国乌尔姆大学医学院访问学者
中国医药教育协会肝胆智能装备发展促进会 委员
中国医师协会微无创专业委员会胰腺外科学组 委员
中国研究型医院学会消化道肿瘤专业委员会 青年委员
中国医促会软组织肿瘤分会 青年委员
中华医学会外科学分会胰腺学组胰腺青年精英俱乐部成员
北京围术期研究会内分泌外科分会 秘书
北京市医疗器械审评检查中心咨询专家
《中华消化外科杂志》、《中华实验外科杂志》审稿专家
曾获华夏医学科技奖 三等奖;中华外科青年学者奖 二等奖;中国抗癌协会科技 二等奖
发表SCI论文十余篇
本案例患者自意识到外科感染发生以来,先后采用降钙素原(PCT)、白介素-6(IL-6)和C反应蛋白(CRP)等多个指标评估感染情况。其中,PCT对细菌感染敏感度高且特异性强,IL-6和CRP虽对多种感染类型有反应,但CRP受干扰因素较多,未能如实反映细菌感染情况,需关注其变化趋势。而PCT在评估感染价值较高,鉴于其半衰期特性,若抗生素治疗有效,PCT水平通常会在24小时内降低至少1/3。
在治疗过程中,该患者首先采用经验性抗生素治疗,之后根据患者病原体敏感性进行调整。此外,治疗还需观察患者发热、引流液等临床状态,以此评估治疗效果。若引流液浑浊或量不符合预期,则相应调整引流管策略,甚至重新进行CT分析。
在胰腺癌外科手术中,胰瘘几乎是难以避免的并发症。一般来说,A级胰瘘不影响胰腺,对临床转归和康复无影响,发生率约为40%;B级胰瘘会使住院时间延长,需采取一系列治疗措施,发生率近15%;C级胰瘘是指术后需二次手术的情况,发生率约为5%,该类患者治疗极具挑战性。而胰腺术后胰瘘导致的感染和出血形成了一个严重的三要素循环,三者互为因果。一旦出现这种情况,需积极处理,尤其对于出血患者,因出血是胰腺术后死亡的主要原因,故通常采取介入治疗准确定位出血点,而该患者则选择了外科手术处置。
二次手术目标是找到出血点并止血。通过对整个腹腔进行冲洗,清理了坏死病灶和脓液,并放置多根引流管以充分引流。而在Whipple术后胰瘘相关腹腔感染的治疗中,通畅引流至关重要。该病例通过放置多根引流管,并在必要时结合B超或CT引导进行穿刺,以解决引流问题。术后,患者未再出血,但仍需与腹腔感染作斗争。术后引流和感染治疗的关键在于维持患者基本稳定。需保持有效血容量,促进感染状态改善,及时清除废物。同时,需重视血浆和白蛋白等胶体恢复治疗,并及时补充营养。
低白蛋白血症会影响抗感染药物在体内的分布、代谢及排泄,尤其是在肝功能障碍的情况下[1]。此外,白蛋白除可影响抗菌药物疗效外[2],还具有维持内环境稳态、血管内皮功能、凝血功能、酸碱平衡,以及改善免疫抑制和缓解全身炎症等多种生理功能[3-6]。针对腹部外科围手术期重症患者,专家共识[7]推荐密切监测白蛋白水平,并在血清白蛋白低于30 g/L时输注人血白蛋白,以降低消化道瘘和术区感染风险,改善预后。该患者接受外科手术、药物治疗及抗生素治疗等多种综合治疗策略后,在围术期取得较好短期预后。然而,令人遗憾的是患者复发较早。
胰腺术后胰瘘引发的复杂出血和腹腔感染作为一种极为严重的术后并发症,治疗复杂,且需多学科协作。因当前尚无统一治疗策略,需根据患者具体情况,结合各中心的经验和特点,采取个体化治疗方案。
参考文献:
1. 抗菌药物药代动力学/药效学理论临床应用专家共识, 2018, 41(6):38.
2. clin interv Aging. 2013;8:1323-8.
3. Bernardi et al. Crit Care 2012; 16: 211.
4. 李荣,等.血清白蛋白的生物学特性研究进展[J].生命科学,2013,25(10):1022-1026.
5. Spiess et al. J Parenter Enteral Nutr 1996; 20: 424–428.
6. Bernardi M, et al. Gut. 2020 Jun;69(6):1127-1138.
7. 《人血白蛋白在危重症患者应用专家共识》(2021).
查看更多