查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





1
乳腺癌筛查指南
1.1 乳腺癌筛查的定义、目的及分类
⑴ 肿瘤筛查,或称作普查,是针对无症状人群的一种防癌措施,而针对有症状人群的医学检查称为诊断。
⑵ 乳腺癌筛查是通过有效、简便、经济的乳腺检查措施,对无症状妇女开展筛查,以期早期发现、早期诊断及早期治疗。其最终目的是要降低人群乳腺癌的死亡率。
⑶ 筛查分为机会性筛查(opportunistic screening)和群体筛查(mass screening)。机会性筛查是指医疗保健机构为因各种情况前来就诊的适龄女性进行的乳腺筛查,或女性个体主动或自愿到提供乳腺筛查的医疗保健机构进行检查;群体筛查是社区或单位实体借助医疗保健机构的设备、技术和人员有组织地为适龄女性提供乳腺筛查服务。
1.2 女性参加乳腺癌筛查的起始和终止年龄
⑴ 虽然有些国外指南建议50岁以上,但大部分指南建议40岁作为乳腺癌筛查的起始年龄。中国女性乳腺癌的发病高峰年龄为45~54岁,比欧美国家要提前10年左右,因此本指南建议一般风险人群乳腺癌筛查的起始年龄为40岁。但对于乳腺癌高危人群可将筛查起始年龄提前到40岁以前。
⑵ 对于乳腺癌影像学筛查的终止年龄,大部分国外群体筛查都推荐把65~70岁作为筛查的上限。但是,老年人乳腺癌的发病率仍然较高,因此本指南认为老年人是否停止筛查需要考虑个人的身体健康状况、预期寿命及各种并发症情况。如果并发症多,预期寿命有限,则可适当减免乳腺癌筛查。因此对于70岁以上老年人可以考虑机会性筛查。
1.3 用于乳腺癌筛查的措施
1.3.1 乳腺X线检查
⑴ 乳腺X线检查对降低40岁以上女性乳腺癌死亡率的作用已经得到了国内外大多数学者的认可。
⑵ 建议每侧乳房常规应摄2个体位,即头足轴(craniocaudal,CC)位和内外侧斜(mediolateral oblique,MLO)位。
⑶ 乳腺X线影像应经过2名以上专业放射科医师独立阅片。
⑷ 乳腺X线筛查对50岁以上亚洲妇女准确性高,但对40岁以下及致密乳腺诊断的准确性欠佳。不建议对40岁以下、无明确乳腺癌高危因素或临床体检未发现异常的女性进行乳腺X线检查。
⑸ 常规乳腺X线检查的射线剂量低,不会危害女性健康,但正常女性无须短期内反复进行乳腺X线检查。
1.3.2 乳腺超声检查
目前已经有较多的证据提示在乳腺X线检查基础上联合乳腺超声检查较之单独应用乳腺X线检查有更高的筛查敏感度,尤其是针对乳腺X线筛查提示致密型乳腺(c型或d型),因此乳腺超声检查可推荐作为乳腺X线筛查的有效补充。但在人群筛查中,增加超声检查显然会增加筛查的成本,其成本效益也相应减弱。此外,乳腺超声检查单独作为筛查措施的有效性尚未得到充分的证据证实。
1.3.3 乳腺临床体检
目前尚无证据显示,乳腺临床体检单独作为乳腺癌筛查的方法可以提高乳腺癌早期诊断率和降低死亡率。但在经济欠发达、设备条件有限及女性对疾病认知度较不充分的地区仍可以作为一种选择。
1.3.4 乳腺自我检查
⑴ 乳腺自我检查不能提高乳腺癌早期诊断的检出率和降低死亡率。
⑵ 由于可以提高女性的防癌意识,故仍鼓励基层医务工作者向女性传授每月1次乳腺自我检查的方法,建议绝经前妇女选择月经来潮后7~14 d进行。
1.3.5 乳腺磁共振成像(magnetic resonance imaging,MRI)检查
⑴ MRI检查可作为乳腺X线检查、乳腺临床体检或乳腺超声检查发现的疑似病例的补充检查措施。
⑵ 可与乳腺X线联合用于BRCA1/2基因突变携带者的乳腺癌筛查。
1.3.6 其他检查
目前的证据不支持近红外线扫描、核素扫描、导管灌洗及血氧检测等检查作为有效的乳腺癌筛查方法。
1.4 一般风险女性乳腺癌筛查指南
乳腺癌一般风险女性即除了乳腺癌高危人群(定义见1.5.1节)以外的所有女性。
1.4.1 20~39岁
不推荐对该年龄段人群进行乳腺筛查。
1.4.2 40~70岁
⑴ 适合机会性筛查和群体筛查。
⑵ 每1~2年进行1次乳腺X线检查,对致密型乳腺(乳腺X线检查提示腺体为c型或d型)推荐与B超检查联合。
1.4.3 70岁以上
⑴ 适合机会性筛查。
⑵ 每1~2年进行1次乳腺X线检查。
1.5 乳腺癌高危人群筛查意见
建议对乳腺癌高危人群提前进行筛查(小于40岁),筛查频度推荐每年1次,筛查手段除了乳腺X线检查外,还可采用MRI等影像学手段。
1.5.1 罹患乳腺癌高危人群的定义
存在下列情况之一者被认为是罹患乳腺癌高危人群:
⑴ 有明显的乳腺癌遗传倾向者,主要判断内容如下:
①一级亲属有乳腺癌或卵巢癌史;②二级亲属50岁前,患乳腺癌2人及以上;③二级亲属50岁前,患卵巢癌2人及以上;④至少1位一级亲属携带已知BRCA1/2基因致病性遗传突变,或自身携带BRCA1/2基因致病性遗传突变(需要行BRCA遗传检测的对象见附录Ⅰ)。
⑵ 既往有乳腺导管或小叶不典型增生或小叶原位癌(lobular carcinoma in situ,LCIS)的患者。
⑶ 既往30岁前接受过胸部放疗。
⑷ 根据评估对象的年龄、种族、初潮年龄、初产年龄、个人乳腺疾病史、乳腺癌家族史和乳腺活检次数等多个风险因子,利用Gail模型进行罹患乳腺癌风险评估。如果受试者5年内发病风险≥1.67%,则被认为是高风险个体。
注:一级亲属指母亲、女儿及姐妹;二级亲属指姑、姨、祖母和外祖母。
1.5.2 乳腺癌高危人群的筛查推荐策略与管理
⑴ 推荐起始年龄更早(<40岁)开展乳腺筛查。
⑵ 每年1次乳腺X线检查。
⑶ 每6~12个月1次乳腺超声检查。
⑷ 每6~12个月1次乳腺体检。
⑸ 必要时联合乳腺增强MRI。
2
常规乳腺X线检查和报告规范
2.1 乳腺X线检查技术规范
2.1.1 投照前准备工作
医技人员应耐心地向被检查者说明拍片过程以及拍片时夹板压迫乳房给被检查者带来的不适,令其放松,从而使受检者理解并予以配合。
2.1.2 常规投照体位
正确摆位是获得高质量乳腺X线片的基础。乳腺X线摄片的常规投照体位为双侧MLO位及CC位。一张好的MLO位片显示如下:乳房被推向前上,乳腺实质充分展开,胸大肌可见,较松弛,下缘达乳头水平,乳头在切线位,部分腹壁包括在片中,但与下部乳腺分开,绝大部分乳腺实质显示在片中。一张好的CC位片显示如下:乳房在片子的中央,乳头在切线位,小部分胸大肌可见,内侧乳腺组织充分显示,外侧乳腺组织可能不包括在片中。
2.1.3 补充投照体位和投照技术
对于MLO位及CC位显示不良或未包全的乳腺实质,可以根据病灶位置的不同选择以下体位予以补充:外内侧(lateromedial,LM)位、内外侧(mediolateral,ML)位、内侧头足轴(medial craniocaudal,MCC)位、外侧头足轴(lateral craniocaudal,LCC)位、尾叶(CLEO)位及乳沟位。为了进一步评价在以上常规摄影中显示出的异常改变,可采用一些特殊摄影技术。其可在任何投照位上进行,包括局部加压摄影、放大摄影或局部加压放大摄影,目的是使病灶得以更好地显示而明确病变性质。
2.2 诊断报告规范
参照美国放射学会的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分类标准,描述乳腺内肿块、钙化等异常表现的X线征象。
2.2.1 肿块
在两个相互垂直(或近似垂直)的投照位置上均能见到的有一定轮廓的占位性病变,仅在1个投照位置上见到,在其被确定具有三维占位特征之前,应描述为“不对称”。X线所见肿块并不一定与临床所触诊的肿块完全一致。X线图像上所发现的肿块,临床不一定能够触及(因病灶太小、质软或腺体重叠形成伪影);临床所触及的肿块,X线图像上亦可能因为患者乳腺实质丰富而未能显示。部分患者肿块周边伴有浸润和水肿,触诊常比X线图像所显示的肿块范围要大。肿块的描述包括边缘、形态和密度3个方面,其中肿块的边缘征象对判断肿块的性质最为重要。
2.2.1.1 肿块边缘描述
⑴ 清楚:超过75%的肿块边界与周围正常组织分界清晰、锐利。
⑵ 遮蔽:超过25%的肿块边界被邻近的正常组织遮盖而无法对其作出进一步判断。
⑶ 小分叶:肿块边缘呈小波浪状改变。
⑷ 模糊:边缘与周边组织分界不清,但并非被周边正常组织遮盖所致。
⑸ 星芒状:从肿块边缘发出放射状线影。
2.2.1.2 肿块形态描述
肿块形态描述包括圆形、卵圆形和不规则形。
2.2.1.3 肿块密度描述
以肿块与其周围相同体积的乳腺组织相比分为高、等、低(不含脂肪)和含脂肪密度4种。大多数乳腺癌呈高密度或等密度,极少数可呈低密度。
2.2.2 钙化
对钙化病变的描述应从类型和分布两方面进行。
2.2.2.1 钙化类型
可分为典型的良性钙化和可疑钙化。良性钙化可不描述,但当这些钙化可能会引起临床医师误解时,这些良性钙化需要描述。
⑴ 典型的良性钙化有以下表现:
①皮肤钙化:粗大、典型者呈中心透亮改变。②血管钙化:管状或轨道状。③粗糙或爆米花样钙化:直径>2.0 mm,多为退变的纤维腺瘤。④粗棒状钙化:连续呈棒杆状,偶可呈分支状,直径通常>0.5 mm,沿导管分布,聚向乳头,常为双侧乳腺分布,多见于分泌性病变,常见于60岁以上的妇女。⑤圆形(直径≥0.5 mm)和点状钙化(直径<0.5 mm)。⑥环形钙化:壁厚<1.0 mm,常见于脂肪坏死或囊肿;壁厚≥1.0 mm,可见于油脂性囊肿或单纯性囊肿。⑦钙乳样钙化:为囊肿内钙化,在CC位表现不明显,为绒毛状或不定形状,在90°侧位上边界明确,根据囊肿形态的不同而表现为半月形、新月形、曲线形或线形,形态随体位而发生变化是这类钙化的特点。⑧缝线钙化:由于钙质沉积在缝线材料上所致,尤其在放疗后常见,典型者为线形或管形,绳结样改变常见。⑨营养不良性钙化:常出现于放疗后、外伤后及自体脂肪移植整形术后的乳腺,钙化形态不规则,大多数钙化大于0.5 mm,呈中空状改变。
⑵ 可疑钙化有以下表现:
① 不定形钙化:小而模糊,双侧、弥漫分布多为良性表现,如呈段样、线样及成簇分布时宜进一步活检,其恶性的阳性预测值(positive predictive value,PPV)约为20%,BI-RADS分类应为4B类。②粗糙不均质钙化:钙化多介于 0.5~1.0 mm之间,比营养不良性钙化小些,多有融合,形态不规则可能为恶性表现,也可能出现在纤维腺瘤、外伤后及纤维化的乳腺内,大量、双侧成簇的粗糙不均质钙化,也有可能是良性的。单处集群分布有恶性的可能,其恶性的PPV约为15%,BI-RADS分类应为4B类。③细小多形性钙化:比不定形钙化更可疑,缺乏细的线样颗粒,大小形态不一,直径小于0.5 mm,其恶性的PPV约为29%,BI-RADS分类应为4B类。④细线样或细线样分支状钙化:表现为细而不规则线样钙化,直径小于0.5 mm,常不连续,有时也可见分支状,提示钙化是由于被乳腺癌侵犯在导管腔内形成,其恶性的PPV约为70%,BI-RADS分类应为4C类。
2.2.2.2 钙化分布
⑴ 散在分布:钙化随意分散在整个乳腺中。双侧、散在分布的点样钙化和不定形钙化多为良性钙化。
⑵ 区域状分布:指较大范围内(>2 cm3)分布的钙化,与导管走行不一致,常超过1个象限的范围,这种钙化分布的性质需结合钙化类型综合考虑。
⑶ 集群分布:指至少有5枚钙化占据在1个较小的空间内(<2 cm3),良性、可疑钙化都可以有这样的表现。
⑷ 线样分布:钙化排列成线形,可见分支点,提示来源于同一个导管,多为可疑钙化。
⑸ 段样分布:常提示病变来源于同一个导管及其分支,也可能出现在1叶或1个段叶上的多灶性癌中。段样分布的钙化,恶性的可能性会增加,比如点状和不定形钙化。尽管良性分泌性病变也会有段样分布的钙化,但如果钙化的形态区别于特征性良性病变时,首先考虑其为可疑钙化。
2.2.3 结构扭曲
结构扭曲是指正常结构被扭曲但无明确的肿块可见,包括从一点发出的放射状影和局灶性收缩,或在实质的边缘扭曲。结构扭曲也可以是一种伴随征象,可为肿块、不对称致密或钙化的伴随征象。如果没有局部的手术和外伤史,结构扭曲可能是恶性或放射状瘢痕的征象,应提请临床考虑活检。
2.2.4 对称性征象
2.2.4.1 不对称
仅在一个投照位置上可见的纤维腺体组织,80%可能是伪影或正常组织的重叠所致。
2.2.4.2 球形不对称
较大范围腺体量的不对称,至少达1个象限,不伴有其他征象,多为正常变异。但当与临床触及的异常相吻合时,则可能有意义。
2.2.4.3 局灶性不对称
两个投照位置均显示且表现相仿,但缺少真性肿块特有的外凸边缘改变,常为内凹,较球形不对称范围小。它可能代表的是1个正常的腺体岛(尤其当其中含有脂肪时)。但在缺乏特征性的良性征象时,往往需要进一步检查,由此可能会显示1个真性肿块或明显的结构扭曲改变。
2.2.4.4 进展性不对称
新发、增大的或比以前更明显的局灶性不对称。约15%的进展性不对称被证实是恶性的,其恶性的PPV约为13%。进展性不对称,除非有特征性的良性改变,都需要进一步的影像学评估和活检。
2.2.5 乳腺内淋巴结
乳腺内淋巴结典型表现为肾形,肉眼可见淋巴结门脂肪所致的透亮切迹,常小于1 cm。当淋巴结较大,但其大部分为脂肪替代时,仍为良性改变。可以是多个,也可能是1个淋巴结由于明显的脂肪替代看上去像多个圆形结节影。对于乳腺外上部的特征性改变可以作出正确诊断。偶尔也可出现在其他区域,多与静脉伴行。
2.2.6 皮肤病变
皮肤病变投照在乳腺组织内,尤其是两个投照体位都有显示的时候,应该在评估报告中提及。摄片的技术员应该在皮肤病变处放一个不透X线的标志。
2.2.7 单侧导管扩张
管状或分支样结构可能代表扩张或增粗的导管。虽然少见,但即使不同时伴有其他可疑的临床或影像征象,其恶性的PPV也可达10%[常见于不含钙化的导管原位癌(ductal carcinoma in situ,DCIS)]。
2.2.8 合并征象
合并征象包括皮肤凹陷、乳头凹陷回缩、皮肤增厚、小梁结构增粗、腋窝淋巴结肿大、结构扭曲和钙化等。
2.3 病灶的定位
一个明确的病灶必然是三维立体地存在于乳腺内的,如在两个投照位上均被看到即可以证实,尤其在两个相互垂直的投照位均显示时则更确定。需要明确4点:
①哪一侧乳腺:左侧、右侧或双侧。②部位:根据钟面和象限两者结合定位。象限定位包括外上象限、外下象限、内上象限和内下象限4个区域。12点钟为正上方,6点钟为正下方,3点钟或9点钟可以是外侧或内侧(根据左、右侧乳房的不同)。另外,乳晕下区、中央区和尾叶区不要求钟面定位。③深度:根据与胸壁的平行分成前1/3、中1/3、后1/3。乳晕下区、中央区和尾叶区不要求深度定位。④与乳头的距离。
2.4 乳腺X线报告的组成
应包括病史、检查目的、投照体位、乳腺分型、任何重要的影像学所见及与既往检查片对比的结果,最后是评估类别和建议。报告措辞应当简洁,使用术语词典中的标准词汇。应清楚地描述任何有意义的发现,如有前片,应对比有无变化,最有意义的是新发现的病灶。如果同时进行过超声和乳腺MRI检查,在报告中应予提及。乳腺X线诊断报告范本见附录Ⅱ。
2.4.1 检查目的
对本次检查作一个简单的说明,如对无症状妇女的筛查、筛查后的回召检查、评估临床发现或随访等。
2.4.2 乳腺分型
乳腺分型是指对整个乳腺构成的简明描述,有助于判断X线诊断的可靠程度,即病灶隐藏在正常乳腺组织中的可能性。对X线致密型乳腺,X线片对小病灶的检出效能随着乳腺腺体致密程度的上升而下降。可分为4型:
①a型:脂肪型,乳腺组织几乎完全被脂肪组织所替代;②b型:乳腺组织内有散在的纤维腺体;③c型:乳腺组织呈密度不均匀增高,很有可能遮蔽小肿块;④d型:致密型,乳腺组织非常致密,会降低乳腺X线检查的敏感性。
2.4.3 清晰地描述任何重要的发现
⑴ 肿块:大小,形态(形状、边缘),密度,伴随的钙化,其他伴随征象,定位。
⑵ 钙化:形态(典型良性或可疑钙化),分布,伴随征象,定位。
⑶ 结构扭曲:伴随钙化,其他伴随征象,定位。
⑷ 不对称征象:伴随钙化,其他伴随征象,定位。
⑸ 乳内淋巴结:定位。
⑹ 皮肤病变:定位。
⑺ 单个扩张的导管:定位。
2.4.4 与前片比较
本次检查结果需与前片比较。
2.4.5 评估分类
应对每个病灶进行完整的评估和分类,常用的是BI-RADS分类法。
2.4.5.1 评估是不完全的
BI-RADS 0类:需要召回(recall)补充其他影像学检查,进一步评估或与前片比较。常在普查情况下应用,作为最终诊断仅用于需要对比前片的情况。推荐的其他影像学检查方法包括局部加压摄影、放大摄影、特殊投照体位和超声等。
在中国,一些妇女乳房内脂肪较少,实质丰富,乳腺组织缺乏自然对比,可采用其他影像学方法(如超声、乳腺X线断层摄影、对比增强乳腺X线摄影及MRI等)进一步检查,也可将其归为0类。
2.4.5.2 评估是完全的—最后分类
⑴ BI-RADS 1类:阴性,无异常发现。乳腺是对称的,无肿块、结构扭曲,无可疑钙化。恶性的可能性为0%。
⑵ BI-RADS 2类:也是“正常”的评价结果,但有良性改变,如钙化的纤维腺瘤、皮肤钙化、金属异物(活检或术后的金属夹)及含脂肪的病变(积乳囊肿、脂肪瘤及混合密度的错构瘤)等。乳腺内淋巴结、血管钙化、植入体及符合手术部位的结构扭曲等亦归为此类。总体而言,并无恶性的X线征象。恶性的可能性为0%。
⑶ BI-RADS 3类:只用于几乎可以确定的良性病变。有很高的良性可能性,放射科医师通常期望此病变在短期(小于1年,一般为6个月)随访中稳定或缩小以证实先前的判断。这一类病变的恶性可能性为0%~2%。包括不可触及的边缘清楚的无钙化的肿块、局灶性不对称、孤立集群分布的点状钙化。对这3类病变的常规处理程序为:首先X线摄片短期随访(一般为6个月),6个月后再常规随访,此后再12个月乃至2年以上,如连续2~3年保持稳定则可将原先的3类判读(可能良性)改为2类判读(良性)。如果短期随访后病灶缩小或消失,可以直接改判为2类或1类,随后常规随访。
⑷ BI-RADS 4类:广泛用于判定绝大部分需要介入性诊断的影像学发现。其恶性的可能性为 2%~95%。可再细分为:
①4A类:其恶性的可能性为2%~10%,包括一组介入手段干预但恶性可能性较小的病变。活检或细胞学检查为良性的结果比较可靠,可以常规随访或6个月后随访,此类病变包括一些可触及的、部分边缘清楚的实性肿块,如超声提示的纤维腺瘤、可扪及的复杂囊肿或可疑脓肿。②4B类:其恶性的可能性为10%~50%。需要对病理学检查结果与影像学表现严格对照,良性病变的判定取决于影像学与病理学检查的一致性,如果病理学检查结果与影像学表现符合,且病理学检查结果为具有排他性的典型良性病变,如纤维腺瘤、脂肪坏死及肉芽肿性病变等,则可进行观察;如穿刺病理学诊断结果为乳头状瘤、不典型增生等,则进一步的切除活检就是必需的。③4C类:更进一步怀疑为恶性,但还未达到5类那样典型的一组病变,其恶性的可能性为50%~95%,此类中包括边界不清、形态不规则的实性肿块或新出现的微细线样钙化,此类病变往往是恶性的,对于病理学检查结果为良性的病例,需要与病理科协商,作进一步的分析。
⑸ BI-RADS 5类:高度怀疑恶性(几乎肯定的恶性),临床应采取适当措施。这一类病变的恶性可能性≥95%。常为形态不规则星芒状边缘的高密度肿块、段样和线样分布的细小线样和分支状钙化、不规则星芒状肿块伴多形性钙化。
⑹ BI-RADS 6类:已活检证实为恶性,应采取积极的治疗措施。用来描述活检已证实为恶性的影像评估,主要是评价先前活检后的影像学改变,或监测术前治疗的影像学改变。根据BIRADS的描述,BI-RADS 6类不适合用来对恶性病灶完全切除(肿块切除术)后的随访。手术后没有肿瘤残留不需要再切的病例,其最终的评估应该是BI-RADS 3类(可能良性)或2类(良性);与活检不在一个区域的可疑恶性病变应单独评估。其最终的评估应该是BI-RADS 4类(可疑恶性)或5类(高度提示恶性),可建议活检或手术干预。
注:本规范的制定,以美国放射学会的BI-RADS第5版作为参考。
3
乳腺超声检查和报告规范
3.1 超声检查的仪器
常规检查采用彩色多普勒超声仪的实时线阵高频探头,探头频率为7.5~10.0 MHz,有条件时可用到10.0~15.0 MHz或更高,但对于乳腺组织过厚或有假体时,可适当降低探头频率。超声探头和频率的选择原则是在保证足够探查深度的前提下,尽量提高频率,从而保证超声图像的分辨率。
3.2 超声检查的方法
检查前一般无需特殊准备,有乳头溢液者最好不要将液体挤出。根据需要,患者取仰卧或侧卧位。如果患者自觉特殊体位有肿块的感觉,可以让患者采取特殊体位进行超声检查,如直立或坐位等。检查时患侧手臂尽量上抬外展,充分暴露乳房及腋下,探头直接放在乳房表面,对乳头、乳晕及乳房外上、外下、内上、内下4个象限进行全面扫查,次序可由操作者自行确定,扫查方式包括放射状、反放射状、旋转式和平行移动等,可根据检查者的习惯选择。注意检查范围全面,不要漏检,同时应检查腋下淋巴结情况。必要时可检查锁骨上下及颈部淋巴结。
3.3 超声检查的程序
3.3.1 基本要求
检查时应先对乳腺及周围组织进行全面的常规二维超声检查,然后对发现病灶的区域进行重点的二维超声检查,检查内容包括:病灶的位置、大小或范围的测定,边界、边缘、形状、内部及后方回声、钙化和周围组织包括皮肤,胸肌及韧带等结构的变化等。病灶的大小或范围的测量应该选取其最大平面,测量两条互相垂直的最长径线,然后在与此切面垂直的最大平面上测量第三个径线。测量时,游标应该放置在病灶边缘的外侧,病灶边界清晰时按照边界测量,肿块边界模糊时,应该根据肿块的最大边缘部分或周边的声晕测量。在二维声像图的基础上应辅助彩色及能量多普勒超声检查,观察血流的走向及分布并在多普勒频谱上测量各种血流参数。在具备条件的情况下,可采用三维重建成像、弹性成像和造影增强对比成像等技术,观察病灶和乳腺组织的硬度变化、空间关系和血管分布,了解病灶和组织的质地变化及血流灌注情况,帮助完善诊断。
3.3.2 图像的存储
图像的存储内容应该包括:患者的姓名、年龄、性别和诊疗记录号码(门诊号或住院号、超声登记号),设备名称和检查条件标识。体位标记包括:乳腺的方位(左或右),病灶的位置,包括与乳头中央的距离、钟面形式的标记及显示病灶时的探头切面标识。病灶图像存储至少应记录2个以上有特征的不同方向切面,应尽量完整地存储记录病灶各种超声特点的声像图,如钙化、血流、能量图、多普勒频谱、弹性成像、三维重建及造影增强对比成像等,必要时可存储动态图像。对于超声检查没有异常的乳腺,可以仅存储各象限的放射状切面的声像图以证明对患者做过全面的超声检查。
3.3.3 报告书写
以上各项检查结果及所测参数均应在超声报告中加以详细描述,最后综合各种检查结果得出超声的诊断结论,包括乳腺正常或异常的判断,如有异常的局灶性病变应明确病灶的物理性质、对应的诊断分类(参照BI-RADS)及相应的处理建议(在分类中默认),并尽可能作出合理的病理学性质判断。
3.4 超声诊断报告的规范
为了使超声报告既个体化又标准化,应首先对超声报告中的描述性语言进行统一定义(附录Ⅲ)。
3.4.1 乳腺超声的回声模式
乳腺声像图表现存在个体差异,因此,通常将自身皮下脂肪组织回声定义为等回声,没有回声定义为无回声,有回声的与脂肪组织回声对比,按照回声的强弱分别定义为弱回声、低回声、中等回声、高回声及强回声。
3.4.2 正常的乳腺组织声像图表现
正常乳腺的声像图由浅入深依次为:
① 皮肤:呈带状高回声,厚2~3 mm,边缘光滑整齐。② 浅筋膜和皮下脂肪:浅筋膜呈线状高回声,脂肪组织呈等回声,由条索状高回声分隔,边界欠清。③ 乳腺腺体:因人而异,厚薄不一,老年人可萎缩至仅3 mm,腺体呈等回声带夹杂有低回声,排列较整齐。腺体与皮肤间有三角形的高回声韧带,称为库柏(Cooper)韧带,其后方回声可衰减。④ 深筋膜:筋膜呈线状高回声,光滑整齐,筋膜间脂肪呈等回声。⑤ 胸肌及肋骨:胸肌为梭形的均质低回声区,肋骨为弧形强回声,其后方衰减为声影。整体的乳腺超声表现有均匀和不均匀之分:均匀的乳腺在声像图上表现为连续一致的脂肪、韧带、纤维及腺体组织回声,从乳头、乳晕至周边组织腺体逐渐变薄;不均匀的乳腺可以表现为局部性或弥漫性,声像图表现为腺体不规律的增厚、回声的增强或减弱等。
3.4.3 异常的乳腺组织声像图表现
乳腺的异常应从不同的切面上全面观察以排除正常的组织及结构,如脂肪组织和肋骨等,局灶性的病变声像图表现需按照以下征象描述。
3.4.3.1 肿块
⑴ 规则:包括圆形、椭圆形。
⑵ 不规则:除规则以外的。
纵横比(平行于皮肤表面的病灶最大径线和与之垂直的最大径线的比值)分为:
⑴ 垂直:纵横比小于2∶1,甚至接近1。
⑵ 平行:纵横比大于2∶1。
边界(病灶与周围组织交界的部分在声像图上的表现)分为:
⑴ 清晰:病灶与周围组织间有明确的界限,包括包膜、声晕,定义为边界清晰。
⑵ 不清晰:如病灶与周围组织间没有明确的界限则定义为不清晰,同一病灶可部分边界清晰,部分边界不清晰。
边缘(病灶与周围组织交界线的走向和形态在声像图上的表现)分为:
⑴ 光整:病灶的边缘光滑整齐,可以有2~3个大的光滑波浪。
⑵ 不光整:病灶的边缘不整齐,可简单地分为3种模式:
①小叶:病灶的边缘有较多短小的弧形波纹,呈扇贝状。②成角:病灶的边缘部分有尖锐的转角,通常形成锐角,类似蟹足,故亦可称蟹足状。③毛刺:病灶的边缘有锐利的放射状线条样表现。同一病灶的边缘可并存上述多种表现。
回声模式(病灶的内部回声,按照前述乳腺超声回声模式定义,内部回声可以是单一的,也可以是多种回声复合的)分布的表现可以分为:
⑴ 均匀:病灶内部回声为分布均匀的单一回声,分为无回声、弱回声、低回声、等回声、高回声及强回声。
⑵ 不均匀:病灶内部回声为分布不均匀单一回声或几种混合的回声。
病灶后方回声(对比周围同等深度的正常组织出现的声像图特征,代表病灶在声学传导方面的特性)分为:
⑴ 增强:病灶后方回声高于周围同等深度的正常组织,表现为病灶后方回声增强。
⑵ 不变:病灶后方回声与周围同等深度的正常组织相同,表现为病灶后方回声无增强或无衰减。
⑶ 衰减:病灶后方回声弱于周围同等深度的正常组织,表现为病灶后方为低回声或无回声,后者即声影。
⑷ 混合:部分病灶后方回声有不止一种的表现,表明肿块内部成分不均匀。
3.4.3.2 周围组织
部分病灶对周围组织的影响在声像图上的表现:
⑴ 皮肤及皮下脂肪组织层水肿增厚:局部或弥漫的皮肤及皮下脂肪组织的增厚,回声增强,皮下脂肪组织层内可见条带状的扩张淋巴管回声。
⑵ 皮肤凹陷、高低不平:皮肤表面高低不平,出现局限性或多处皮肤表面凹陷。
⑶ 病灶周围组织水肿:病灶周围组织增厚,回声增强。
⑷ 结构扭曲:病灶引起周围正常解剖层次结构的扭曲或连续性中断,包括病灶处皮肤、浅筋膜层、腺体层、深筋膜层及胸肌层的改变。
⑸ Cooper韧带改变:韧带牵拉或增厚。
⑹ 导管改变:腺体内导管内径的异常扩张或导管走向的扭曲。
3.4.3.3 钙化
乳腺腺体或病灶内显示的强回声谓之钙化,一般认为>0.5 mm的钙化属于粗大钙化,大钙化可能会伴有声影,<0.5 mm的钙化属于小钙化。乳腺组织中的孤立或散在的钙化因为腺体内纤维结缔组织的关系有时难以鉴别。钙化的形态可呈泥沙状、颗粒状、短棒状或弧形等,钙化的分布可为单一、成堆、成簇、散在或弥漫等。
3.4.3.4 血管评估
⑴ 病变区域没有明显的血流信号。
⑵ 病变区域与周围腺体内血流信号相似。
⑶ 病变区域有明显增强的血流信号。
3.4.4 彩色超声检查
彩色超声用于腺体组织及病灶内血管的检查。病灶的血管分布是一项特征性的分析指标,通常有别于对侧的相同区域或同侧乳房的正常区域。彩色及能量多普勒超声检查会受到各种因素的影响,如血流速度、仪器灵敏度设定等,探头施压可以使小血管特别是静脉闭塞,因此检查时应避免用力过度,通常囊肿内无血流,如加压会出现血流伪像。良性病灶内血流一般较少,恶性病灶内部及周边的血流会明显增多,且走向无规律,部分病灶有从周边穿入的特征性血流。除了对血流形态学的观察,还应对血流的各项多普勒参数进行测定。诊断意义除阻力指数(resistance index,RI)外其他的参数多存在争议,一般恶性病变的RI>0.70。
3.4.5 其他相关技术
可以根据检查的需要选择相关技术。
3.4.5.1 三维成像
乳腺病灶的三维超声最主要的作用不是对病灶的三维重建,而是对病灶冠状面的观察,此切面二维超声无法观测到。恶性病灶在冠状面上最突出的表现是类似于二维图像上病灶边缘出现“结构断裂”现象,酷似星星或太阳及周边的光芒,国内外不同学者称之为汇聚征或太阳征。
3.4.5.2 弹性成像
弹性超声成像是针对不同组织的弹性差别进行的检查,一般认为恶性肿瘤中的组织大部分硬度较高。由于目前各厂家仪器的不同设定,弹性成像未能形成统一的诊断标准。
弹性超声显示不同于二维超声,其反映的是组织硬度的变化,类似医师临床触诊的感觉,通过对比组织的预期变化推测组织成分的不同,从而帮助超声医师完成疾病的发现和诊断。剪切波技术是对组织中横波的检查,以彩色编码技术实时显示出组织弹性图。
3.4.5.3 造影增强对比成像
造影增强对比成像在乳腺疾病诊断中的应用受到探头频率、造影剂谐振及病灶血管生长等因素的影响,目前没有很成熟的标准。
3.5 乳腺超声评估分类
超声对病灶特征描述的专业术语要有统一的规范标准。超声描述的专业术语需要体现对病灶良恶性的判断和分类的影响,且对多个特征指标进行综合分析优于单个指标的判断。随着超声技术的发展,相应的专业术语内涵也将会有所改变。本指南分类标准参照2013年美国放射学会的BI-RADS,并结合中国的实际情况制定了以下分类标准。
3.5.1 评估是不完全的
BI-RADS 0类:需要其他影像学检查(如乳腺X线检查或MRI等)进一步评估。
在多数情况下,超声检查可对乳腺进行全面评估。当超声作为初次检查时,下列情况则需要进一步做其他检查:一种情况是超声检查乳腺内有明显的病灶而其超声特征又不足以作出评价,此时必须借助乳腺X线检查或MRI;另一种情况是临床有阳性体征,如触及肿块、浆液性溢液或乳头溢血、乳腺癌术后及放疗后瘢痕需要明确是否复发等,超声检查无异常发现,也必须借助乳腺X线检查或MRI对乳腺进行评估。
3.5.2 评估是完全的—分类
⑴ BI-RADS 1类:阴性。临床上无阳性体征,超声影像未见异常,如无肿块、无结构扭曲、无皮肤增厚及无微小钙化等。
⑵ BI-RADS 2类:良性病灶。基本上可以排除恶性病变。根据年龄及临床表现可每6~12个月随诊。如单纯囊肿、乳腺假体、脂肪瘤、乳腺内淋巴结(也可以归入1类)、多次复查图像无变化的良性病灶术后改变及有记录的经过多次检查影像变化不大的结节可能为纤维腺瘤等。
⑶ BI-RADS 3类:可能良性病灶。建议短期复查(3~6个月)及加做其他检查。根据乳腺X线检查积累的临床经验,超声发现明确的典型良性超声特征如实性椭圆形、边界清、平行于皮肤生长的肿块,很大可能是乳腺纤维腺瘤,其恶性危险性应该小于2%,如同时得到临床、乳腺X线检查或MRI的印证更佳。新发现的纤维腺瘤、囊性腺病、瘤样增生结节(属不确定类)、未扪及的多发复杂囊肿或簇状囊肿、病理学检查明确的乳腺炎症及恶性病变的术后早期随访都可归于此类。
⑷ BI-RADS 4类:可疑的恶性病灶。此类病灶的恶性可能性为2%~95%。一旦评估为4类即议进行病理学检查,包括细针抽吸细胞学检查、空芯针穿刺活检、手术活检以明确诊断。超声声像图上表现不完全符合良性病变或有恶性特征均归于此类,目前可将其划分为4A类、4B类及4C类。4A类更倾向于良性病变,不能肯定的纤维腺瘤、有乳头溢液或溢血的导管内病灶及不能明确的乳腺炎症都可归于此类,其恶性符合率为2%~10%;4B类难以根据声像图来明确良恶性,其恶性符合率为10%~50%;4C类提示恶性可能性较高,其恶性符合率为50%~94%。
⑸ BI-RADS 5类:高度可能恶性,应积极采取适当的诊断及处理措施。超声声像图恶性特征明显的病灶归于此类,其恶性可能性≥95%,应开始进行积极的治疗,经皮穿刺活检(通常是影像引导下的空芯针穿刺活检)或手术治疗。
⑹ BI-RADS 6类:已经活检证实为恶性。此类用于活检已证实为恶性,但还未进行局部治疗的影像评估。主要是评价先前活检后的影像学改变,或监测手术前新辅助化疗引起的影像学改变。
3.6 乳腺超声检查报告的组成
报告用词应当具体而简洁,使用不加修饰的术语;各项术语的定义、阐述性用语无须出现在报告中;报告内容应当尽量详细,包含全部标准的描述;数据测量应该遵守前述规范,其包括下列内容。
3.6.1 患者信息的记录
患者信息的记录包括姓名、年龄和诊疗记录号码等。
3.6.2 双侧乳腺组织总体声像图描述
按乳腺回声组成情况,分为均质的脂肪组织回声、均质的纤维腺体回声和混杂回声3种类型。
3.6.3 有意义的异常及病灶的声像图描述
3.6.3.1 记录病灶
一般信息记录病灶所在侧、位置(需要一致的和可以重复的系统定位,诸如钟表定位、与乳头的距离)和大小(至少两个径线,大者最好三个径线),同性质的病灶较多时可选取较大及有特征的病灶测量,没有必要测量所有病灶。
3.6.3.2 病灶声像图的描述
应按照BI-RADS分类内容标准逐一进行,包括病灶的外形、边界、边缘、内部及后方回声、周围组织、病灶及周围的钙化、血流,以及采用特殊手段检查所见的各项特征,尽量用规范化术语描述,并注意保持与病灶诊断和分类的一致性。
3.6.3.3 结论
结论部分包括乳腺正常或异常、发现病灶的物理性质、对应的诊断分类及相应的处理建议(在分类中默认),如果可能的话应尽量作出适当的临床诊断。
3.6.3.4 病灶图像存储
病灶应当存储2个垂直切面以上的声像图,声像图上有完整的各种条件记述及位置标识。
3.7 报告范例
超声描述:左乳头上方(2点,距乳头10 mm处)腺体表面探及弱回声,大小为8 mm×6 mm,边界清楚,边缘光整,形态规则,内部见散在强回声,后方声影不明显,彩色超声未见明显异常血流信号。
超声提示:双乳增生伴左乳实质占位性病变(BI-RADS 3类),可能为良性病变,建议短期随访或复查。
4
常规乳腺MRI检查和报告规范
4.1 乳腺MRI检查适应证
4.1.1 乳腺癌的诊断
当乳腺X线摄影或超声检查发现病变但不能确定其性质时,可以考虑采用MRI进一步检查。
4.1.2 乳腺癌分期
由于MRI对乳腺癌检出的高敏感性,有助于发现其他影像学检查不能发现的多灶和多中心性肿瘤,有助于显示和评价肿瘤对皮肤、胸肌筋膜、胸大肌及胸壁的浸润情况。
4.1.3 新辅助治疗效果评估
对于确诊乳腺癌需进行新辅助治疗的患者,在新辅助治疗前、治疗中和治疗结束手术前行MRI检查有助于对病变治疗反应性进行评估,对治疗后残余病变范围的判断也较常规影像学检查技术更精准。
4.1.4 腋窝淋巴结转移,原发灶不明者
对于腋窝转移性淋巴结,而临床检查、X线摄影及超声检查都未能明确原发灶时,乳腺MRI有助于发现乳房内隐匿的癌灶,确定位置和范围,以便进一步治疗。
4.1.5 保乳术患者的应用
保乳手术前MRI的应用可以更为精准地确定病灶范围;保乳术后随访,则较常规影像技术更有利于鉴别肿瘤复发和术后瘢痕。
4.1.6 乳房成形术后随访
对于乳房假体植入术后者,MRI有助于植入假体完整性的评价和判断是否发生乳腺癌。
4.1.7 高危人群筛查
高危人群乳腺癌筛查年龄较非高危人群更为提前,MRI有助于高危人群的早期筛查。
4.1.8 MRI引导下的穿刺活检
MRI引导的穿刺活检适用于仅在MRI上发现的病灶,并对此靶病灶行超声检查和X线检查确认仍不能发现异常者。
4.2 乳腺MRI检查的禁忌证
⑴ 妊娠期妇女。
⑵ 体内装有起搏器、外科金属夹子等铁磁性物质及其他不得接近强磁场者。
⑶ 幽闭恐惧症患者。
⑷ 有对任何MRI造影剂如钆螯合物过敏史的患者。
⑸ 一般情况很差,无法配合俯卧,不能耐受MRI检查者。
4.3 乳腺MRI检查技术规范
4.3.1 检查前准备
4.3.1.1 临床病史
了解患者发病情况、症状、体征、家族史、高危因素,询问乳腺手术史及病理学检查结果和手术日期,月经状态及月经周期,有无激素替代治疗或内分泌治疗史,有无胸部放疗史,有无前片及其他相关检查(包括乳腺X线摄影、乳腺超声检查)。
4.3.1.2 检查前准备
作好乳腺MRI检查注意事项的宣教、解释。
最佳检查时间:由于正常乳腺组织强化在月经周期的分泌期最为显著,因而对绝经前女性推荐MRI检查尽量安排在月经周期第2周(第7~14天)进行。
4.3.2 MRI检查
4.3.2.1 设备要求
采用高场1.5 T及以上的扫描机进行乳腺MRI检查,以获得较好的信噪比和脂肪抑制效果。必须采用专用的乳腺线圈,推荐采用开放式线圈,以便必要时可以在侧方进行MRI引导的介入操作。
4.3.2.2 扫描体位
俯卧位,双侧乳房自然悬垂于乳腺线圈中央。
4.3.2.3 成像序列
一般包括横断位、矢状位和冠状位定位扫描,T1WI不抑脂序列、T2WI抑脂序列、T1WI增强扫描序列,扩散加权序列扫描,建议b值用800 s/mm2。增强序列一般行包括双乳的横断位扫描,需要有增强前的蒙片,注入造影剂后连续扫描数次,时间分辨率60 s左右(视各厂家的设置而定),增强后总扫描时间不得少于5 min,建议行等体素无间隔横断位增强扫描(可以多平面重建),最后行双乳矢状位高分辨扫描。增强扫描要求Gd-DTPA团注,标准剂量为0.1~0.2 mmol/kg,于10 s内快速团注,继而快速推注0.9%氯化钠注射液10 mL冲洗。
4.3.2.4 后处理
动态增强曲线在工作站上对增强前蒙片和增强后各期图像进行分析,将病灶最可疑的区域设为感兴趣区(region of interest,ROI),一般应避开肉眼可见的病灶内出血、坏死及囊变区,并在对侧正常乳腺组织内选取相同大小的ROI作为对照,绘制动态增强曲线。曲线判读分两部分,即早期强化和延迟强化。早期强化指注入对比剂后最初2 min或曲线开始变化前的强化率,分成缓慢强化(强化率小于50%)、中等强化(50%~100%)和快速强化(大于100%)。曲线后面部分为延迟强化,也分成3种状况,包括持续上升型(随时间的延长而继续强化,且大于早期强化最高点的10%)、平台型(随时间推移呈平台改变,如有轻度升高或流出,则变化在早期强化最高点上下10%范围之内)和流出型(强化达峰值后信号强度迅速下降范围大于峰值10%以上)。
最大信号投影(maximum intensity projection,MIP):有些设备在扫描完成后可以自动生成MIP图,是对同一期别容积扫描的乳腺进行最大信号投影产生的三维图像,可以比较直观地显示乳腺内病灶的空间位置,同时显示双侧乳腺内的血管分布情况,对诊断病灶性质有一定的鉴别诊断价值。
表观扩散系数(apparent diffusion coefficient,ADC)值测量:扩散加权序列扫描完成后,会生成扩散加权图像和相应的ADC图像。基于ADC图像像针对病灶或者对照取ROI可以测量相应的ADC值,单位为mm2/s。
4.4 诊断报告书写规范
目前的诊断报告书写规范参照美国放射学会指定并被大多数国家采用的2013版乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS),需描述病灶形态特征和动态增强曲线特征,一般形态特征的权重要高于曲线类型,但对于形态特征判断困难者,动态增强曲线类型有一定的价值。形态特征需要对增强前T1WI、T2WI上的信号特点及增强后的表现进行综合分析。但病灶形态描述则根据增强后形态进行,并将病灶分为点状强化、肿块和非肿块强化三大类。乳腺MRI诊断报告范本见附录Ⅳ。
4.4.1 点状强化
点状强化指<5 mm的强化,不具有明显的占位效应,平扫时多不显示。可以多发,但不会聚集成簇。点状强化可能由腺体局限性增生所引起,也可以是乳头状瘤、纤维腺瘤及乳内淋巴结等良性改变,<3%的情况可能是恶性病变,可以是浸润性癌或原位癌。对形态可疑、新发或较前增大的点状强化可建议活检。一般对点状强化予以随访即可。
4.4.2 肿块
具有三维空间的占位性病变,伴或不伴周围正常组织移位或浸润。从形态(圆形、卵圆形或不规则形)、边缘(光整、不规则或星芒状)和内部强化情况(均匀、不均匀、环形强化或低信号分隔)三个方面来描述。不规则的形态,不规则和星芒状的边缘,内部强化不均匀,以及不规则的环形强化是偏恶性的征象。
4.4.3 非肿块强化
当乳腺内出现既非点状亦非肿块的强化时,即为非肿块强化,一般占位效应不明显。分类主要依据其形态特征(线状、局灶性、段样、区域性、多区域或弥漫性)、内部强化特征(均匀、不均匀、集群卵石样或簇状小环样强化)、病灶是否双侧对称三个方面进行分析,双侧对称的非肿块强化可能是一种良性改变。形态中的线样强化如沿着导管走行,并且出现分支,则为偏恶性的征象,段样强化也是偏恶性的征象。内部增强特征中的集群卵石样强化和簇状小环样强化为偏恶性的征象。
4.4.4 其他征象和伴随征象
其他征象有乳内淋巴结,皮肤上的病变,含脂肪的病变,一些不强化的病灶如T1WI增强前高信号的导管、囊肿、血肿及不强化的肿块等。
伴随征象有乳头内陷及侵犯、皮肤增厚、内陷和侵犯、胸肌侵犯、淋巴结异常等。伴随征象可与其他异常征象一同出现,亦可单独出现。发现伴随征象的意义在于当与其他异常征象同时出现时,可提高乳腺癌的诊断权重。当确诊为乳腺癌时,某些伴随征象的出现将影响术前分期及治疗方式的选择。
4.4.5 病灶定位
⑴ 先定位病变位于哪一侧乳房。
⑵ 乳房确定后,则继续将病灶定位在以下7个区域:外上、外下、内上、内下4个象限区域,这4个区域也可以面向观察者进行钟面定位;另外3个区域则不需要结合钟面定位,分别是乳晕后区、中央区和尾叶区。乳晕后区和中央区均位于从乳头向胸壁垂直的中轴线上,乳头基底后方2 cm范围内是乳晕后区,2 cm后则是中央区。尾叶区位于乳腺外上近腋下的乳丘内。
⑶ 病变的深度:在横断位或矢状位上,与胸壁平行分前带、中带、后带,给病灶进行深度定位。一般需测量病灶与乳头的距离。
4.5 乳腺MRI报告的组成
乳腺的MRI报告内容应包括病史简述、与既往检查(包括常规影像检查)对比、扫描技术、乳房的纤维腺体构成、实质背景强化及任何相关的影像学发现,最后是评估分类和处理建议。报告措辞应当简洁,使用BI-RADS术语词典中的标准词汇。可行的话,MRI诊断报告应当与临床检查、X线和超声检查结果相参照,特别是对MRI阳性发现与触诊、X线和超声检查的阳性发现在空间位置的对应关系是否一致性的评估,对非一致的病灶尤其需要强调,以引起临床医师的注意。应重视实质背景强化对MRI检出敏感性的影响,实质背景强化分成轻微、轻度、中度和明显4个等级。随着注入对比剂时间的推移,实质背景强化的程度和范围会逐渐增强增大,并且两侧对称。总体上明显的实质背景强化会增加乳腺MRI检查的“回叫率”,但是恶性病灶的检出并不会受太大的影响。与乳腺X线检查一样,乳腺MRI的检查结果即BI-RADS分类也分为0~6类共7个类别。
4.5.1 评估不完全
BI-RADS 0类:需要进一步影像评估。一般MRI检查后较少用这个分类。但在一些特殊的情况下,如使用合适的扫描技术再做一次MRI检查,需参考既往的乳腺X线和超声检查结果,或充分考虑乳腺既往病史,此时可以用这个评估。
4.5.2 评估完全
⑴ BI-RADS 1类:阴性。
⑵ BI-RADS 2类:良性病变,如无强化的纤维腺瘤、囊肿、无强化的陈旧性瘢痕、乳腺假体,以及含脂肪的病变如油性囊肿、脂肪瘤、错构瘤等。这一分类无恶行征象发现。
⑶ BI-RADS 3类:可能是良性病变,建议短期随访,恶性的可能性非常低,小于2%。良性可能性非常大,但需要通过随访确认其稳定性。较可疑者可3个月后随访,一般是6个月后复查。
⑷ BI-RADS 4类:可疑恶性,要考虑活检。不具有乳腺癌的典型表现,但不能排除乳腺癌的可能性,建议做活检,此类病灶的恶性概率为2%~95%。也可以参照乳腺X线检查分类进而将病灶细分为4A类(恶性概率为2%~10%)、4B(恶性概率为10%~50%)和4C类(恶性概率为 50%~95%)。
⑸ BI-RADS 5类:高度怀疑恶性,应进行临床干预(恶性概率≥95%)。
⑹ BI-RADS 6类:已经活检证实为恶性,但还是需要再做扩大手术的病例,MRI检查的目的是评估是否有残存病灶。
5
影像学引导下的乳腺组织学活检指南
影像学引导下乳腺组织学活检一般是指在乳腺X线、超声和MRI影像引导下进行乳腺组织的病理学检查(简称活检),特别适合于未扪及的乳腺病灶(如小肿块、钙化灶及结构扭曲等)。具体包括影像引导下空芯针穿刺活检、真空辅助活检和钢丝定位手术活检等。
5.1 适应证
5.1.1 乳腺超声影像引导下乳腺病灶活检
⑴ 乳腺超声发现未扪及的可疑乳腺占位性病变,BI-RADS≥4类或部分3类病灶,若有必要时也可考虑活检。
⑵ 可扪及乳腺肿块,且超声提示相应部位有乳腺内占位性病变,需要行微创活检或微创切除以明确诊断。
5.1.2 乳腺X线影像引导下乳腺病灶活检
⑴ 乳腺未扪及肿块,而乳腺X线检查发现可疑微小钙化病灶,BI-RADS≥4类。
⑵ 乳腺未扪及肿块,而乳腺X线发现其他类型的BI-RADS≥4类的病灶(如肿块、结构扭曲等),并且超声下无法准确定位。
⑶ 部分3类病灶,如果其他影像学检查提示相应部位有可疑病灶,也可考虑活检。
⑷ 乳房体检扪及肿块,且乳腺X线摄影提示相应位置有占位性病变,需要行微创活检或微创切除以明确诊断。
5.1.3 其他
对有条件的单位应积极提倡在手术前进行影像学引导下的微创活检(空芯针穿刺活检或真空辅助活检),如不具备条件可考虑直接行影像学引导下钢丝定位手术活检。
5.2 对影像学引导乳腺活检设备的要求
5.2.1 乳腺X线影像引导
乳腺X线立体定位床或配备定位活检装置的乳腺X线机。
5.2.2 乳腺超声影像引导
高频乳腺超声探头:频率7~15 Hz。
5.2.3 乳腺磁共振成像引导
对于MRI发现的病灶,而X线、超声检查没有发现者,首先建议超声复查。如果超声检查在相应部位发现病灶,建议在超声引导下进行活检,如超声检查未能发现,则在具备条件的单位,可行MRI引导下活检。
5.2.4 用于手术活检的定位导丝
单钩或双钩钢质导丝(推荐规格20~22 G)。
5.2.5 微创活检设备
空芯针弹射式活检枪(推荐规格14 G),真空辅助乳腺定向活检系统(推荐规格8~11 G)。
5.3 影像引导下钢丝定位手术活检
5.3.1 禁忌证
禁忌证为有重度全身性疾病及严重出血性疾病者。
5.3.2 术前准备
⑴ 签署知情同意书。
⑵ 核对和确认影像学资料,建议临床医师用记号笔在乳腺X线片或乳房上勾画出病灶大致的部位,在保乳手术和保留皮肤全乳切除患者中,可标记手术切口。
⑶ 检查影像定位设备,确保精度和准度。
⑷ 术前血常规检查和凝血功能实验室检查。
5.3.3 术中注意事项
⑴ 手术操作在影像引导下放置定位钢丝至病灶中央部位;如有必要,可考虑在病灶周围放置多根钢丝,以利于精确的定位。
⑵ 摄片或录像记录影像定位下病灶和穿刺针的位置,留档。
⑶ 活检穿刺针道和定位钢丝插入点尽量位于外科医师标记的手术切口范围内。
⑷ 术中切除以定位钢丝顶端为中心至少半径2 cm范围内的乳腺组织(2 cm并非绝对,具体切除活检范围应该根据病灶大小、临床医师判断的恶性风险决定)。标本离体时,亦可考虑使用金属标记物标记标本切缘的4个方向再进行摄片,以利于在X线片上评估钙化灶在标本上的确切位置并确定补充切除的方向。
⑸ 微小钙化灶的活检标本应当立即摄片,待手术者确认取到病灶后,并将标本影像片和标本一起送病理学检查。对于所有临床不可触及的微小病灶,避免术中快速冷冻切片病理学检查,应采取常规石蜡切片;对于可完整切除的病灶,对标记切缘也要进行病理学检查。
5.4 影像引导下的乳腺微创活检
5.4.1 禁忌证
禁忌证为有重度全身性疾病及严重出血性疾病者。
5.4.2 术前准备
⑴ 签署知情同意书。
⑵ 核对和确认影像资料,乳腺X线和乳腺超声再次定位,并做相应标记。
⑶ 检查影像引导设备和微创活检设备(活检枪、真空辅助乳腺定向活检系统等),确保精度和准度。
⑷ 术前血液检验指标:血常规检查和凝血功能实验室检查。
5.4.3 术中注意事项
⑴ 选择切口,采用就近原则,同时还需考量活检后的美观性。
⑵ 摄片或录像记录影像定位下病灶和穿刺针的位置,留档。
⑶ 取材足量,保证病理学诊断。有条件的中心,应该在活检部位放置金属标记。
⑷ 活检结束后压迫手术部位5~15 min。
5.4.4 术后乳房和标本的处理
⑴ 术后应加压包扎至少24 h。若出现瘀血斑或血肿可延长包扎1~2 d,一般2~4周后瘀血斑或血肿可消退。
⑵ 微小钙化灶的活检标本应当立即行乳腺X线摄片以确认是否取到病灶。
⑶ 将含有钙化的标本条与不含钙化的标本条分装于不同的容器内,用4%甲醛溶液固定,送检。如一侧乳房有多个肿物行麦默通微创旋切时,应标记手术切除顺序,标本分别标号并分装在不同的容器内,用4%的甲醛溶液固定,送检。
6
乳腺癌病理学诊断报告规范
6.1 标本类型及固定
6.1.1 标本类型
日常工作中常见的乳腺标本类型包括空芯针穿刺活检标本、真空辅助微创活检标本和各种手术切除标本[乳腺肿物切除术、乳腺病变保乳切除术、乳腺单纯切除术和乳腺改良根治术标本、前哨淋巴结活检(sentinel lymph node biopsy,SLNB)标本、腋窝淋巴结清扫术(axillary lymph node dissection,ALND)标本]。
6.1.2 标本固定
穿刺或切除后的乳腺组织应立即固定(不得超过1 h)。应选择足够的磷酸缓冲液配制的4%中性甲醛固定液。对于切除标本,应将其每隔5 mm切开,宜用纱布或滤纸将相邻的组织片分隔开,以保障固定液的充分渗透和固定。固定时间6~72 h。
6.2 取材及大体描述规范
接受标本时,必须核对姓名、床位号、住院号、标本名称及部位。
6.2.1 空芯针穿刺活检标本
⑴ 大体检查及记录:标明穿刺组织的数目,每块组织的大小,包括直径和长度。
⑵ 取材:送检组织全部取材。空芯针穿刺活检标本不宜行术中病理学诊断。
6.2.2 真空辅助微创活检标本
⑴ 大体检查及记录:标明活检组织的总大小。
⑵ 取材:送检组织全部取材。如临床送检组织标记“钙化”及“钙化旁”,需记录注明,并将其分别置于不同的包埋盒中。真空辅助微创活检标本不宜行术中病理学诊断。
6.2.3 乳腺肿块切除标本
⑴ 大体检查及记录:按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的部位。测量标本三个径线的大小;若带皮肤,应测量皮肤的大小。测量肿瘤或可疑病变三个径线的大小。记录肿瘤或可疑病变的部位和外观。记录每块组织所对应的切片总数及编号。
⑵ 术中冷冻取材:沿标本长轴每隔5 mm做一个切面,如有明确肿块,在肿块处取材。如为钙化灶,宜对照X线摄片对可疑病变取材。如无明确肿块,在可疑病变处取材。
⑶ 常规石蜡包埋标本取材:若肿块或可疑病变最大径小于或等于5 cm,应至少每1 cm取材1块,必要时(如DCIS)宜将病变全部取材后送检。若肿块或可疑病变最大径大于5 cm,应每1 cm至少取材1块,必要时需补充取材甚至全部取材。乳腺实质的其他异常和皮肤均需取材。
6.2.4 乳腺病变保乳切除标本
6.2.4.1 大体检查及记录
⑴ 按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的部位。
⑵ 测量标本三个径线的大小,若附带皮肤,也需测量皮肤的大小。
⑶ 根据临床标记,正确放置标本,建议将标本各切缘(表面切缘、基底切缘、上切缘、下切缘、内切缘、外切缘)涂上不同颜色的染料。
⑷ 按从表面到基底的方向,沿标本长轴每隔5 mm做一个切面,将标本平行切分为若干块组织,并保持各块组织的正确方向和顺序。
⑸ 仔细查找病灶,并测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述残腔大小及有无残留病灶。
⑹ 测量肿瘤、瘤床或残腔距各切缘的距离,观察最近切缘。
⑺ 记录每块组织所对应的切片编号及对应取材内容。
6.2.4.2 取材
⑴ 切缘取材:保乳标本切缘取材主要有两种方法:垂直切缘放射状取材(radial sections perpendicular to the margin)和切缘离断取材(shave sections of the margin)。两种切缘取材方法各有优缺点。无论采取何种取材方法,建议在取材前将6处标本切缘涂上不同颜色的墨水,以便在镜下观察时能根据不同颜色对切缘作出准确的定位,并正确测量肿瘤和切缘的距离。保乳标本病理学检查报告中需明确切缘状态(阳性或阴性)。“阳性切缘”是指墨染切缘处有DCIS或浸润性癌侵犯。“阴性切缘”的定义并不一致,但多数指南或共识中将墨染切缘处无肿瘤定义为“阴性切缘”。对于切缘阴性者,建议报告切缘与肿瘤的距离,应尽量用客观的定量描述,而不建议用主观描述(如距切缘近等)。
⑵ 垂直切缘放射状取材(图1A):根据手术医师对保乳标本做出的方位标记,垂直于基底将标本平行切成多个薄片(建议间隔5 mm),观察每个切面的情况。描述肿瘤大小、所在位置及肿瘤距各切缘的距离,取材时将大体离肿瘤较近处的切缘与肿瘤一起全部取材,大体离肿瘤较远处的切缘抽样取材,镜下观察时准确测量切缘与肿瘤的距离。“垂直切缘放射状取材”的优点是能正确测量病变与切缘的距离,缺点是工作量较大,且对大体离肿瘤较远的切缘只抽样取材。
⑶ 切缘离断取材(图1B):将6处切缘组织离断,离断的切缘组织充分取材,镜下观察切缘累及情况。切缘离断取材的优点是取材量相对较少,能通过较少的切片对所有的切缘情况进行镜下观察,缺点是不能准确测量病变与切缘的距离。
⑷ 肿瘤及周围组织取材:若肿块或可疑病变最大径小于或等于5 cm,应沿肿瘤或可疑病变的最大切面至少每1 cm取材1块,必要时(如DCIS)宜全部取材后送检。若肿块或可疑病变最大径大于5 cm,则每1 cm至少取材1块;如已诊断为DCIS,建议将病灶全部取材。若为新辅助治疗后标本,则参照《乳腺新辅助治疗的病理诊断专家共识(2020版)》(附录Ⅴ-A)进行取材。若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
⑸ 补充切缘取材:若首次切除时为阳性切缘,需再次送检切缘。补充切缘亦可作为单独的标本同切除组织一同送检。若外科医师已对补充切缘中真正的切缘做了标记,可用染料对真正切缘处进行涂色,垂直于标记处切缘将标本连续切开并送检。如果标本较小,所有组织应全部送检。
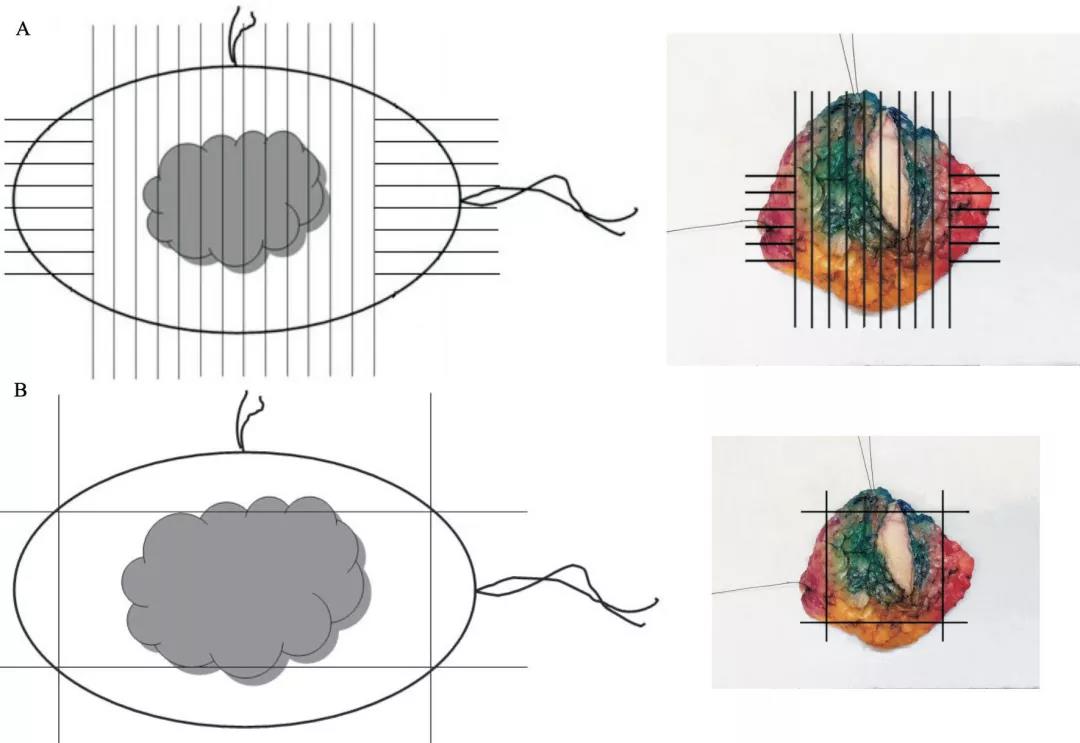
图 1 垂直切缘放射状取材(A)和切缘离断取材(B)
6.2.5 乳腺切除术(包括单纯切除术和改良根治术)
6.2.5.1 大体检查及记录
按正确的方向摆放标本以便识别肿瘤所在的象限:改良根治术标本可通过识别腋窝组织来正确定位(腋窝组织朝向外上方)。单纯切除术标本,需根据外科医师的标记来定位,若未标记方向,则应与外科医师联系以确定标本的正确方向。建议标本的基底切缘涂上染料以便镜下观察切缘情况。测量整个标本及附带皮肤、腋窝组织的大小。描述皮肤的外观,如有无手术切口、穿刺点、瘢痕、红斑或水肿等。从基底部水平切开乳头,取乳头水平切面组织一块以观察输乳管的横断面,而后垂直于乳腺表面切开乳头其他组织。描述乳头、乳晕的外观,如有无破溃及湿疹样改变等。垂直于基底将标本切成连续的薄片。记录病灶所在象限位置,描述肿瘤的特征(质地、颜色、边界、与皮肤及深部结构的关系)。若有明确肿块,则测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述手术残腔大小及有无残留病灶。测量肿瘤、残腔、瘤床距最近表面切缘及基底切缘的距离,描述非肿瘤乳腺组织的情况。将腋窝脂肪组织同标本离断后,仔细寻找淋巴结,对规范的腋窝清扫标本宜至少找到10枚淋巴结。描述淋巴结的总数目及最大径范围、有无融合、有无与周围组织粘连。注意需附带淋巴结周围的结缔组织。
6.2.5.2 取材
原发肿瘤和手术残腔的取材:若为肿瘤,送检肿瘤的最大切面;若肿块或可疑病变最大径小于或等于5 cm,应至少每1 cm取材1块,必要时(如DCIS)宜全部取材后送检。若标本肿块或可疑病变最大径大于5 cm,则每1 cm至少取材1块,如已诊断为DCIS,应将病灶全部取材。若为化疗后瘤床,则参照《乳腺癌新辅助治疗的病理诊断专家共识(2020版)》取材。若为手术残腔,送检代表性的切面,包括可疑的残留病灶。对其余组织的异常病灶、乳头、距肿瘤最近处表面被覆皮肤、距肿瘤最近处基底切缘进行取材,尽可能取切缘的垂直切面。周围象限乳腺组织每个象限代表性取材1块。腋窝淋巴结:若淋巴结肉眼观察为阴性,则送检整个淋巴结行组织学检查;若淋巴结肉眼阳性,则沿淋巴结最大径剖开后取组织送检,注意需附带淋巴结周围的结缔组织,以识别淋巴结被膜外的肿瘤转移灶。
6.2.6 SLNB
⑴ 乳腺癌SLNB已逐渐取代传统的ALND来评估早期乳腺癌患者的区域淋巴结情况,SLNB阴性者可避免ALND。孤立肿瘤细胞(isolated tumor cells,ITC):淋巴结中的肿瘤病灶直径≤0.2 mm,或单张切片上的肿瘤细胞<200个。美国癌症联合会(American Joint Committee on Cancer,AJCC)定义其为pN0(i+)。微转移:肿瘤转移灶最大径>0.2 mm,但不超过2 mm。AJCC定义其为pN1mi。ITC与微转移有着本质的不同,前者为pN0,后者为pN1。宏转移:肿瘤转移灶最大径>2 mm。
⑵ 术中病理学评估:前哨淋巴结中术中病理学评估的主要目的是检测出淋巴结中的转移病灶,从而进行ALND,以避免二次手术。术中病理学评估的方法主要包括术中细胞印片和术中冷冻切片:①术中细胞印片:将淋巴结每间隔2 mm切 成若干片组织(图2),仔细检查每片组织上是否存在肉眼可见的转移灶,对每个切面行细胞印片。术中细胞印片的优点是可保全整个淋巴结组织,对组织基本无损耗,可对淋巴结的不同切面取材,价廉,所需时间短,制作流程简单;缺点是在印片的高细胞背景下辨认出分散的癌细胞(如小叶癌)有一定难度。术中细胞印片有很好的诊断特异性,但其诊断敏感性受多种因素的影响。②术中冷冻切片:将淋巴结每间隔2 mm切成若干片组织,仔细检查每片组织上是否存在肉眼可见的转移灶,每片组织制成冷冻切片行病理学评估。术中冷冻切片的优点是诊断特异性好,能够避免因假阳性而造成不必要的ALND;缺点是组织损耗,用时长,费用较高,且难以评估脂肪化的淋巴结等。
⑶ 术后常规石蜡包埋组织病理学评估:将淋巴结每间隔2 mm切成若干片组织,每个蜡块至少切1张切片。
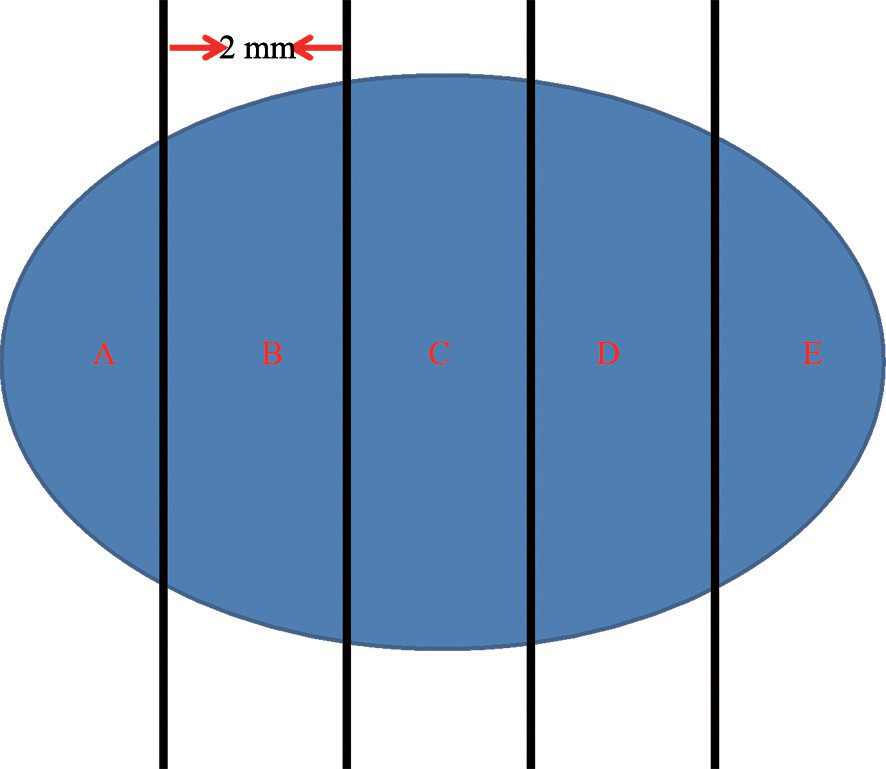
图 2 将前哨淋巴结每间隔2 mm切成若干片组织,每片组织均包埋成石蜡组织块
6.3 病理学诊断分类、分级和分期方案
6.3.1 组织学分型
参见附录Ⅴ-B,组织学分型主要依据2019版世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类,某些组织学类型的准确区分需行免疫组织化学和(或)分子病理学检测后确定。
6.3.2 组织学分级
浸润性乳腺癌和DCIS的组织学分级参见附录Ⅴ-C。
组织学分级是重要的预后因素。推荐采用Nottingham分级系统对浸润性乳腺癌进行组织学分级。根据腺管形成的比例、细胞的异型性和核分裂象计数三项指标分别独立评估,各给予1~3分,相加后根据总分将浸润性癌分为高、中、低三个级别。腺管分化程度的评估针对整个肿瘤,需要在低倍镜下评估。只计数有明确中央腺腔且由有极向肿瘤细胞包绕的结构,以腺管/肿瘤区域的百分比表示。细胞核多形性的评估要选取多形性最显著的区域。该项评估参考周围正常乳腺上皮细胞的细胞核大小、形状和核仁大小。当周边缺乏正常细胞时,可用淋巴细胞作为参照。当细胞核与周围正常上皮细胞的大小和形状相似、染色质均匀分布时,视为1分;当细胞核比正常细胞大,形状和大小有中等程度差异,可见单个核仁时,视为2分;当细胞核的大小有显著差异,核仁显著,可见多个核仁时应视为3分。只计数明确的核分裂象,不计数核浓染和核碎屑。核分裂象计数区域必须根据显微镜高倍视野的直径进行校正。核分裂象计数要选取增殖最活跃的区域,一般常见于肿瘤边缘,如果存在异质性,要选择核分裂象多的区域。
6.3.3 乳腺癌的分期
参见AJCC第8版乳腺癌分期系统。包括传统的解剖学分期和预后分期。解剖学分期包括了肿瘤的大小、累及范围(皮肤和胸壁受累情况)、淋巴结转移和远处转移情况。肿瘤大小的测量有多种方法,包括临床体检、影像学评估、病理大体测量和显微镜下测量。乳腺癌分期中涉及的肿瘤大小是指浸润癌的大小。由于体检、影像学及大体检查均无法区分浸润性癌和DCIS,因此显微镜下测量应该是最准确的测量方式。如果浸润性癌范围较大,无法用一个蜡块全部包埋,则以巨检时的肿瘤大小为准。若浸润性癌病灶局限,可以用一个蜡块全部包埋,则肿瘤大小以显微镜下测量的大小为准。
⑴ 如果肿瘤组织中有浸润性癌和原位癌两种成分,肿瘤的大小应该以浸润性成分的测量值为准。
⑵ 原位癌伴微浸润:出现微浸润时,应在报告中注明,并测量微浸润灶最大径;如为多灶微浸润,浸润灶大小不能累加,需在报告中注明多灶微浸润,并测量最大浸润灶的最大径。
⑶ 对于肉眼能确定的发生于同一象限的两个以上多个肿瘤病灶,应在病理学报告中注明为多灶性肿瘤,并分别测量大小,以最大浸润病灶作为分期依据。
⑷ 对于肉眼能确定的发生于不同象限的两个以上肿瘤病灶,应在病理学检查报告中注明为多中心性肿瘤,并分别测量大小。
⑸ 如果肿瘤组织完全由DCIS组成,应尽量测量其范围。淋巴结状态是决定乳腺癌患者治疗和预后的重要因素,对于淋巴结转移数位于分期临界值(如1、3和10个转移)附近时,要特别仔细观察淋巴结的转移数目,从而作出准确的pN分期判断。预后分期是在传统解剖学分期基础上增加生物学信息,是解剖学分期的完善和补充。
6.3.4 免疫组织化学和肿瘤分子病理学检测及其质量控制
⑴ 应对所有乳腺浸润性癌病例进行雌激素受体(estrogen receptor,ER)、孕激素受体 (progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)免疫组织化学染色,HER2 2+病例应进一步行原位杂交检测。对DCIS也建议进行ER、PR及HER2免疫组织化学染色。ER、PR的病理学报告需包含阳性细胞强度和百分比。ER、PR检测参考中国《乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)》(参见附录Ⅴ-D),细胞核ER/PR染色1%~10%定义为“阳性(低表达)”。HER2检测参考中国《乳腺癌HER2检测指南(2019版)》(参见第14章,附录Ⅴ-E)。
⑵ 应对所有乳腺浸润性癌进行Ki-67增殖指数检测,并对癌细胞中阳性染色细胞所占的百分比进行报告。
⑶ PD-L1检测:目前临床研究中采用的PD-L1检测是一套完整的系统,包括所采用的抗体、检测平台和判读系统。常用的PD-L1抗体包括SP142(Ventana)和22C3(DAKO),前者的判读采用免疫细胞评分,后者采用综合阳性评分(CPS评分)。
⑷ 可进行肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)报告。
⑸ 开展乳腺癌免疫组织化学和分子病理学检测的实验室应建立完整有效的内部质量控制体系,具有合格资质的病理实验室应满足以下条件:①应建立完善的标准操作程序,并严格遵照执行,做好每次检测情况的记录和存档工作。应开展同一组织不同批次染色结果的重复性分析。检测相关的仪器和设备应定期维护、校验。任何操作程序和试剂变化均应重新进行严格的验证。②从事乳腺癌免疫组织化学和分子病理学检测的实验技术人员和病理学医师应定期进行必要的培训、资格考核和能力评估。③实验室外部质控可通过参加有关外部质控活动来实现。外部质控的阳性和阴性符合率应达到90%以上。外部质控活动推荐每年参加1~2次。不具备检测条件的单位应妥善地保存好标本,以供具有相关资质的病理实验室进行检测。
6.3.5 病理报告内容及规范
乳腺浸润性癌的病理报告(参见附录Ⅴ-F)应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无并存的DCIS、有无淋巴管血管侵犯(lymphovascular invasion,LVI)、切缘和淋巴结情况等,还应包括ER、PR、HER2表达情况及Ki-67增殖指数。若为治疗后乳腺癌标本,则应对治疗后反应进行病理学评估。DCIS的病理学诊断报告应报告核级别(低、中或高级别)和有无坏死、手术切缘情况以及ER、PR和HER2表达情况。对癌旁良性病变,应明确报告病变名称或类型。对保乳标本的评价应包括大体检查及显微镜观察中肿瘤距切缘最近处的距离、若切缘阳性,应注明切缘处肿瘤的类型。LVI需要与乳腺癌标本中经常出现的组织收缩引起的腔隙鉴别。相对而言,收缩腔隙在肿瘤组织内更常见,而在肿瘤主体周围寻找LVI更可靠。
中国癌症杂志 平台发布
查看更多