查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





自身免疫性胃炎,也称A型胃炎,是一种影响胃泌酸黏膜的非自限性、慢性炎症性疾病,可导致胃黏膜出现进行性萎缩。病变部位主要位于胃体及胃底,胃窦通常不受累。如果内镜医生遗漏此病,可能延误患者病情,特别是当患者出现神经症状时,神经损伤是不可逆的,且部分患者可能合并其他自身免疫性疾病,因此,提高对此病的认识度,早期识别A型胃炎,具有重要意义。
A型胃炎的发病机制及临床过程仍不十分清楚,目前认为是CD4+T细胞针对胃壁细胞产生自身免疫反应,导致壁细胞破坏,泌酸黏膜受损,胃酸分泌减少或缺乏,胃黏膜萎缩。
此外,越来越多的证据表明幽门螺杆菌(Hp)可能也与A型胃炎发病相关,可能是自身免疫反应的感染性触发因素。
A型胃炎的发病率处于低估状态,由于患者最初通常无症状或仅有轻微的消化道症状,只有到晚期出现微量元素缺乏相关症状时才引起重视,因此常出现诊断延误的情况。
A型胃炎的临床症状包括:
与胃酸缺乏导致胃动力减弱及肠道菌群改变有关,常见的有消化不良、餐后饱腹感、早饱感、恶心、体重下降,值得注意的是,A型胃炎的患者也可能出现胃食管反流症状,大部分为非酸反流。
任何类型的贫血,以巨幼细胞贫血更为多见,有时可出现全血细胞减少,患者可出现面色苍白、头晕、乏力、疲惫感、呼吸困难等表现。
主要与维生素B12缺乏有关,既能影响中枢神经系统,又影响外周神经系统,患者临床表现多样。包括感觉、外周神经、本体感觉、认知、情绪功能障碍、麻木、共济失调等。神经系统症状应当早期识别并处理,因为后期即便给予补充微量元素治疗,神经损伤也是不可逆的。
其他症状包括高同型半胱氨酸血症(动脉粥样硬化的危险因素)、不孕、复发性流产等。
A型胃炎主要根据组织病理学特征进行诊断,内镜和自身抗体的血清学检测可用作辅助诊断。
组织学诊断是诊断A型胃炎的金标准。随着疾病进展,典型的组织学表现不断发生变化。早期表现为泌酸黏膜固有层内弥漫性、基底为主的炎症。淋巴细胞与浆细胞、嗜酸性粒细胞和肥大细胞混合。可见淋巴细胞浸润腺体的斑片状病灶及继发性凋亡小体。泌酸腺被破坏后,壁细胞可能出现假性肥大。随着疾病进展,早期观察到化生持续存在,但肠化生也通常显著,ECL细胞开始增生。疾病终末期主要表现为泌酸腺几乎完全缺失,上皮化生明显,ECL细胞增生,但炎症减轻。
A型胃炎内镜下早期胃黏膜无明显变化,随着萎缩进展,胃底及胃体黏膜变薄、皱襞变平、血管透见(如合并幽门螺杆菌感染,可出现胃窦萎缩),并可见多发小结节,以增生性息肉最常见,见于10%~40%的患者。息肉多无蒂,直径小于2 cm,常为多发性。由于息肉数量众多,与息肉病相似,如果不对邻近黏膜进行活检,则可能漏诊A型胃炎。当然,部分息肉也可能是神经内分泌瘤或腺瘤性息肉。
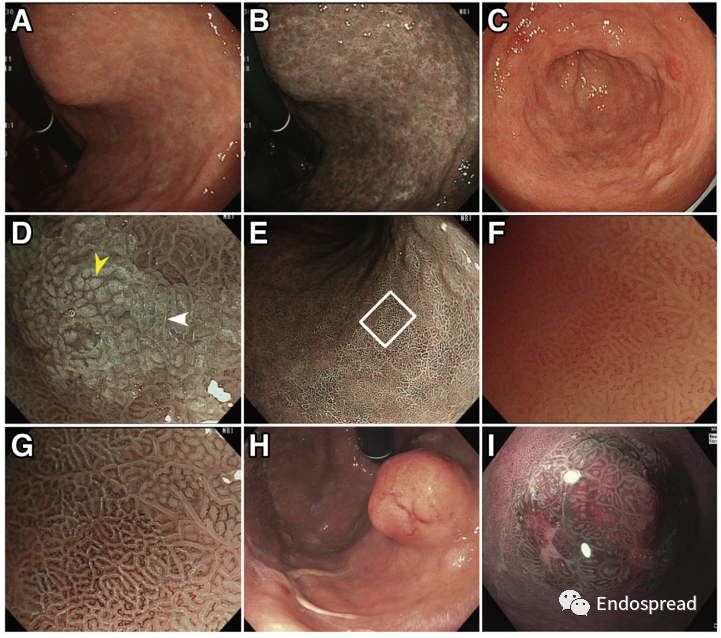
图片来源:Gastroenterology 2021;161:1325–1332 (A型胃炎内镜表现:A-B:黏膜苍白,皱襞消失,黏膜下血管可见,C-G:肠化改变,H-I:神经内分泌瘤)。
血清生物标志物包括两类:一类为胃蛋白酶原(PG)和胃泌素(G-17);另一类为壁细胞抗体、内因子抗体和幽门螺杆菌抗体等。PG、G-17及自身抗体的联合检测也被称为“血清学活检”,其与病理活检的一致性良好,并且具有非侵入性、简便易行等优点。但是由于现有许多研究对于其界值的标准还有一定争议,故目前多用于筛查及辅助诊断,并不用于单独诊断。
目前尚缺乏有效的根治方法,主要是对症治疗,疾病早期阶段的治疗重点是预防,确诊后须定期随访复查。
如Hp检测阳性,须行根除治疗。对于有消化不良症状的患者,可使用促胃动力药和消化酶制剂来改善患者的症状。对于贫血患者须补充铁剂、维生素B12、叶酸等纠正贫血。
激素能通过胃黏膜再生改善A型胃炎病情,但停药后会复发。骨髓移植重建免疫系统被认为是有可能治愈A型胃炎的途径。异体移植可治愈疾病,但受预处理毒性和排斥反应并发症的限制;自体移植毒性小,但疾病复发率高。
此外,对A型胃炎患者应长期随访,每年复查胃泌素、维生素B12、血清铁和血常规。并进行内镜随访监测,内镜随访监测应重点关注胃黏膜的萎缩程度以及癌前病变的情况:
活检有中重度萎缩并伴有肠化生的慢性萎缩性胃炎患者应1年左右随访一次,不伴有肠化生或上皮内瘤变的慢性萎缩性胃炎可酌情内镜和病理随访。伴有低级别上皮内瘤变并证实此标本并非来源于癌旁者,根据内镜和临床情况缩短至6个月左右随访一次,而高级别上皮内瘤变须立即确认,证实后行内镜下治疗或手术治疗。
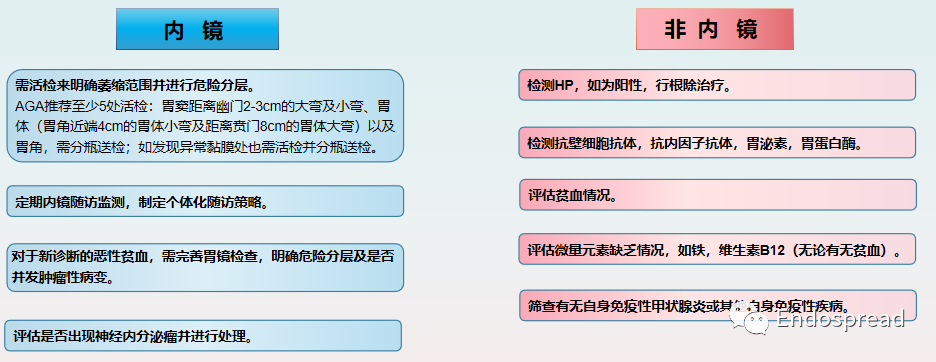
参考资料:Gastroenterology 2021;161:1325–1332
来源:Endospread
查看更多