目前AE诊断标准
查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





自身免疫性脑炎(autoimmune encephalitis,AE)是一类越来越常见的炎症性脑部疾病。AE患儿表现为急性或亚急性起病的神经精神症状,归因于其潜在的中枢神经系统异常免疫反应。许多AE与针对细胞表面抗原的抗体相关,如突触受体和离子通道。与细胞表面抗原结合的自身抗体通常是具有致病性的,而与细胞内抗原结合的自身抗体不一定具有致病性,而通常是自身免疫标记物。
已有不少抗体在AE患儿中被发现。到目前为止,儿童最常见的自身抗体针对N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)、髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)和谷氨酸脱羧酶65(glutamic acid decarboxylase 65,GAD65)。并不是所有具有AE临床表型的患儿都存在已知自身抗体。
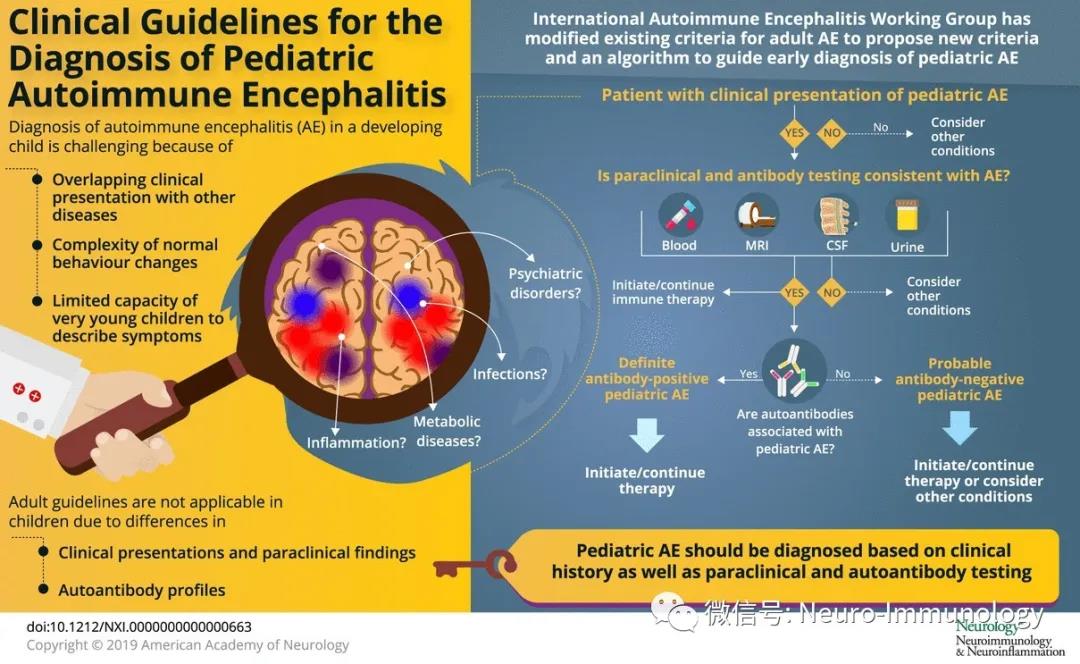
AE的诊断具有挑战性,因为各种类型的AE、其他炎症性脑部疾病、感染、代谢性疾病和精神障碍具有相似的临床表现。在儿童中诊断尤为困难,因为儿童正常行为变化较为复杂,而且幼儿无法准确描述其症状。与成人AE患者相比,儿童可能会表现出非常不同的症状、检查发现、并发症、治疗反应和预后。延误治疗会使预后变差,增加永久性认知功能缺损的风险,因此,亟须早期识别AE患儿。
本文依据已经制定的成人AE临床诊断共识,并针对儿童进行优化调整。专家组提出了临时的儿童AE分类标准和一种有助于早期诊断的流程。AE的诊断依靠于与疾病相符的临床病史和支持性辅助检查的结合,包括但不依赖于抗体检测。专家组还讨论了疑似AE患儿的鉴别诊断。
目前AE诊断标准
国际脑炎协作组2013感染性/自身免疫性脑炎诊断标准指出,患者需要存在超过24小时的精神状态改变,而不能其他病因来解释。确诊还需满足以下至少3条标准:发热持续72小时,新发局灶性神经功能缺损,脑脊液有核细胞增多,影像学提示脑炎样新发病灶,符合脑炎改变的异常脑电图。但该诊断标准无法区别自身免疫性或感染性脑炎。
2016年,国际协作组提出了成人自身免疫性脑炎的诊断标准,包括:
(1)亚急性病起病(小于3个月)的工作记忆下降、意识状态改变或精神症状;
(2)至少存在以下1条:新发局灶性中枢神经系统症状;不能用既往病史解释的癫痫发作;脑脊液有核细胞数增多;脑MRI提示脑炎样改变;
(3)排除其他诊断。
特异性神经系统综合征有各自标准,包括边缘叶(边缘性)脑炎、抗NMDAR抗体脑炎和自身抗体阴性AE。
以上这些AE诊断标准在应用于儿童时需要进行修订。例如,幼儿的工作记忆下降难以辨别。患儿常常不太可能出现明确的神经系统综合征,即使是抗NMDAR抗体脑炎,临床症状演变也与成人不同。对于表现为颞叶癫痫和认知功能下降的患儿,其鉴别诊断是非常广泛的,而成人患者的鉴别诊断主要为边缘叶脑炎和获得性颞叶病变。
成人和儿童AE的临床表现
AE患儿一般既往体健,表现为快速进展的神经精神症状。超过50%的患者出现包括发热在内的前驱症状。在起病和开始治疗之间,症状通常会持续一段时间。这将AE与儿童急性起病的神经精神综合征(pediatric acute-onset neuropsychiatric syndrome,PANS)区别开来,在PANS中,患者常经历复发-缓解病程,迅速发展为最严重的症状,并在数小时或数日之内迅速恢复到病前状态,有时甚至无须治疗。
AE的神经系统表现包括意识水平改变、意识内容混乱、睡眠障碍、运动障碍和癫痫发作。癫痫发作是AE最常见的临床表现,也可能是主要症状。癫痫发作可为局灶性或全面性,通常是多灶性的。超过1/3的AE患者有运动异常,如共济失调、舞蹈症、肌张力障碍、肌阵挛或震颤。
对于AE患儿,癫痫发作和运动障碍均可对标准治疗产生高度抵抗性。在绝大多数AE患者中可见不同程度的认知障碍,也被认为是主要症状。
因此,对于认知功能评估正常的患者,AE的诊断需要高度怀疑,这又使AE与认知多不受累的PANS区别开来。评估幼儿的记忆下降可能具有挑战性,然而,发育倒退、语言丧失或言语障碍或许是儿童AE的特征。
行为改变,如重复或刻板行为,易怒,多动,性欲亢进,失眠和愤怒爆发在儿童AE中很常见。精神症状可能从情绪波动和轻度人格变化到暴发性精神病,见于超过50%的AE患者。
13岁以下儿童的新发精神病并不常见,被认为是潜在疾病而非原发性精神病的警示信号。
对于患有急性精神症状的儿童,评估其认知功能改变、癫痫发作、运动异常或其他神经系统症状是非常重要的,因为这些症状可能提示AE。
由于正常发育中神经元环路、神经感受器密度和髓鞘形成的演变,AE患儿可能在临床表现上与成人不同。AE患儿更有可能表现为多灶性神经精神症状,而不是孤立的临床综合征。例如,GAD65抗体脑炎患儿可能不会表现出成人典型的僵人综合征或小脑变性。
抗NMDAR抗体脑炎患儿更容易出现运动异常、易激惹、失眠、癫痫发作、言语障碍、共济失调和/或偏瘫,而记忆力下降、精神症状和中枢性低通气在成人中更为常见。与成人相比,儿童AE与肿瘤的相关性较低。
儿童和青少年疑诊AE的诊断评估
尽管没有一项单独的检查可以诊断儿童AE,但存在提示性的临床表现和支持性辅助检查对于诊断潜在炎症性病变和排除其他诊断至关重要。表1列举了疑似AE患儿应考虑的初步检查,但具体方案应该个体化。
表1 疑似AE患儿检查建议
A 对于可能的AE的初步检查 | |
影像学检查 | 颅脑增强MRI(包括T1、T2、FLAIR、DWI序列) |
考虑脊髓MRI,如神经系统症状提示潜在脊髓受累 | |
血化验 | 全血细胞计数及分类 |
红细胞沉降率、C-反应蛋白、铁蛋白 | |
维生素B12和维生素D水平 | |
血清叶酸水平 | |
考虑促甲状腺激素、抗核抗体(如抗双链DNA和抗Smith),如临床表现提示 | |
考虑血清补体和免疫球蛋白,如有自身免疫异常或免疫缺陷的个人史或家族史 | |
尿液检测 | 成瘾药物检测(如大麻、可卡因和阿片类药物) |
腰椎穿刺 | 开放压力 |
脑脊液细胞数、蛋白、乳酸、寡克隆带和新蝶呤(若可能) | |
感染性检测依据区域流行病学史,但常包括肠道病毒、单纯疱疹病毒和带状疱疹病毒的PCR | |
保留5~10 ml脑脊液用于未来的检测 | |
呼吸系统检测 | 鼻咽拭子检测呼吸道病毒和支原体PCR |
脑电图 | 评估局灶性或全面性癫痫发作,痫样放电和背景活动变化 |
B.对于可能的AE的进一步检查 | |
血化验 | 血清AE相关抗体检测 |
腰椎穿刺 | 脑脊液AE相关抗体检测 |
认知功能检查 | 评估认知功能障碍,包括记忆力、注意力、问题解决能力、语言能力、认知加工等 |
考虑使用符号数字模态测试筛查认知功能障碍 | |
其他检查 | 若必要而可行:考虑PET和SPECT |
血化验有助于评估全身性炎症反应,与系统性自身免疫性疾病相关的自身抗体,维生素B12缺乏,感染指标,代谢产生的乳酸升高,以及成瘾药物的使用。AE患儿的红细胞沉降率、C反应蛋白、白细胞计数和血小板计数可能是正常的。
在诊断当时或病程中可能会有脑脊液有核细胞数增多和(或)蛋白水平升高,但并非全部存在。推荐的用于评估感染性脑炎的检测是基于加利福尼亚和英格兰的人群研究(表1)。但是,根据患者居住或旅行的季节和地区,感染性疾病的病因学筛查会有所不同。
最近一项研究表明,抗NMDAR脑炎在儿童中可能比任何特定的感染性脑炎更常见,进一步突显在评估感染性脑炎时鉴别AE的重要性。脑脊液新蝶呤是一种有用但不能快速检测的生物标志物,在抗NMDAR脑炎和其他脑炎中经常升高,但在PANS中正常。有证据表明,单纯疱疹病毒性脑炎和日本脑炎可能会诱发AE(尤其是抗NMDAR脑炎)。
所有患者都应该进行脑MRI检查(平扫或增强)。超过一半的AE患者在诊断时脑和脊髓MRI正常。炎症性病变(T2和FLAIR序列上的高信号)会随着时间进展,数月后可能会出现脑萎缩。MOG或γ-氨基丁酸-A受体(GABAAR)抗体阳性的患者脑MRI最有可能出现病灶。神经影像学改变不仅仅局限于颞叶或皮质。正常的MRI可疾病不考虑CNS血管炎、脱髓鞘疾病、感染和恶性肿瘤。如出现弥散受限则儿童AE的可能性降低,并应考虑其他病因,如感染相关性脑病和血管炎。小型回顾性成人AE研究表明,功能性PET和SPECT检查或能发现脑功能障碍,但在儿童AE中的经验有限。
疾病活动期AE患儿脑电图正常是不常见的,尽管可能需要长时程脑电图提高敏感性。因此,局灶性或全面性癫痫发作、痫样放电和脑病样变化(如弥漫性或局灶性慢波)可能有助于鉴别AE和原发性精神病或PANS。成人AE的脑电图异常主要位于颞叶,而儿童脑电图异常可能更广泛。特异性脑电图表现,例如“极度δ刷”,与抗NMDAR脑炎有关,但敏感性较低。
认知功能检查可发现记忆力、注意力、问题解决能力、语言和处理速度的障碍,尤其是在年幼的儿童中。认知功能改变支持儿童AE的诊断,并有助于鉴别原发性精神病患者。然而,诊断时对认知功能检查的解释应谨慎进行,因为通常没有病前检查用于比较。
其他辅助检查也可考虑。大多数AE患儿不需要进行脑活检。但是,当初步检查后诊断仍不能确定时,可能需要对MRI异常病灶进行针对性脑活检。儿童患者的脑活检诊断率高于成人患者。
儿童和青少年疑似AE的抗体检测与解读
儿童AE相关抗体见表2和表3。每个抗体都与特异性症状、癫痫类型和其他临床表现相关。但是,不同疾病之间存在明显的重叠,因此建议对任何疑似AE的儿童进行神经自身抗体组套检测。儿童中最常见的自身抗体为抗NMDAR、MOG、GAD65和GABAAR抗体。鉴于其他自身抗体的罕见性,只有在上述抗体均为阴性且仍怀疑AE的情况下,才考虑进一步检测。
表2 儿童AE中常见的自身抗体
抗体针对抗原 | 儿童中典型的临床表现 | |
GAD65(细胞内) | 出现频率 | AE中常见,但只有在血清中滴度高且脑脊液中阳性时才有具有致病性 |
临床表现 | 脑炎,伴记忆力下降、认知功能障碍、小脑共济失调、颞叶癫痫 | |
MRI | 初始时可正常,经常发展为边缘叶、小脑和皮层病灶,可能发生萎缩 | |
脑电图 | 痫样放电可能是多灶性的 | |
其他 | 脑脊液细胞数可轻度升高,伴寡克隆带 具有自身免疫异常的个人或家族史 常对免疫抑制治疗有抵抗 | |
MOG(细胞外) | 出现频率 | AE中常见 |
临床表现 | 急性播散性脑脊髓炎,包括脑病、视神经炎或横贯性脊髓炎(但非典型多发性硬化表现),皮质脑炎伴癫痫发作,脑干脑炎,不伴脱髓鞘的脑膜脑炎 | |
MRI | 局灶或多发白质病灶,长节段横贯性脊髓炎,视神经炎 | |
脑电图 | 非特异性慢波 | |
其他 | 血清抗体检测优于脑脊液 幼儿抗体滴度高 复发时抗体持续阳性 | |
NMDAR(细胞外) | 出现频率 | 儿童AE中最常见的抗体 |
临床表现 | 脑炎,伴运动障碍、癫痫发作、精神症状、言语减少/缄默、发育迟滞(幼儿)、睡眠障碍(主要是失眠)和自主神经功能障碍 | |
MRI | 至少65%的患者正常,T2/FLAIR病灶可能见于皮质、白质、小脑或基底节,可逆性大脑萎缩是后期表现 | |
脑电图 | 超过90%的患者异常—多数表现为全面性慢波,但可能有局灶性痫样放电,局灶性慢波,或“极度δ刷” | |
其他 | 脑脊液抗体检测优于血清 女性和12岁以上患者与肿瘤相关性增加 | |
表3 儿童AE中不常见的自身抗体
抗体针对抗原 | 儿童中典型的临床表现 | |
多巴胺-2受体(细胞外) | 出现频率 | 非常少见 |
临床表现 | 脑炎,主要表现为运动障碍、精神症状、睡眠障碍、缄默和意识水平下降 | |
MRI | 50%的患者异常,通常对称性累及基底节 | |
脑电图 | 表现不一 | |
其他 | 脑脊液检测各异,有时可见淋巴细胞增多或寡克隆带 | |
GABAA受体(细胞外) | 出现频率 | 少见 |
临床表现 | 脑炎,难治性癫痫,癫痫持续状态,部分性癫痫持续状态 | |
MRI | 皮质/皮质下区T2/FLAIR多发病灶 | |
脑电图 | 痫样放电和全面性慢波 | |
其他 | 多数患者脑脊液有核细胞数增多 常与GAD或甲状腺自身抗体相关 | |
GABAB受体(细胞外) | 出现频率 | 非常少见 |
临床表现 | 脑炎,局灶性或全面性癫痫,混合型运动障碍 | |
MRI | 超过50%患者异常,内侧颞叶T2/FLAIR序列信号升高(可能是多灶性,部分病灶可能弥散受限) | |
脑电图 | 弥漫性慢波和痫样放电 | |
其他 | 90%患者脑脊液淋巴细胞数增多 儿童患者与感染或肿瘤无关 | |
甘氨酸受体(细胞外) | 出现频率 | 少见 |
临床表现 | 进行性脑脊髓炎伴强直和肌阵挛,脑炎和其他脑干综合征 | |
MRI | 通常是正常的(70%的患者) | |
脑电图 | 约70%的患者异常,通常为慢波 | |
其他 | 脑脊液检测各异,淋巴细胞数增多,蛋白升高,寡克隆带 可能与其他自身抗体相关(如GAD) | |
代谢型谷氨酸受体5(m-GluR5)(细胞外) | 出现频率 | 非常少见 |
临床表现 | 脑炎伴精神症状 | |
MRI | MRI结果多样,T2/FLAIR序列多见 | |
脑电图 | 结果多样,通常无痫样放电 | |
其他 | 脑脊液淋巴细胞数增多 | |
需要脑脊液和血清中同时进行抗体检测,以避免假阴性和假阳性结果。例如,NMDAR抗体在脑脊液中敏感性通常比血清高,多达15%的患者血清结果阴性。相反,MOG自身抗体血清的敏感性更高。
抗体检测结果的解读应仔细结合患儿的临床表现,尤其是鉴定出一种以上抗体时。例如,GAD65抗体往往与个人或家族自身免疫性相关,而抗体滴度低(如在1型糖尿病中见到的抗体)常与神经系统无关。在一些AE患者中,已经发现一种以上的抗体存在,并且可能与重叠综合征相关。解读抗体检测结果时,抗体特异性也很重要。例如,只有针对NMDAR的GluN1亚基的IgG同型抗体(基于细胞的检测)才与AE存在特定相关性。
在成人AE患者中,大多数电压门控钾离子通道复合物(voltage-gated potassium channel complex,VGKCC)抗体不与该通道结合,而是与该复合物中的蛋白结合,主要是富亮氨酸胶质瘤失活蛋白1(leucine-rich glioma-inactivated protein 1,LGI1)和接触蛋白相关蛋白-2(contactin associated protein-like 2,Caspr2)。而在儿童中,VGKCC抗体很少靶向LGI1或Caspr2。有学者认为,没有特异性结合LGl1或Caspr2的VGKCC抗体的临床意义有限。
儿童AE分类标准和诊断流程
专家组对成人AE标准进行修改,并提出可能的儿童AE、很可能的抗体阴性的儿童AE以及确诊的抗体阳性的儿童AE的临时分类标准,见表4。并提供了诊断流程图。该项临时分类标准和诊断流程应在以后的研究进行评估验证。
表4 可能的、很可能的抗体阴性的、确诊的抗体阳性的儿童AE分类标准
项目分类 | 特定诊断项目 | 诊断分类 | ||
可能的AE | 很可能的抗体阴性的AE | 确诊的抗体阳性的AE | ||
1. 起病形式 | 既往体健的儿童在≤3个月内出现神经和/或精神症状 | 是 | 是 | 是 |
2. 临床表现 | 临床表现包括: a. 精神状态/意识水平改变或脑电图出现慢波或痫样放电(局灶或全面性) b. 局灶性神经功能缺损 c. 认知功能障碍 d. 急性发育倒退 e. 运动障碍(除外抽动) f. 精神症状 g. 无法用既往癫痫病史或其他疾病解释的癫痫发作 | ≥2条 | ≥2条 | ≥2条 |
3. 辅助检查 | 辅助检查包括: a. 脑脊液炎性改变(有核细胞>5/mm3,和/或寡克隆带阳性) b. MRI可见脑炎表现 c. 脑活检提示炎性浸润并除外其他疾病 | 无 | ≥1条 | ≥1条 |
4. AE血清学 | 血清或脑脊液存在已知的AE相关自身抗体 | 无 | 无 | 是 |
5. 排除诊断 | 排除其他疾病,如其他CNS炎症性疾病 | 是 | 是 | 是 |
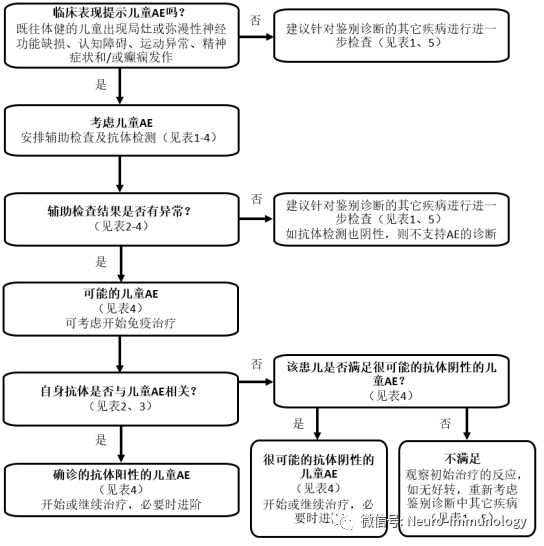
图 基于临时分类标准的疑诊儿童AE诊断流程图
对于表现为急性或亚急性(<3个月)起病的新发局灶性或弥漫性神经功能缺损、认知障碍、发育倒退、运动异常、精神症状和/或癫痫发作的既往体健的儿童,应考虑诊断儿童AE。尽管既往发育倒退或慢性行为/精神异常的儿童也可能会罹患AE,但在这些患儿中应首先考虑其他诊断,例如遗传性、代谢性或神经退行性疾病。
临床表现提示AE的患儿应检测血清和脑脊液的神经抗体,接受针对脑炎的相关辅助检查,并排除表现相似的其他疾病。脑电图不能作为脑炎的检查依据,因为脑电图不能区别AE与其他脑病。然而,脑电图上的脑病表现可以作为脑病临床表现的替代指标。
如果患者符合可能的儿童AE分类标准(表4)并且有神经功能受损,考虑到早期治疗对改善转归的重要性,可在等待抗体和其他检查结果的同时开始治疗。如果可能的AE患者随后没有发现抗体阳性或缺乏脑炎的辅助检查依据,则不支持AE的诊断。对于这些儿童,应进一步仔细考虑鉴别诊断,并且应谨慎进行其他免疫治疗(表5,图)。
表5 儿童和青少年AE的鉴别诊断
原发性CNS炎症 | AE,包括桥本脑病 |
原发性或继发性CNS血管炎 | |
脱髓鞘性疾病:急性播散性脑脊髓炎、多发性硬化、视神经脊髓炎谱系疾病 | |
Rasmussen脑炎 | |
系统性炎症 | 自身免疫性疾病:抗磷脂综合征、乳糜泻、白塞病、结节病、系统性红斑狼疮、干燥综合征 |
自身炎症性疾病:干扰素病与噬血细胞性淋巴组织细胞增多症 | |
感染 | 细菌:伯氏疏螺旋体、单核细胞增生李斯特菌、肺炎支原体、结核分枝杆菌和梅毒螺旋体 |
病毒:腺病毒、肠道病毒、EB病毒、单纯疱疹病毒、HIV、流感病毒、JC病毒、麻疹病毒、狂犬病毒、带状疱疹病毒、西尼罗病毒 | |
寄生虫:疟疾 | |
感染后或感染相关脑病 | 支原体后基底神经节脑炎 |
单纯疱疹病毒性脑炎后运动障碍 | |
链球菌感染后神经精神障碍(包括Sydenham舞蹈病) | |
嗜睡性脑炎 | |
免疫机制未明的疾病 | 高热感染相关性癫痫综合征(FIRES) |
急性坏死性脑病(ANE) | |
伴有双相发作和弥散受限的急性脑病(AESD) | |
与链球菌感染相关的儿童自身免疫性神经精神障碍(PANDAS) | |
儿童急性起病神经精神综合征(PANS) | |
代谢性 | 遗传/获得性:脑白质营养不良、线粒体病、黏多糖贮积病、有机酸尿症、肝豆状核变性 |
肝性脑病 | |
肿瘤性 | 原发性中枢神经系统肿瘤(如淋巴瘤、胶质瘤、星形细胞瘤) |
转移性肿瘤(如神经母细胞瘤、白血病) | |
营养性 | 维生素B12缺乏症 |
精神性 | 新发精神分裂症、双相情感障碍、分离转换障碍、儿童分裂性疾病、心因性癫痫发作 |
中毒性 | 成瘾药物(如酒精、大麻、合成大麻素、可卡因、阿片类药物、甲基苯丙胺) |
摄入物(如乙二醇、甲醇和吸入剂) | |
药物(如甲硝唑和环孢素) | |
其他 | 儿童虐待和忽视 |
儿童可能罹患由尚未明确的抗体引起的AE,并可能符合很可能的抗体阴性的儿童AE的分类标准(表4)。这些患者会有一项或多项脑炎相关阳性检查结果,但抗体检测为阴性。符合确定的抗体阳性儿童AE分类标准的患儿抗体检测呈阳性。如果脑脊液抗体阳性(如NMDAR和GAD65),则诊断为明确的AE而不需要其他脑炎相关检查依据(表4)。如果仅存在血清抗体,则必须有一项或多项脑炎相关检查异常。当仅发现血清抗体(特别是NMDAR,GABAAR和甘氨酸受体)而没有脑炎相关辅助检查依据时,诊断AE时应谨慎。
本文提出的儿童AE分类诊断标准在几个方面与成人标准有所不同。首先,儿童AE标准包含了症状出现的急性和亚急性的时间概念(≤3个月),反映了儿童中所观察到的病程范围。成人AE标准针对几个明确的综合征(如边缘叶脑炎、急性播散性脑脊髓炎和抗NMDAR脑炎)制定了相应标准,相关流程也着重于患者是否符合这些综合征的标准。相比之下,许多AE患儿并未出现明确的综合征,因此儿童标准主要根据相关报道的临床和辅助检查发现从广度上覆盖。同样,儿童AE诊断流程图也不着眼于综合征的识别,而是旨在指导临床医生评估临床特征,辅助检查以及抗体检测,以判断AE诊断是否合适。成人AE标准将临床和辅助检查结果归在一起,而儿童标准则区分神经功能障碍的临床证据和脑炎相关辅助检查依据。
尽管特异性治疗方案尚未证实,但确诊的AE患者可能会从持续或进阶的免疫抑制治疗中获益。与AE相关抗体的检测或有助于判断疾病病程和预后。AE患儿对免疫治疗的反应时间各异,从立即起效到数月不等。因此,以治疗反应作为诊断AE的确证支持可能会产生误导。
临床上可识别的综合征
抗NMDAR脑炎
抗NMDAR脑炎是儿童最常见的AE。目前成人抗NMDAR脑炎的诊断标准已经在儿童中进行了验证并能很好地适用。但儿童患者更常出现神经症状,而非精神症状,并且可能不会按照成人典型症状序列出现,例如,儿童患者中运动障碍和自主神经功能障碍出现较早。
MOG抗体相关AE,包括急性播散性脑脊髓炎(ADEM)
与自身免疫性脱髓鞘相关的最常见自身抗体是MOG。与无自身抗体的患者相比,MOG自身抗体阳性ADEM患者更容易出现大的球形病变和长节段脊髓炎。与多发性硬化患者相比,MOG抗体阳性的患儿更少出现寡克隆带。然而,成人和儿童MOG抗体相关疾病谱已经扩大到包括ADEM、脑膜脑炎、伴癫痫发作的皮质脑炎、脑干脑炎和血管炎模拟病。其中一些患者会发展为更典型的脱髓鞘事件,如ADEM,因此,除ADEM外,表现为AE的患儿也应考虑到MOG抗体。MOG自身抗体在单相ADEM中通常呈短暂阳性,但在复发表型中可为持续阳性。
边缘叶脑炎
儿童边缘叶脑炎的临床、脑电图和影像学特征并不常见。与成人边缘叶脑炎相关的自身抗体包括针对LGI1、GAD65、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor,AMPAR)、GABABR、Caspr2、Hu和Ma2的抗体。除GAD65外,这些特异性抗体在儿童中很少见。
桥本脑病
桥本脑病(Hashimoto encephalopathy,HE)具有非特异性神经精神症状,伴有抗甲状腺抗体,这些抗体被认为是自身免疫性而非致病性标志物。患者可能会出现癫痫发作、意识状态改变、认知功能下降、精神异常、偏执狂、局灶性神经功能缺损和运动障碍。超过70%的HE患儿的脑MRI正常,脑脊液很少出现有核细胞增多,脑电图常表现为全面性或局灶性慢波而无癫痫发作。尽管存在抗甲状腺抗体,但大多数患儿的甲状腺功能正常。由于在健康儿童中也可发现血清甲状腺自身抗体,因此诊断需要慎重。
很可能的抗体阴性的儿童AE
具有AE临床表现和脑炎相关辅助检查结果,但自身抗体检测阴性的儿童,或符合很可能的抗体阴性的儿童AE分类标准(表4)。众所周知,不是所有的神经自身抗体目前都已被发现。在相关研究实验室对脑脊液和血清进行检测,可以发现针对未知神经细胞表面抗原的抗体且可能对免疫治疗有反应的患者。
很可能的抗体阴性的AE是最具挑战性的临床诊断之一。对出现新发脑病、神经精神症状和功能改变的儿童进行针对AE的检查是合适的。然而,儿童的鉴别诊断可能比成人更广泛,因此在诊断AE之前,确保排除其他诊断是很重要的。常引起诊断困难的疾病是表现为发热诱发的症状性局灶性癫痫的皮质发育异常和遗传性癫痫,感染诱发的脑病和PANS。在这些综合征中,通常不出现脑脊液细胞数增多或寡克隆带,脑MRI正常或提示其他病变。因此,为了避免不必要的免疫抑制治疗,必须对中枢神经系统炎症的辅助检查结果进行严格审查。对于具有不典型特征的儿童,诊断很可能的抗体阴性的AE也应反复评估。
总结
本文提出的儿童AE分类标准是为了阐明儿童和成人患者在临床表现、辅助检查和自身抗体上的差异。同时所给的诊断流程图旨在指导临床诊断工作,促使尽早开始治疗。
来源:脱髓鞘及自免脑二三事
查看更多