查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





乳腺癌原发灶和腋窝转移淋巴结中雌激素受体、孕激素受体、人表皮生长因子受体2及Ki-67表达情况的比较
作者:杨素梅 厦门大学附属中山医院
乳腺癌是全球女性最常见的恶性肿瘤之一,严重危害女性的生命健康。预计在2030年,中国女性乳腺癌发病例数达33.4万例,较2008年增加31.15%,乳腺癌死亡例数达7.0万例,较2008年增加47.94%[1]。基于对乳腺癌认识的不断加深,乳腺癌的治疗不断发展,从以往的经验诊疗到随后的循证医学治疗,再逐步推进到目前倡导的精准医疗,均离不开精准的病理诊断。乳腺癌是一类在分子水平上具有高度异质性的疾病,组织学形态相同的肿瘤,其分子遗传学改变可能不尽相同,从而导致肿瘤治疗方法和预后不同[2]。雌激素受体(estrogenreceptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(humanepi-dermalgrowthfactorreceptor2,HER2)及Ki-67的表达水平均是乳腺癌患者分子分型及个体化治疗的指导依据。目前乳腺癌治疗方案的制订主要根据原发部位ER、PR、HER2表达情况。同侧腋窝淋巴结转移是乳腺癌重要的转移途径之一[3],可能比原发癌更能代表潜在复发或转移的乳腺癌细胞。此前,一些研究已经证实,乳腺癌原发灶和腋窝转移淋巴结中ER、PR和HER2表达状态是不一致的[4-5]。本研究探讨乳腺癌原发灶与腋窝转移淋巴结中ER、PR、HER2和Ki-67表达情况,旨在为乳腺癌的临床治疗和预后评估提供依据,现报道如下。
1.1一般资料
选取2020年10月至2021年10月于厦门大学附属中山医院接受手术治疗的存在腋窝淋巴结转移的非Ⅳ期乳腺癌患者。纳入标准:①女性;②病理检查确诊为乳腺癌;③手术方式为乳腺癌改良根治术;④术后病理检查确诊同侧腋窝淋巴结宏转移;⑤单发病灶。排除标准:①出现远处转移的Ⅳ期乳腺癌;②术前有化疗、放疗、内分泌治疗、靶向治疗史;③腋窝淋巴结仅存在孤立肿瘤细胞。依据纳入和排除标准,本研究共纳入50例乳腺癌患者,年龄25~78岁,平均(51.4±11.5)岁;TNM分期:Ⅱ期20例(40%),Ⅲ期30例(60%);组织学分级:Ⅱ级38例(76%),Ⅲ级12例(24%)。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2免疫组化染色法检测ER、PR、HER2和Ki-67表达情况
收集50例乳腺癌患者的乳腺癌原发灶和腋窝转移淋巴结组织,固定后石蜡包埋,切片,采用免疫组化染色法检测ER、PR、HER2、Ki-67表达情况。具体步骤如下:将切片脱蜡水化,阻断内源性过氧化物酶(198ml甲醇+2ml30%H2O2,室温放置20min),水洗,根据需要进行抗原修复(高温热修复、酶修复或不修复),pH=7.2的磷酸盐缓冲液(phosphatebufferedsolution,PBS)冲洗3次,每次 1min;滴加一抗,37℃孵育30~60min(或室温孵育1h或4℃冰箱过夜),pH=7.2的PBS冲洗3次,每次1min;滴加第二代生物素标记二抗工作液,37℃(或室温)孵育20~30min,pH=7.2的PBS冲洗3次,每次1min;二氨基联苯胺(diaminobenzidine,DAB)显色3~10min,水洗终止显色,苏木精淡染细胞核1~2min;水洗,蓝化,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。
1.3免疫组化染色结果判断
ER、PR主要定位于细胞核,HER2主要定位于细胞膜。ER、PR判断标准:评估整张切片中阳性染色的肿瘤细胞占所有肿瘤细胞的比例,≥1%的肿瘤细胞呈现不同程度的着色为阳性,﹤1%的肿瘤细胞呈现不同程度的着色或完全无着色为阴性[6]。HER2判断标准:无着色或≤10%的浸润肿瘤细胞呈现不完整、微弱的细胞膜染色为0;﹥10%的浸润肿瘤细胞呈现不完整、微弱的细胞膜染色为1+;﹥ 10%的浸润肿瘤细胞呈现弱-中等强度的完整细胞膜染色,或≤10%的浸润肿瘤细胞呈现强而完整的细胞膜染色为2+;﹥10%的浸润肿瘤细胞呈现强、完整且均匀的细胞膜染色为3+。其中0和1+为HER2阴性,3+为HER2阳性,若为2+,需要进一步行荧光原位杂交(fluorescenceinsituhybridization,FISH)检测,FISH阳性即判定为阳性[7]。Ki-67判断标准:依据《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[8]中的相关标准,将20%作为判定Ki-67表达高低的界值,≥20%为高表达,﹤20%为低表达。1.4统计学方法
采用SPSS28.0软件对数据进行统计分析。计量资料以均数±标准差(x-±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法;以P﹤0.05为差异有统计学意义。
2.1乳腺癌原发灶和腋窝转移淋巴结中ER表达情况的比较
乳腺癌原发灶中ER阳性率为66%(33/50),与腋窝转移淋巴结的66%(33/50)比较,差异无统计学意义(P﹥0.05)。其中,2例乳腺癌原发灶ER阳性患者的腋窝转移淋巴结ER为阴性,2例乳腺癌原发灶ER阴性患者的腋窝转移淋巴结ER为阳性。在乳腺癌原发灶和腋窝转移淋巴结中,ER表达不一致率为8%(4/50)。(图1)
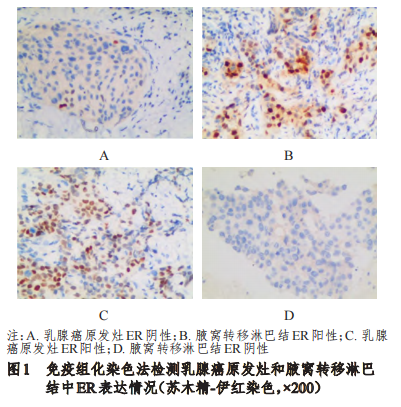
2.2乳腺癌原发灶和腋窝转移淋巴结中PR表达情况的比较
乳腺癌原发灶中PR阳性率为58%(29/50),与腋窝转移淋巴结的58%(29/50)比较,差异无统计学意义(P﹥0.05)。其中,3例乳腺癌原发灶PR阳性患者的腋窝转移淋巴结PR为阴性,3例乳腺癌原发灶PR阴性患者的腋窝转移淋巴结PR为阳性。在乳腺癌原发灶和腋窝转移淋巴结中,PR表达不一致率为12%(6/50)。(图2)
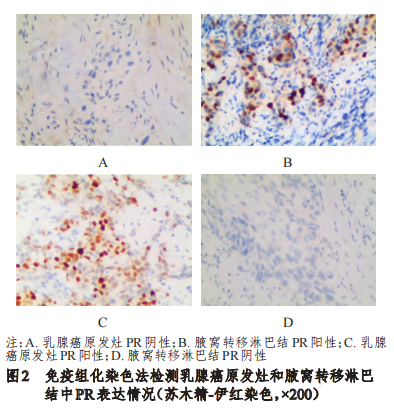
2.3乳腺癌原发灶和腋窝转移淋巴结中HER2表达情况的比较
乳腺癌原发灶中HER2阳性率为30%(15/50),与腋窝转移淋巴结的28%(14/50)比较,差异无统计学意义(P﹥0.05)。其中,2例乳腺癌原发灶HER2阳性患者的腋窝转移淋巴结HER2为阴性,1例乳腺癌原发灶HER2阴性患者的腋窝转移淋巴结HER2为阳性。在乳腺癌原发灶和腋窝转移淋巴结中,HER2表达不一致率为6%(3/50)。(图3)
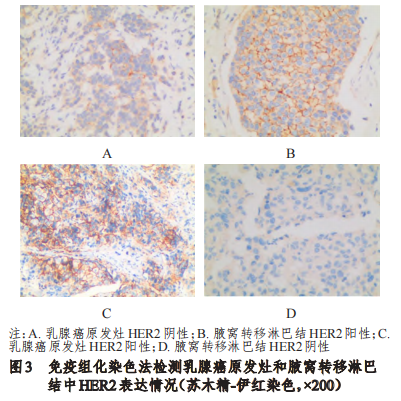
2.4乳腺癌原发灶和腋窝转移淋巴结中Ki-67表达情况的比较
乳腺癌原发灶中Ki-67高表达率为70%(35/50),高于腋窝转移淋巴结的60%(30/50),差异有统计学意义(x²=6.350,P=0.014)。其中,10例乳腺癌原发灶Ki-67高表达患者的腋窝转移淋巴结Ki-67为低表达,5例乳腺癌原发灶Ki-67低表达患者的腋窝转移淋巴结Ki-67为高表达。在乳腺癌原发灶和腋窝转移淋巴结中,Ki-67表达不一致率为30%(15/50)。(图4)
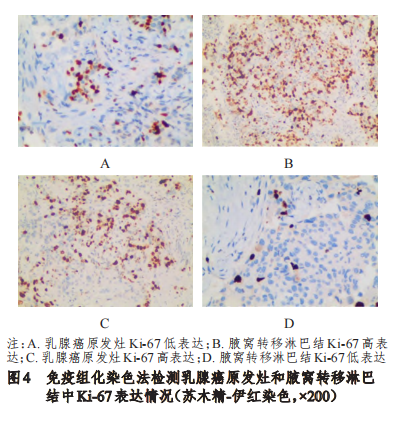
腋窝淋巴结转移是乳腺癌重要的转移途径之一,作为局部转移,腋窝淋巴结同步转移可能比原发肿瘤更能代表乳腺癌潜在转移细胞的性质。本研究结果显示,乳腺癌原发灶和腋窝转移淋巴结中ER、PR、HER2阳性率比较,差异均无统计学意义(P>0.05)。乳腺癌原发灶中Ki-67高表达率为70%,高于腋窝转移淋巴结的60%,差异有统计学意义(P<0.05);在乳腺癌原发灶和腋窝转移淋巴结中,ER、PR、HER2和Ki-67表达不一致率分别为8%(4/50)、12%(6/50)、6%(3/50)和30%(15/50)。说明乳腺癌原发灶与腋窝转移淋巴结中ER、PR和HER2表达均具有高度一致性。
Aitken等④采用免疫组化染色法对385例乳腺癌中211例伴淋巴结转移的患者同时行原发灶和转移淋巴结ER、PR及HER2检测,结果表明,ER、PR及HER2在乳腺癌原发灶与转移淋巴结中表达不一致率分别为28.4%(55/194)、23.4%(45/192)和8.9%(17/190),其中最常见的是原发灶中ER、PR和HER2阳性,而在同侧腋窝转移淋巴结中为阴性。由于这些差异,研究人员建议同时检测原发灶和转移淋巴结中ER、PR和HER2表达情况,从而指导临床治疗。
然而,其他部分研究表明,ER、PR、HER2和Ki-67表达在原发灶和转移灶之间是一致的。Su-jarittanakarn等[9]研究分析99例乳腺癌患者的临床资料,结果发现,乳腺癌原发灶与同侧腋窝转移淋巴结的ER、PR、HER2状态不一致率分别为11.1%、20.2%、10.1%。Khande等[10]对比分析60例乳腺癌原发灶及同侧腋窝转移淋巴结中ER、PR、HER2及Ki-67表达情况,其不一致率分别为3.3%、6.7%、5.0%及3.4%,提示ER、PR、HER2及Ki-67在乳腺癌原发灶和同侧腋窝转移淋巴结之间具有显著的一致性。
目前关于ER、PR、HER2、Ki-67在乳腺癌原发灶与腋窝转移淋巴结中表达不一致的原因尚未明确,主要与以下4个方面有关:①肿瘤的异质性;②肿瘤进展过程中,转移灶因遗传修饰和遗传漂移而产生与原发灶不同的变化;③病理医师对标志物表达的判断存在主观差异;④原发灶与转移灶受体非同步检测,受体试剂的选择及检测医师不同。

参考文献
[1]国家癌症中心,卫健委疾病预防控制局.中国癌症发病与死亡2003-2007[M].北京:军事医学科学出版社,2012.
[2] Agarwal G, Pradeep PV, Aggarwal V, et al. Spectrum of breast cancer in Asian women[J]. World J Surg, 2007, 31(5): 1031-1040.
[3] Harris JR, Lippman ME, VeronesiU, et al. Breast cancer (2) [J]. N Engl J Med, 1992, 327(6): 390-398.
[4] Aitken SJ, Thomas JS, Langdon SP, et al. Quantitative anal- ysis of changes in ER, PR and HER2 expression in primary breast cancer and paired nodal metastases[J]. Ann Oncol, 2010, 21(6): 1254-1261.
[5] Ataseven B, GologanD, Gunesch A, et al. HER2/neu, topoi- somerase 2a, estrogen and progesterone receptors: discor- dance between primary breast cancer and metastatic axil- lary lymph node in expression and amplifification character- istics[J]. Breast Care (Basel), 2012, 7(6): 465-470.
[6] 杨文涛,步宏.乳腺癌雌、孕激素受体免疫组织化学检测指南[J].中华病理学杂志,2015,44(4): 237-239.
[7]《乳腺癌HER2检测指南(2019 版)》编写组.乳腺癌HER2检测指南(2019 版)[J].中华病理学杂志,2019,48(3):169-175.
[8]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2019 年版)[J].中国癌症杂志,2019,29(8):609-680.
[9] Sujarittanakarn S, Himakhun W, Worasawate W, et al. The case to case comparison of hormone receptors and HER2 status between primary breast cancer and synchronous axil- lary lymph node metastasis[J]. Asian Pac J Cancer Prev, 2020, 21(6): 1559-1565.
[10] Khande TA, Joshi AR, Khandeparkar SGS, et al. Study of ER, PR, ER2/neu, p53, and Ki67 expression in primary breast carcinomas and synchronous metastatic axillary lymph nodes[J]. Indian J Cancer, 2020, 57(2): 190-197.
查看更多