查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肺癌,特别是晚期肺癌,治疗的目标是延长生命和提高生活质量,因此,对于疗效的评估也理所当然地围绕这两个目标进行。
1

OS的优点:
直接反映了生存获益,且判断精确可靠,不容易出现偏差。
OS的缺点:
需要较大样本和随访时间较长;
容易受到交叉和后续治疗的影响;
很多抗肿瘤药物已经不以OS为评价指标了,而是选择“替代终点”。
2
3
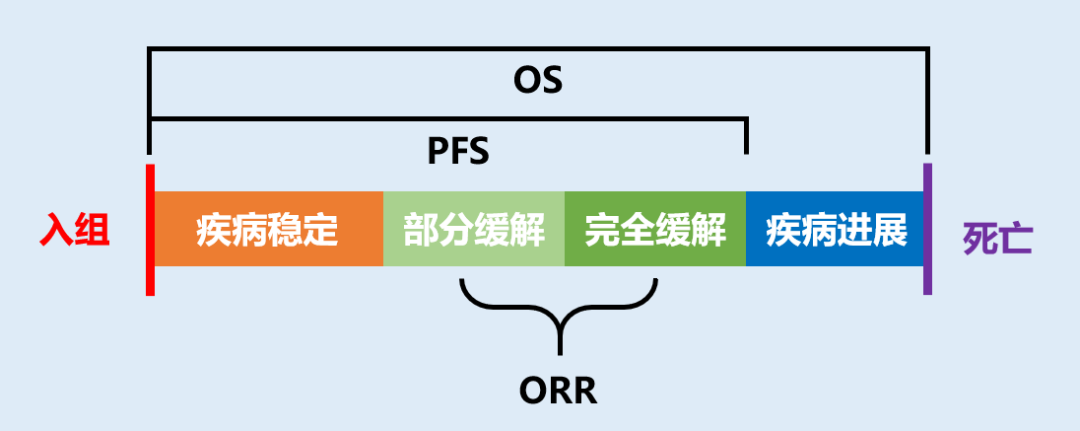
除PFS外,客观缓解率(objective response rate,ORR)是另一个常用的替代终点。ORR被定义为肿瘤体积缩小达到预先规定值并能维持最低时限要求的患者比例,也常被称为“有效率”。
ORR为完全缓解(complete response,CR)与部分缓解(partial response,PR)的比例之和,因为直接以肿瘤对药物的反应为测量标准,可以比较可靠地反映药物的抗肿瘤活性。但单纯的ORR不足以说明问题,还需要足够的缓解持续时间(duration of response,DOR)一起来看。缓解持续时间越长,ORR的提高越可能带来临床获益。
由于PFS是OS的替代品,所以PFS常常用于随机对照试验中,和安慰剂或对照组进行对比,也就是我们常说的Ⅲ期临床试验。而ORR与PFS不同,只管药物对肿瘤的影响,而不管药物是否能够延长OS或者改善症状,更加纯粹,因此常用于单臂临床试验,也就是我们常说的II期临床试验,没有对照组。
因为ORR不是临床获益的直接测量,也就决定之后还需要补充OS或PFS的临床数据。如今常常能听到某个抗癌新药因为II期临床试验的ORR结果获批上市,但这个获批是有条件,之后还要补上Ⅲ期临床试验的OS或PFS结果才算是获得完全批准。
4
疾病控制率(disease control rate,DCR)是在ORR的基础上加上疾病稳定(stable disease,SD)的患者比例。但也因此容易受到肿瘤自然病程的影响,不能可靠地反映药物的抗肿瘤活性。

参考文献:
2019年9月10日《国家药监局关于发布晚期非小细胞肺癌临床试验终点技术指导原则》
肺癌康复圈平台发布
查看更多