查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





ADC药物利用单克隆抗体将细胞毒载药特异性递送至肿瘤细胞,具有精准靶向,特异性杀伤肿瘤的特点,从而限制细胞毒药物暴露于正常细胞或组织。ADC药物的主要临床毒性包括胃肠道、血液学、肝脏、神经系统和眼部毒性,通常具有剂量限制性[1]。根据是否与作用靶点特异性结合,ADC药物治疗相关毒性可分为在靶毒性(靶点依赖性)和脱靶毒性(非靶点依赖性)[2]。更好地理解ADC药物诱导的靶点依赖性和/或非靶点依赖性细胞毒性的发生机制对于ADC药物的未来开发策略十分重要。T-DM1是在实体瘤领域问世的第一个ADC药物,至今已有近10年的临床应用,对其不良反应机制的探索相对较成熟,本文以之为例,主要探讨T-DM1诱导血小板下降和肝毒性的发生机制,并由此展开对ADC药物脱靶毒性的思考。
T-DM1的毒性和ADC药物脱靶作用机制概况
T-DM1由美登素类细胞毒素DM1通过不可裂解硫醚连接子与人源化单克隆抗体曲妥珠单抗偶联而成。与HER2结合后,T-DM1被内化进入肿瘤细胞内部,并在溶酶体中发生降解,形成Lys-MCC-DM1复合物作为效应分子,靶向微管蛋白从而诱导细胞死亡。在过去的近10年中,T-DM1曾作为HER2阳性晚期乳腺癌的二线标准治疗药物,也是新辅助治疗后残留浸润性疾病的HER2阳性早期乳腺癌患者的强化辅助治疗选择。血小板减少、肝转氨酶升高和周围神经病变是T-DM1的常见不良反应[3]。并且T-DM1在临床试验中观察到的主要剂量限制性毒性是血小板减少和肝转氨酶升高[2]。
脱靶作用是目前临床开发中ADC药物剂量限制性毒性的主要原因[2]。可能的发生机制包括①连接子-载药不稳定导致循环中载药过早释放;②旁观者效应;③正常细胞通过受体依赖性和非受体依赖性(非特异性内吞)机制摄取/转运完整的ADC药物[4]。虽然正常细胞对ADC药物的非靶点依赖性摄取可能是产生脱靶毒性的主要原因之一,但这却是ADC药物相关毒性中研究相对较少的机制[2]。

图1. 正常细胞摄取ADC药物或游离载药的潜在机制。①靶抗原可能在正常细胞上表达,有助于ADC药物的靶点依赖性摄取。②与IgG抗体Fc区结合的受体,如Fcγ受体(FcγR)、新生儿Fc受体(FcRn)和C型凝集素受体(CLR)也可能有助于正常细胞中ADC药物的非靶点依赖性内吞/转运。③非特异性内吞机制,如巨胞饮或小胞饮也可能导致完整ADC药物或游离载药(由于连接子-药物不稳定或胞外蛋白酶活性使得载药在细胞外释放)进入细胞。④游离载药也可能通过其他机制进入正常细胞,如被动扩散(如果具有膜通透性)、非特异性内吞或特异性转运蛋白(如果是膜转运蛋白的底物)介导的摄取。⑤抗原阳性靶细胞还能够通过将载药释放到局部环境中介导毒性,随后被抗原阴性正常细胞通过被动扩散、转运蛋白介导的摄取或通过其他非特异性内吞机制摄取,类似于旁观者效应[4]。
已知抗体可通过多种机制以非靶点依赖性方式被正常细胞摄取,包括Fc受体介导的内吞途径(例如,甘露糖受体、FcRn和FcγR受体)、非特异性内吞作用和/或ADC药物分解代谢产物的摄取。理论上,非靶点依赖性摄取可导致ADC药物通过胞内体或溶酶体途径在细胞内转运,随后在正常细胞中释放细胞毒载药。但是评估非靶点依赖性摄取对ADC药物总体脱靶毒性特征影响的数据非常少。而支持该假设的最广泛的证据来自对T-DM1介导的血小板减少机制的研究探索[2]。
不仅如此,鉴于无论靶蛋白表达如何,大多数与微管蛋白抑制剂结合的ADC药物的最大耐受剂量(MTD)范围为2~5mg/kg。为了改善下一代ADC药物的治疗指数,有必要对脱靶毒性的潜在机制进行更加深入地了解[2]。
T-DM1诱导血小板减少的发生机制
血液学毒性是以奥瑞他汀类(如MMAE、MMAF)、刺孢霉素类、美登素类(如DM1)作为“弹头”分子的ADC药物的最常见非靶点依赖性剂量限制性毒性[4]。Uppal等[4,5]研究者通过研究T-DM1介导的血小板减少症的发生机制,支持了FcγR在ADC药物治疗相关血液学毒性中的关键作用。既往已有研究者证实在循环血小板或骨髓中分化的巨核细胞(MKs)表面未见HER2表达,因此预期这些细胞中不存在靶点依赖性摄取。Uppal等利用体外实验和一种新型的人骨髓造血干/祖细胞分化模型,不仅排除了ADC对成熟血小板的直接作用,同时也揭示了巨核细胞(骨髓中)表面FcγRIIa介导的T-DM1内化和由此产生的细胞毒性(细胞骨架破坏)是血小板生成减少的机制。使用FcγRII阻断抗体(抗CD32抗体)或使用不能结合FcγR的Fcγ突变体T-DM1(携带D265A和N297A突变的T-DM1-DANA)可显著减少巨核细胞中的T-DM1内化。此外,仅观察到T-DM1和含有DM1的对照ADC药物对巨核细胞产生影响,而曲妥珠单抗尽管也能被巨核细胞内化,但是并无不良影响,这表明T-DM1对巨核细胞造成损伤导致的血小板减少是由载药DM1介导的,但是需要T-DM1抗体上的Fc结构域与FcγRIIa相互作用才能发生内化。总体而言,研究者得出结论,FcγRIIa(至少部分)有助于T-DM1结合和内化的机制介导了巨核细胞分化受损,并最终导致血小板减少的发生。但是,由于研究数据不支持内化T-DM1与溶酶体标记物LAMP1在巨核细胞中的共定位,因此本研究仍不清楚ADC/FcγRIIa复合物如何内化以及T-DM1的效应分子Lys-MCC-DM1如何释放到巨核细胞的微管中[3]。
与该研究报告的结果不同,Thon等[6]研究者认为T-DM1诱导的血小板减少症是通过独立于HER2或Fc受体的机制发生的,这是基于Thon等将小鼠胎肝细胞培养物和成熟巨核细胞与T-DM1、5B6-DM1(非特异性人源化抗体偶联物)、曲妥珠单抗(单独抗体)或溶媒对照共同孵育。基于巨核细胞/血小板不表达HER2受体,且小鼠不含人IgG的FcRIIA的事实。尽管曲妥珠单抗是一种直接针对HER2胞外域的人源化单克隆抗体,但观察到5B6-DM1在小鼠造血干细胞和巨核细胞培养物中的作用与T-DM1相似,表明T-DM1的摄取并不依赖于HER2和FcRIIA。此外,该研究还表明T-DM1可破坏巨核细胞和血小板中的微管组织。同时Thon也支持了Uppal的观点,即曲妥珠单抗单药对巨核细胞分化或血小板的生成没有影响,血小板减少症源自载药DM1引起的微管抑制。
不仅如此,虽然Uppal等证实了阻断T-DM1与FcγRIIa受体的相互作用可显著降低T-DM1内化,但并不能完全阻断巨核细胞对T-DM1的摄取或细胞毒性,提示其他机制(如非特异性内吞)也可能导致血小板减少。Zhao等[7]研究者发表的报道很好地支持了这一观点,该报告研究了AGS-16C3F[靶向ENPP3(外切核苷酸焦磷酸酶/磷酸二酯酶家族成员-3)的单抗,通过不可裂解连接子与MMAF偶联而成的ADC药物)]和T-DM1,使用与Uppal研究中相似的体外巨核细胞分化平台诱导血小板减少症。AGS-16C3F与T-DM1相似,对成熟血小板无直接作用,在循环血小板或其前体巨核细胞上也未检测到ENPP3(靶抗原)表达。但与Uppal相反,Zhao等研究者认为ADC药物在巨核细胞中的非靶点依赖性巨胞饮及其分化抑制作用在ADC药物诱导的血小板减少症中发挥着作用[4,7]。
ADC药物除了通过FcγR介导和/或巨胞饮介导的摄取过程进入巨核细胞外,其他机制如外周破坏或循环血小板的清除/隔离增加也可能导致ADC药物诱导的血小板减少。人体血小板的代谢周期在正常情况下为9~11天,然后通过不同机制清除,包括去唾液酸化,暴露潜在的半乳糖基团(被Ashwell-Morrell受体识别)以清除肝细胞和免疫介导(抗体或T细胞依赖性)机制。了解ADC药物治疗后血小板动力学的变化可能有助于区分由于生成减少还是外周破坏或清除导致的血小板减少。若血小板计数快速(急性)下降(<5~7天),表明外周血中血小板破坏加速或隔离在远端损伤部位,而不是骨髓生成减少。例如,刺孢霉素类偶联ADC药物在食蟹猴中诱导产生的血小板减症,被证明与FcγR介导或巨胞饮介导的巨核细胞摄取无关。而这种主要在肝窦内皮细胞(LSEC)中的肝毒性与肝窦间隙中的血小板隔离相关,从而导致血小板减少的发生[4]。
T-DM1诱导肝毒性的发生机制
HER2依赖性途径
肝毒性是T-DM1治疗的黑框警告之一,可能导致肝酶、血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)严重升高[3]。为了探索T-DM1诱导肝毒性的分子机制,Endo等[8]研究者建立了体外和体内模型,如永生化人肝细胞,与T-DM1治疗敏感的HER2阳性乳腺癌细胞系相比,如SKBR-3和BT-474,其HER2表达水平较低。结果表明,T-DM1可能通过HER2依赖性摄取途径引起肝毒性。并且研究者还发现,由T-DM1介导的肝细胞损伤可被促炎细胞因子TNF-α进一步加强,这是因为T-DM1引起的线粒体外膜破裂,引发了线粒体依赖性凋亡[3]。
ADC药物诱导的靶点依赖性肝毒性在吉妥珠单抗(GO,抗CD33单抗与刺孢霉素衍生物偶联而成的ADC药物)中也十分典型,FDA于2000年批准GO用于治疗急性髓系白血病(AML),并于2010年将其撤市,原因是批准后的研究未显示患者的生存期较单独化疗有所改善,且存在安全性问题,包括显著的肝毒性。Maniecki等证明CD33受体广泛分布于肝组织和肝细胞上。由此认为GO特异性靶向表达CD33的肝细胞与肝毒性有关[3]。
CKAP5依赖性途径
除了T-DM1诱导的HER2依赖性肝毒性外,Endo等[9]还注意到DM1与非靶向IgG偶联也可在体外引起剂量依赖性细胞生长抑制。Endo等假设HER2非依赖性摄取机制也可能参与T-DM1诱导的肝毒性。为了寻找能参与T-DM1诱导肝毒性的新靶点分子,使用T-DM1作为诱靶,并在细胞培养皿中与人和小鼠肝细胞共同孵育,以便针对能与T-DM1结合的细胞表面分子进行免疫沉淀分析。该研究筛选出一个分子量为230 kDa的蛋白可与T-DM1特异性结合,但不与曲妥珠单抗或对照IgG结合[9]。该蛋白经质谱鉴定为细胞骨架相关蛋白5(CKAP5,也称为ch-TOG或XMAP215),是XMAP215/Dis 1家族的成员,通过与微管蛋白结合,在微管聚合调控中发挥关键作用。关于CKAP5的组织分布,基于人类蛋白质图谱(https-www.proteina tlas.org/),CKAP5在多种人体组织中广泛表达[3]。
Endo等进一步证实CKAP5与T-DM1的结合是通过T-DM1的DM1部分介导的,并证明DM1和CKAP5之间的相互作用发生在细胞表面,与T-DM1的抗体部分曲妥珠单抗无关[9]。数据显示,与细胞表面的CKAP5结合后,T-DM1开始损伤细胞膜,随后钙流入肝细胞,导致微管聚合破坏和细胞凋亡[9]。在该研究中,MMAE偶联的维布妥昔单抗未能与CKAP5结合,也未引起细胞膜损伤和肝细胞凋亡[9]。
Endo等确定了在HER2表达水平较低的正常细胞/组织中,ADC药物(T-DM1)介导的非靶点(HER2)依赖性细胞毒性的新机制。此外,Endo等还发现,这种新机制也可能与其他DM1和DM4偶联ADC药物诱导的肝毒性相关,这是因为研究中观察到非特异性ADC药物分子(α-CD22-DM1和α-gD-DM4)与CKAP5结合并诱导了肝细胞中微管的紊乱[9]。这些数据进一步表明,CKAP5可被认为是美登素类(DM1或DM4)偶联ADC药物介导的脱靶毒性的细胞靶点,值得进一步的临床前和临床研究。图1总结了T-DM1通过HER2和CKAP5依赖性途径诱导肝毒性的机制。
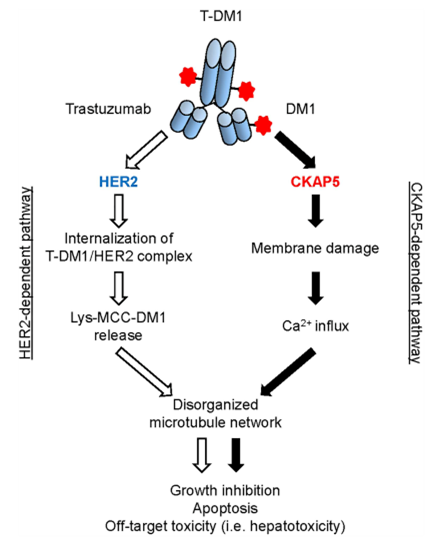
图2.T-DM1通过HER2和CKAP5依赖性途径诱导肝毒性的机制。①HER2依赖性途径:T-DM1与肿瘤细胞表面表达的HER2相互作用后,T-DM1/HER2复合物内化,随后在溶酶体内降解并释放Lys-MCC-DM1至靶细胞微管,导致细胞凋亡。HER2依赖性通路是T-DM1在HER2阳性肿瘤细胞中诱导肝毒性的主要机制。②CKAP5依赖性途径:T-DM1(DM1)在肝细胞表面与CKAP5特异性结合后,T-DM1开始损伤细胞膜,随后钙流入肝细胞内部。肝细胞胞浆中钙浓度升高引起微管网络紊乱,从而导致细胞生长抑制、凋亡和肝毒性[3]。
总结与启示
美登素类偶联ADC药物在目前临床在研ADC药物中占据着重要比例。这类ADC药物在临床研究中观察到的副作用似乎与载药DM1和DM4相关。例如,胃肠道反应、血小板减少和中性粒细胞减少均与DM1偶联ADC药物相关,而眼毒性是DM4偶联ADC药物最常见的不良反应之一,并且在DM1和DM4偶联ADC药物中均观察到肝毒性。
一项对2000年至2014年1月期间发表的660篇ADC药物相关文献的荟萃分析显示,DM1和DM4偶联ADC药物之间的几种关键毒性存在显著差异。并且Endo等还观察到DM1和DM4偶联ADC药物对CKAP5的结合活性存在差异,这可能与各自ADC药物中检测到的不同毒性特征相关。
目前,对ADC药物治疗相关脱靶毒性机制的理解仍不明确,但Endo等的研究促进了对T-DM1诱导脱靶毒性机制的理解。并且相关研究启示今后对于ADC药物的设计,尤其是美登素类偶联ADC药物,在细胞内吞作用之前掩藏ADC药物中的载药部分可能是一种有用的策略,以减少非靶点依赖但与载药相关的不良反应。此外,在探索ADC药物诱导脱靶毒性的相关机制方面,未来有必要进行更多的研究工作,为更好地管理ADC药物治疗相关毒性奠定良好的基础。
参考文献
* 本文由阿斯利康提供支持,仅供医疗专业人士参考
审批编号:CN-104492
有效期至:2023-10-26
查看更多