查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胆管癌(CCA)高度侵袭、高度异质、预后差,现有治疗手段有限,疗效有限。尽管CCA总体发病率不高,但近年来呈逐年上升趋势,且死亡率高,中国更是高死亡率国家之一。2020年9月,欧洲CCA研究网络(ENS-CCA)于Nature Reviews Gastroenterology & Hepatology杂志正式发表了题为“Cholangiocarcinoma 2020: the next horizon in mechanisms and management”的专家共识综述,从基础研究到临床诊治全面解读了CCA近十年来的进展,并提出了下一个十年的努力方向。本文简述文章总体核心内容,并选取其中的免疫治疗部分加以拓展和分析,以飨读者。
(原文链接 :https: // pubmed. ncbi. nlm. nih. gov/ 32606456 /)
周军 教授
北京大学肿瘤医院消化内科
医学博士、副主任医师 、副教授
中国抗癌协会胰腺癌专业委员会CSPAC委员
CSCO胃肠间质瘤专家委员会秘书
中国老年肿瘤协会胃肠肿瘤分委会秘书
中国胃肠肿瘤临床研究协作组秘书
卫健委《结直肠癌诊疗规范》组稿秘书组成员
CCA是一种高度异质性的恶性肿瘤,其发病率在全球范围内正逐年上升,约占原发性肝癌的15%、消化系统恶性肿瘤的3%。根据解剖位置的不同,CCA分为肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)和远端胆管癌(dCCA)。由于CCA起病隐匿、侵袭性强、对化疗反应不佳,导致死亡率令人堪忧,在全球每年癌症相关死亡中占比2%,5年生存率不足5%。如图1所示,我们看到,中国CCA死亡率位居最高等级之列(>6/100 000),形势不容乐观。
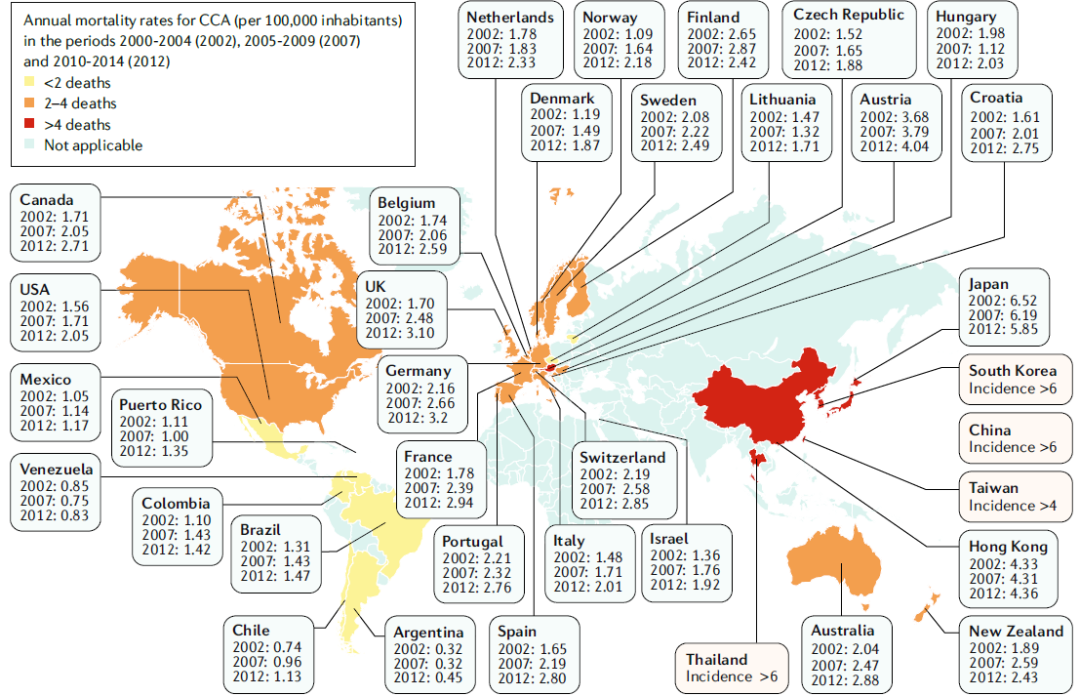
图1 全球CCA死亡率
过去十年,各个相关学科领域的研究者们都在认识CCA复杂性、发展新的诊断和治疗方法方面做了大量努力,以期改善患者疗效和生活质量。ENS-CCA的国际多学科专家组成员以“cholangiocarcinoma”为核心关键词,检索了PubMed近10年来的相关文献并进行综述,旨在概述CCA相关最新研究进展,涵盖了从基础机制到临床诊治等各方面的内容,包括流行病学和危险因素、分类和细胞起源、临床诊断和分期、基因组学和表观遗传学、信号和分子网络、上皮间质转化(EMT)和肿瘤干细胞特性、肿瘤微环境、肿瘤相关成纤维细胞、免疫生物学、在体和离体实验模型、诊断和预后生物标志物、手术切除、肝移植、介入治疗、化疗、靶向治疗、免疫治疗、化疗耐药机制等。相应领域的专家对这些研究进行了点评,并提出了下一个十年的重点研究方向,成文后共同修订,最终达成一致共识并公开发表。因此,该文是集CCA全领域最前沿数据、汇国际权威专家智慧与观点于一体的深度好文,回顾了上一个十年,也展望了下一个十年,全面呈现了CCA基础与临床的过去、现在和未来。
通读全文,总体上我们可以看到,造成CCA高度异质性的因素非常多,包括不同的危险因素、肿瘤细胞间的相互作用、肿瘤干细胞和肿瘤微环境、克隆进化、基因突变及表观遗传学异常等等,从而严重制约了现有治疗手段的效果。不同分子分型的CCA,其预后和治疗敏感性各异。表1对CCA的各种治疗方式进行了推荐。外科手术仍然是CCA唯一的潜在治愈性手段,但由于确诊时多数已为中晚期,具有根治性手术机会的患者比例非常低且术后复发率和远处转移率仍然很高。针对肝内CCA,根治术后为期6个月的卡培他滨辅助化疗是被推荐的。对于存在肝硬化或肝内CCA长径≤2 cm者,作为潜在治愈性手段,肝移植极大可能显著延长患者总生存期(OS)。对不可切除CCA,铂类联合吉西他滨仍是目前的标准一线化疗方案,FOLFOX方案作为二线治疗推荐。强烈推荐治疗前对患者进行基因检测,从而提供个体化的治疗依据。靶向治疗领域,以异柠檬酸脱氢酶1/2(IDH 1/2)、成纤维细胞生长因子受体(FGFR)为靶点的一线/二线治疗III期临床研究尚在开展中。现有系统治疗策略总体匮乏,更多有效方案亟待探索。
表1 CCA治疗方法推荐

目前能够准确诊断CCA和评估患者预后的无创手段(如生物标志物)仍然缺乏,仍须经组织病理学确诊。此外,我们对CCA耐药机制的认识还有待深入;同时,已知的耐药机制在今后的临床治疗决策制订中应被充分利用起来。尽管目前关于CCA的一些重要信息已被揭示,但仍有很多核心的空白领域亟待后续研究去填补。因此,在未来,我们仍需携手努力共同去破译并攻克CCA的复杂性。
迄今为止,CCA免疫治疗的临床数据是比较有限的。疫苗这类免疫疗法既往未能取得显著性突破。嵌合抗原受体T细胞(CART)免疫疗法早期的数据具有一定参考性,但其在不同分型CCA中的作用尚待进一步明确。单抗类的免疫检查点抑制剂在多种实体瘤患者中显示出了卓越而持久的疗效,尤其是在错配修复(MMR)缺陷性肿瘤(包括CCA)中,其客观反应率(ORR)达到了40%以上。程序性死亡受体-1(PD-1)抑制剂帕博利珠单抗的KEYNOTE-028篮式试验(NCT02054806)就纳入了晚期CCA患者,结果显示ORR为17%(4/23),中位无进展生存期(PFS)为1.8个月。KEYNOTE-158试验(NCT02628067)的初步分析中,ORR为6%,中位PFS为2个月。Lin J 等2018年发表于《临床肿瘤学杂志》(J Clin Oncol)的一项PD-1单抗(帕博利珠单抗或纳武利尤单抗)联合仑伐替尼治疗既往至少接受过两种方案的IV期胆道癌研究中国患者数据中,ORR、疾病控制率(DCR)分别为 21.4%、92.9%,中位 PFS 为 5.9 个月(95% CI 4.2~6.2),且安全性良好。该方案当时很快就获得了美国食品药品监督管理局(FDA)“突破性疗法”的资格认证,且该研究中国亚组在后续样本量扩大后,总体ORR进一步提高。
专家组在文中特别指出,合适的免疫治疗将非常有望提升CCA患者的疗效和生活质量;未来,CCA免疫治疗研究的前进方向应为针对固有免疫与获得性免疫系统的联合免疫疗法,以及免疫治疗与化疗、放疗相结合(例如ABC-09试验)。基于帕博利珠单抗单药治疗晚期不可切除CCA显示出的有效性和安全性,其联合其他系统治疗(免疫治疗/化疗/靶向治疗)的临床研究也正在开展中,例如联合细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抑制剂的双免疫疗法I期研究(NCT03849469)、联合卡培他滨+奥沙利铂的II期研究(NCT03111732)、联合吉西他滨+顺铂的大型III期研究(NCT04003636)、联合靶向药物仑伐替尼的IIb期研究(NCT03895970)、联合FGFR靶向药物培米替尼的I/II期研究(NCT02393248)、联合CD8+ T细胞免疫疗法的I期研究(NCT02757395)、联合同种异体NK细胞免疫疗法的I/IIa期研究(NCT03937895)均已在入组受试者中。
此外,值得一提的是,在免疫治疗联合局部治疗的研究中,鉴于放疗与免疫治疗的协同增效机制以及前期在非小细胞肺癌领域证实了有效性和安全性的PACIFIC 研究,也为该模式在CCA的应用带来无限期待,且有望将既往不适宜免疫治疗的“冷肿瘤”患者转化为“热肿瘤”,进一步拓宽免疫治疗获益人群。
利用生物标志物,针对不同人群、不同亚型的 CCA患者选择特异性治疗方案、使免疫治疗更加精准和更具指向性也是未来的关键所在。PD-1配体(PD-L1)表达水平已是公认的免疫治疗疗效预测生物标志物之一。在KEYNOTE-028和 KEYNOTE-158试验中,尽管使用帕博利珠单抗治疗的CCA人群非常相似,但仍存在细微差别,即PD-L1阳性率,分别为100%和58.7%,这也是导致两项试验不同疗效结果的原因之一。除PD-L1 表达以外,肿瘤突变负荷(TMB)、错配修复缺陷(dMMR)或微卫星不稳定(MSI)等在评估 CCA患者免疫治疗疗效方面也具有重要地位。KEYNOTE-158试验也强调了MSI-H或dMMR的CCA患者对帕博利珠单抗具有更好的治疗反应。
综上所述,得益于精准医学时代赋予的能量,伴随肿瘤学日新月异的发展节奏,CCA的十年,无论从基础机制,还是在诊治水平上,无疑也都有了长足进步,从ENS-CCA专家组的这篇宏大综述中一览无余。然而,尽管进步很大,但相较于其他多个瘤种,CCA的进展速度并不理想,突破性进展更是差强人意,靶向、免疫治疗这些在其他瘤种中“如鱼得水”的治疗手段在CCA中也都尚未有出类拔萃的表现。患者日益提升的临床治疗需求也对临床医生、研究者、药企提出了更高的要求。下一个十年需要重点探索的方向和完成的课题在这篇文章里也都条分缕析。雄关漫道真如铁,CCA的下一个十年,路漫漫,任重道远!(作者:周军)
审批号:ENC-PD1-0029-CN
本资讯由默沙东医学团队提供旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多