查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





欧洲临床微生物学和传染病学会年会(ECCMID)是感染领域具有重大影响的学术大会,第34届ECCMID于2024年4月27日~4月30日在西班牙巴塞罗那举行。本文简要介绍了“下呼吸道疾病感染的管理“专题内容,主要讨论慢性呼吸道疾病患者中微生物感染和定植对疾病预后和治疗管理的价值。
西班牙瓦尔德希伯伦大学附属医院Eva Polverino教授在报告中指出,慢性呼吸道疾病如囊性纤维化、支气管扩张症、慢性阻塞性肺病、哮喘,容易发生慢性感染。虽然囊性纤维化发病率相对较低,但在慢性感染的证据最为充分,相反常见疾病如哮喘和慢性阻塞性中的肺病慢性感染证据较为匮乏。囊性纤维化慢性感染定义为在至少12个月内有超过50%的咽拭子或痰液样本呈阳性(采样间隔时间3个月),铜绿假单胞菌等致病微生物培养呈阳性1。支气管扩张慢性感染的定义差异大,最常用的定义是在12个月的过程中至少间隔3个月的两次同一病原体培养阳性2。慢性阻塞性肺病慢性感染的定义为在一年内至少有3次培养显示同一潜在致病微生物,且每次培养至少相隔1个月3。

囊性纤维化慢性感染特征及治疗策略
囊性纤维化是高加索人的常见常染色体隐性遗传病之一,囊性纤维化跨膜传导调节因子基因是目前已知的囊性纤维化唯一致病基因。囊性纤维化是一种影响许多器官的复杂遗传疾病,囊性纤维化肺病始于生命早期,伴有炎症和黏膜纤毛清除受损,随后的气道慢性感染导致肺功能进行性下降,呼吸道症状急性加重,85%的死亡率是由肺部疾病引起4。
在5岁以下的囊性纤维化患者痰液分离出的微生物中,占比第一的是金黄色葡萄球菌(70%甲氧西林敏感),而流感嗜血杆菌和铜绿假单胞菌分别位居第二(28%)和第三(18%)。在6至10岁年龄组中,最常检出金黄色葡萄球菌,而流感嗜血杆菌开始下降,铜绿假单胞菌增加到25%,在35岁以上患者中铜绿假单胞菌是慢性感染的最常见病原体3(图1)。
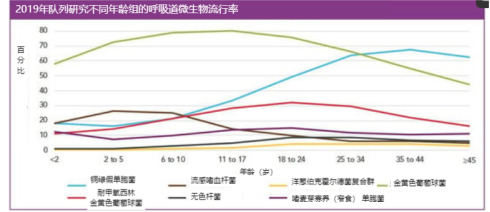
囊性纤维化患者自确诊起需终身治疗,多学科团队综合治疗,包括气道廓清、抗炎治疗、预防和根除感染在内的慢性肺病长期管理,营养和康复等全方位的管理策略。早期根除治疗可有效延缓慢性铜绿假单胞菌和黏液样铜绿假单胞菌感染,改善患者预期寿命。因此,欧洲国家、澳大利亚和北美都强调早期清除铜绿假单胞菌感染的重要性。

支气管扩张症慢性感染特征及治疗策略
支气管扩张症是临床常见的慢性呼吸系统疾病之一。一项在27个欧洲国家和以色列进行的一项多中心、前瞻性、观察性、非干预性队列研究(EMBARC研究),收集了2万多名支气管扩张症患者的临床数据5,其中大约60%的患者有某种慢性感染。从痰液样本中分离出的细菌中,最常见的是铜绿假单胞菌(25.1%),其次是流感嗜血杆菌(23.6%)、肠杆菌科(15.9%)(图2)。患者在一年内分离出一种以上的病原体较为常见,在7731例痰液阳性的患者中,有36.1%的患者分离出一种以上的主要病原体。
图2 EMBARC研究支气管扩张症患者痰样本的病原菌分布5
一项研究分析了来自欧洲和以色列10个不同支气管扩张症临床中心的2596名支气管扩张症患者的5年随访数据[]显示,铜绿假单胞菌在单变量分析中与较高的死亡率相关(HR2.02,95%CI1.53-2.66;P<0.0001),在多变量分析中,铜绿假单胞菌在频繁加重(每年两次或更多次)的患者中与死亡率增加独立相关(HR2.03,95%CI1.36–3.03;P=0.001)(图3)。
图3 铜绿假单胞菌感染对支气管扩张症患者死亡率的影响6
欧洲呼吸学会制定的“成人支气管扩张症管理指南”非常关注慢性感染的根除治疗7,而抗生素的长期管理如吸入或口服抗生素及物理治疗等手段旨在提高慢性感染治疗效率。指南建议新检出铜绿假单胞菌感染的患者,应进行病原体清除,对每年加重3次及以上成人支气管扩张症患者采用长程抗生素治疗,长期吸入抗生素治疗及长期口服大环内酯类治疗。此外,还建议对排痰困难的使用黏膜活性药物,对慢性排痰性咳嗽或咳痰困难病人在专业呼吸物理治疗师指导下使用气道廓清技术或工具。

慢性阻塞性肺疾病慢性感染特征及治疗策略
慢性阻塞性肺疾病致病微生物定植较为常见,不同研究和不同严重程度的患者数据显示稳定期22%-84%患者的呼吸道样本(痰培养样本、肺泡灌洗样本)培养物中分离出潜在的致病微生物8,9,10。其中最常分离的微生物包括流感嗜血杆菌、肺炎链球菌、卡他莫拉菌、铜绿假单胞菌等。慢性阻塞性肺病中的细菌定植是疾病进展的重要因素,气道细菌负荷的增加和种类变化与气道炎症加剧和FEV1加速下降有关11(图4)。
图4 慢性阻塞性肺疾病患者中细菌负荷和FEV1下降的关系11
西班牙肺病学和胸外科学会撰写的“慢性阻塞性肺疾病慢性支气管感染诊治共识”高度重视铜绿假单胞感染,虽然证据有限,对于首次分离出铜绿假单胞菌稳定期慢性阻塞性肺疾病患者,始终建议铜绿假单胞菌根除治疗;对于由铜绿假单胞菌或其他毒性特别强的非发酵革兰氏阴性杆菌引起的慢性支气管感染患者,应吸入抗生素治疗;对每年有3次或3次以上加重的支气管扩张症成人患者建议提供长期抗生素治疗(有条件推荐,中等质量证据);对患有支气管扩张症和慢性铜绿假单胞菌感染的成人患者进行长期吸入性抗生素治疗(有条件推荐,中等质量证据)12。

哮喘慢性感染特征及治疗策略
慢性支气管感染可加剧气道炎症,导致哮喘控制困难和临床结果恶化,患有慢性支气管感染的哮喘患者通常无法耐受吸入性抗生素治疗,从而导致预后更差。合并慢性支气管感染的哮喘患者的FEV1/FVC低于未合并慢性支气管炎的哮喘患者,表明慢性支气管感染可显著影响患者肺功能13。研究发现,在严重的哮喘患者中,慢性支气管感染的患病率约为10-15%。在哮喘合并支气管扩张症的患者中,这一比例上升至20-30%14。
无论哮喘患者是否合并支气管扩张症,铜绿假单胞菌、流感嗜血杆菌、卡他莫拉菌均为最常检出的微生物13。慢性感染是哮喘管理中的一个关键因素,需要更多的研究来确定其在哮喘患者中的实际患病率以及最佳的诊断和管理方法。对于慢性感染的早期识别和适当治疗可能改善哮喘患者的临床结果,并减少相关的医疗负担。
主任医师,医学博士
复旦大学附属华山医院 院感科主任,抗生素研究所临床应用室主任
中华医学会细菌感染与耐药防治分会 委员兼秘书长
中华预防医学会感染控制专业委员会 常委
中国医药教育协会感染疾病专业委员会 常委
中国细菌耐药监测网专家委员会 委员
上海市医学会感染与化疗分会 主任委员
上海市医院协会医院感染管理专委会 副主任委员
上海市医师协会临床合理用药分会 副会长
上海市抗菌药物合理应用与管理专委会 办公室主任
培元、培英、培微项目专家委员会 委员
教育部新世纪优秀人才、上海优秀青年医学人才
Eva Polverino教授强调,慢性感染的管理是改善患者预后和生活质量的关键,需要联合诊断、根除、抗微生物治疗、辅助治疗和抗炎治疗等手段进行综合管理。早期准确地诊断慢性感染对于制定有效的治疗计划至关重要。诊断方法包括影像学检查、微生物培养、分子生物学检测和临床评估,但尤其需要重视痰培养。样本采集的频率取决于患者的疾病类型和病情稳定性。在囊性纤维化患者中,建议每1-3个月进行一次样本采集;在支气管扩张症中,每3-6个月进行一次;而在慢性阻塞性肺疾病中,如果存在持续的黏液脓性痰液排出,则需要进行相应的样本采集。
根除治疗是针对慢性呼吸道感染的重要治疗策略。囊性纤维化患者中,根除治疗被明确推荐用于铜绿假单胞菌感染,耐甲氧西林金黄色葡萄球菌等病原体;支气管扩张症患者中,推荐对铜绿假单胞菌感染根除治疗;对于慢性阻塞性肺疾病和哮喘患者,需要更多的研究来确定根除治疗的最佳实践。抗生素可用来控制或治疗慢性呼吸道疾病中的细菌感染,不同的疾病适宜不同给药方式。慢性阻塞性肺病、哮喘、囊性纤维化、支气管扩张症适宜间歇性口服抗生素治疗,除此以外囊性纤维化还可采用吸入性治疗和脉冲式口服治疗。
下呼吸道疾病合并慢性感染,尤其是铜绿假单胞菌感染加剧气道炎症,导致临床结果恶化。慢性感染的早期诊断、细菌根除治疗、抗菌治疗(口服,脉冲式口服和气道吸入)等对改善患者的患者预后和生活质量尤为重要。
本文经杨帆教授审核
仅供医疗卫生专业人士阅读/参考
参考文献:
1.Lee TW, Brownlee KG, Conway SP, Denton M, Littlewood JM. Evaluation of a new definition for chronic Pseudomonas aeruginosa infection in cystic fibrosis patients. J Cyst Fibros. 2003;2(1):29-34. doi:10.1016/S1569-1993(02)00141-8.
2.Finch S, McDonnell MJ, Abo-Leyah H, Aliberti S, Chalmers JD. A Comprehensive Analysis of the Impact of Pseudomonas aeruginosa Colonization on Prognosis in Adult Bronchiectasis. Ann Am Thorac Soc. 2015;12(11):1602-1611. doi:10.1513/AnnalsATS.201506-333OC.
3.de la Rosa Carrillo D, López-Campos JL, Alcázar Navarrete B, et al. Consensus Document on the Diagnosis and Treatment of Chronic Bronchial Infection in Chronic Obstructive Pulmonary Disease. Documento de consenso sobre el diagnóstico y tratamiento de la infección bronquial crónica en la enfermedad pulmonar obstructiva crónica. Arch Bronconeumol (Engl Ed). 2020;56(10):651-664. doi:10.1016/j.arbres.2020.04.023.
4.Flume PA, Mogayzel PJ Jr, Robinson KA, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-808. doi:10.1164/rccm.200812-1845PP.
5.Chalmers JD, Polverino E, Crichton ML, et al. Bronchiectasis in Europe: data on disease characteristics from the European Bronchiectasis registry (EMBARC). Lancet Respir Med. 2023;11(7):637-649. doi:10.1016/S2213-2600(23)00093-0.
6.Araújo D, Shteinberg M, Aliberti S, et al. The independent contribution of Pseudomonas aeruginosa infection to long-term clinical outcomes in bronchiectasis. Eur Respir J. 2018;51(2):1701953. Published 2018 Jan 31. doi:10.1183/13993003.01953-2017.
7.Polverino E, Goeminne PC, McDonnell MJ, et al. European Respiratory Society guidelines for the management of adult bronchiectasis. Eur Respir J. 2017;50(3):1700629. Published 2017 Sep 9. doi:10.1183/13993003.00629-2017.
8.Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med. 2008;359(22):2355-2365. doi:10.1056/NEJMra0800353.
9.Matkovic Z, Miravitlles M. Chronic bronchial infection in COPD. Is there an infective phenotype?. Respir Med. 2013;107(1):10-22. doi:10.1016/j.rmed.2012.10.024.
10.Miravitlles M, Marín A, Monsó E, et al. Colour of sputum is a marker for bacterial colonisation in chronic obstructive pulmonary disease. Respir Res. 2010;11(1):58. Published 2010 May 14. doi:10.1186/1465-9921-11-58.
11.Wilkinson TM, Patel IS, Wilks M, Donaldson GC, Wedzicha JA. Airway bacterial load and FEV1 decline in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003;167(8):1090-1095. doi:10.1164/rccm.200210-1179OC
12.de la Rosa Carrillo D, López-Campos JL, Alcázar Navarrete B, et al. Consensus Document on the Diagnosis and Treatment of Chronic Bronchial Infection in Chronic Obstructive Pulmonary Disease. Documento de consenso sobre el diagnóstico y tratamiento de la infección bronquial crónica en la enfermedad pulmonar obstructiva crónica. Arch Bronconeumol (Engl Ed). 2020;56(10):651-664. doi:10.1016/j.arbres.2020.04.023
13.Olveira C, Padilla A, Martínez-García MÁ, et al. Etiology of Bronchiectasis in a Cohort of 2047 Patients. An Analysis of the Spanish Historical Bronchiectasis Registry. Etiología de las bronquiectasias en una cohorte de 2.047 pacientes. Análisis del registro histórico español. Arch Bronconeumol. 2017;53(7):366-374. doi:10.1016/j.arbres.2016.12.003.
14.Polverino E, Dimakou K, Traversi L, et al. Bronchiectasis and asthma: Data from the European Bronchiectasis Registry (EMBARC). J Allergy Clin Immunol. Published online February 23, 2024. doi:10.1016/j.jaci.2024.01.027.
查看更多