查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者信息:安徽省肿瘤医院放疗科:洪福 钱立庭 詹必红 张洪波
[ 摘 要 ] 目的 :对比不同放疗时机和方案对非小细胞肺癌(NSCLC)脑转移患者预后的影响。方法:研究对象为 2014 年 12 月至 2018 年 7 月于我院接受放疗及全身治疗的 61 例 NSCLC 脑转移患者。按照患者放疗时机,将其分别纳入早期放疗组(n=37)、晚期放疗组(n=24);按照患者放疗方案,将其分别纳入调强放疗(IMRT)组(n=32)、伽马刀立体定向放射治疗(SBRT 伽马刀)组(n=29)。比较各组患者近期疗效、不良反应发生情况以及生存情况,总结 NSCLC 脑转移放疗时机和方案的选择思路。结果 :(1)早期放疗组与晚期放疗组近期总有效率分别为 59.45%、58.33%,组间比较差异无统计学意义(P> 0.05)。早期放疗组与晚期放疗组不良反应发生率比较,差异无统计学意义(P> 0.05)。早期放疗组中位 OS 与 PFS 分别为 17.8 个月、4.0 个月,均高于晚期放疗组的12.5 个月、3.0 个月,差异有统计学意义(P< 0.05)。(2)IMRT 组近期总有效率为 37.50%,低于SBRT(伽马刀)组的 75.86%,差异有统计学意义(P< 0.05)。两组不良反应发生率比较,差异无统计学意义(P> 0.05)。IMRT 组中位 OS 与 PFS 分别为 9.5 个月、3.0 个月,均低于 SBRT(伽马刀)组的 18.0 个月、5.0 个月,差异有统计学意义(P< 0.05)。结论 :早期放疗以及 SBRT(伽马刀)方案在改善 NSCLC 脑转移患者预后及生存质量方面的作用较晚期放疗、IMRT 方案更为理想。
[ 关键词 ] 非小细胞肺癌;脑转移;放疗;全身治疗
约有 20% ~ 40% 的非小细胞肺癌(NSCLC)患者在疾病进程中会发生脑转移,若未得到积极治疗,患者自然状态下中位生存期往往不足 3 个月 [1]。放疗及综合治疗技术使 NSCLC 脑转移患者的预后得到了明显改善,但目前临床关于放疗时机和方案的选择尚存在争议 [2]。有学者认为,全脑放疗可造成神经认知功能损害,且与全身治疗同时进行时往往使得毒性反应加重 [3] ;但也有报道指出,推迟放疗可能会影响患者生存 [4]。此外,关于调强放疗(IMRT)与立体定向放射治疗(SBRT)在 NSCLC 脑转移治疗中的应用价值,目前尚无定论。此次研究就不同放疗时机和方案选择预后进行回顾性分析,现将研究方法与结果予以总结报道。
1 资料与方法
1.1 一般资料
研究对象为 2014 年 12 月至 2018 年 7 月于我院接受放疗及全身治疗的 61 例 NSCLC 脑转移患者。患者均经病理组织学或细胞学检查明确 NSCLC 诊断,头颅 MRI 或 CT 检查证实脑转移,且病例资料及随访资料均保存完整。61 例患者中,男 42 例,女 19 例,年龄 42 ~ 87 岁,中位年龄 62岁,病理分型:腺癌 48 例,鳞癌 13 例;脑转移数量:单发 30 例,多发 31 例。基因突变(EGFR/ALK 突变):15 例。
1.2 放疗方案患者于我院接受综合治疗,化疗 54 例,靶向治疗 20 例。
IMRT 放疗方案:患者仰卧位定位,予头部面罩固定。大体肿瘤体积(GTV)定义为影像学可见脑转移瘤,不包括周围水肿区;临床靶体积(CTV)即全脑(包括硬脑膜);计划肿瘤靶区(PGTV):GTV均匀外放摆位误差;计划靶体积(PTV):CTV 均匀外放摆误差位,外放后根据解剖屏障及病灶位置适当调整。采用 95% 等剂量曲线覆盖靶区,每日 1 次,每周 5 次,PGTV 共 45.0 ~ 59.4 Gy/15 ~ 33F, PTV 共 30 ~ 40 Gy/10 ~ 20 F。限定危及器官受量:晶体 ≤ 8 Gy,脑干≤ 54 Gy,眼球、视神经和视交叉≤ 50 Gy。 SBRT(伽马刀)放疗方案:患者仰卧位定位,予头部面罩固定。螺旋 CT 3~ 5 mm 层厚连续扫描病变区域获得定位图像,核准 Z 线值及患者体表标记点的 X、Y、Z 坐标参数及重复摆位读数,以不易移动的骨性标志作为体表标记点,将定位扫描所获得的定位图像通过网络或光盘传输系统输入到伽玛刀治疗计划系统。靶区勾画,GTV :为影像学(头颅 CT 结合 MRI)所示脑转移肿瘤病灶范围;PTV :GTV 均匀外扩摆位误差,外放后根据解剖屏障及病灶位置适当调整。由副主任以上医师审核勾画肿瘤靶区及计划,由医师及物理师共同对治疗计划进行评价及优化,根据病灶大小和部位选用不同大小的准直器,以单靶点或多靶点照射,采用 50% 等剂量曲线覆盖 PTV,每日 1 次,每周5 次,共28 ~ 51 Gy/7 ~ 17 F。
1.3 分组方案
1)根据放疗时机早期放疗组 :于全身治疗开始后 2周期内实施放疗 ;晚期放疗组 :于全身治疗开始后 2 周期后实施放疗。2)根据放疗方案,将其分别纳入 IMRT 组、SBRT(伽马刀)组。
1.4 观察指标分析
比较各组患者近期疗效、不良反应发生情况以及生存情况。疗效评价参照实体瘤疗效评价新标准(RECIST)[5] 进行评价。总有效率 =(CR + PR)/ 总例数×100%。不良反应发生情况参照常用药物毒性标准 3.0(CTCAE)及肿瘤放射治疗协作组(RTOG)急性放射性损伤分级标准予以评估 [6-7]。生存情况相关指标包括颅内疾病无进展生存期(PFS)、总生存期(OS),PFS 定义为确诊脑转移后首治疗至疾病进展或死亡,OS 定义为确认脑转移至死亡或末次随访 [8]。
数据采用 SPSS 18.0 进行分析,计数资料以(n/%)表示,采用χ2 检验,生存率分析采用Kalpan-Meier 法,并采用Log-rank 检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 早期放疗组与晚期放疗组对比
2.1.1 近期疗效和不良反应 早期放疗组共 37 例 CR5 例、PR17 例、SD5 例、PD10 例,CR 与 PR合计 22 例,总有效率 59.45%,晚期放疗组共 24 例 CR3例、PR11 例、SD4 例、 PD6 例,CR 与PR合计 14 例,总有效率 58.33%,组间比较差异无统计学意义(P> 0.05)。
早期放疗组与晚期放疗组各类型不良反应发生率比较,差异无统计学意义(P> 0.05)。见表 1。

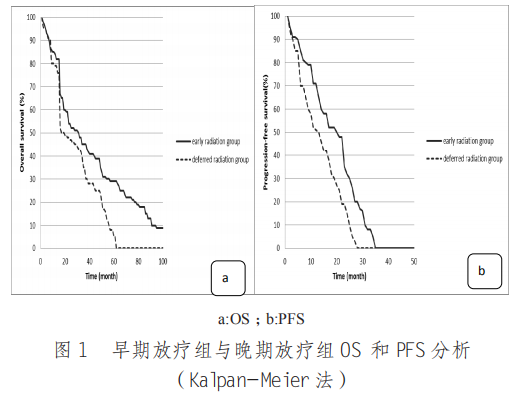
2.1.2 生存情况 早期放疗组中位 OS 与 PFS 分别为 17.8 个月、4.0 个月,均高于晚期放疗组的12.5 个月、3.0 个月,差异有统计学意义(P< 0.05)。见图 1。
2.2 IMRT 组与 SBRT(伽马刀)组对比
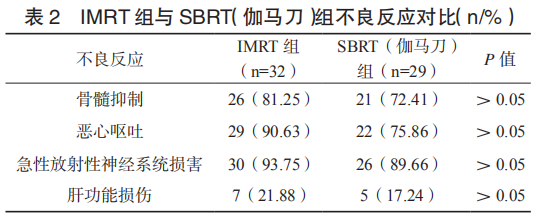
2.2.1 近期疗效与不良反应 IMRT 组共 32 例,CR3 例、 PR9 例、SD8 例、PD12 例,CR 与 PR 合计 12 例,近期总有效率 37.50%,SBRT(伽马刀)组共 29 例,CR5 例、 PR17 例、SD5 例、PD2例,CR 与 PR 合计 22 例,近期总有效率 75.86%,SBRT(伽马刀)组高于 IMRT 组,差异有统计学意义(P< 0.05)。IMRT 组与 SBRT(伽马刀)组各类型不良反应发生率比较,差异无统计学意义(P> 0.05)。见表 2。
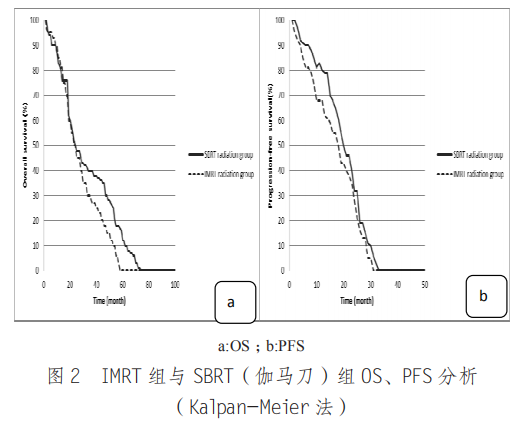
2.2.2 生存情况 IMRT 组中位 OS 与 PFS 分别为 9.5 个月、3.0 个月,均低于 SBRT(伽马刀)组的18.0 个月、5.0 个月,差异有统计学意义(P< 0.05)。见图 2。
3 讨论
脑转移是 NSCLC 晚期重要表现,也是疾病进展和死亡的主要原因。综合治疗结合脑转移放疗,能够改善患者预后 [9]。但脑放疗所致神经认知功能损害仍是不可忽视的一大问题,且有研究认为,脑放疗与全身治疗同时进行可导致毒性反应进一步加剧 [10],故目前临床关于 NSCLC 脑转移放疗时机的选择尚存在较大争议。
此次研究观察早期放疗与晚期放疗,两组患者近期疗效及不良反应发生率比较均未见明显差异,而早期放疗组 OS、PFS 优于晚期放疗组,考虑与早期放疗能够更好地控制脑转移进展有关,同时,两组患者不良反应均以 1 ~ 2 级为主。有研究显示,于全身治疗开始后 2 周内实施放疗,患者脑转移进展倾向于颅外转移,而全身治疗开始后 2 周后实施放疗,患者脑转移进展则倾向于颅内转移 [11-12],其原因可能为:早期放疗的实施可造成血脑屏障功能破坏,使得化疗药物、靶向治疗药物更易透过血脑屏障达到病灶,从而有效控制颅内转移。较颅内转移而言,颅外转移的诊治难度均更低,故患者往往可获得更为理想的生存质量 [13]。
NSCLC 属中度放射敏感肿瘤,肿瘤细胞分为富氧细胞和乏氧细胞,前者对常规剂量敏感,后者需高剂量方可产生杀伤效应 [14]。IMRT 具有精确定位、精准计划、精确照射等特点,能够实现靶区高剂量、靶区外低剂量照射,在满足肿瘤局部控制的同时,有效减少正常组织损伤;伽玛刀立体定向放疗系统是我国自主研发的立体定向设备,具有高度剂量聚集特性和三维适形功能,可实现超大剂量小靶区单次照射 [15-16]。在 NSCLC 脑转移放疗时机研究的基础上,此次研究就两种放疗方案的临床应用价值进行了对比,结果显示,采用伽玛刀立体定向放疗系统实施的 SBRT 的近期疗效优于 IMRT,患者 OS、PFS 更为理想且不良反应发生率并未增加。其优势在于放射治疗剂量分布高度集中,呈同心圆状紧密排列,而峰值以外的剂量梯度锐减,故能够在有效提高肿瘤组织治疗剂量的基础上,降低周围正常组织照射剂量、缩短治疗时间 [17]。此外,对 NSCLC 而言,若需达到 50% 以上的肿瘤控制率,常规分割剂量需超过 84 Gy,SBRT 采用大分割放疗技术,能够满足抑制肿瘤细胞再增殖、保护正常组织的要求,而 IMRT 常规分割剂量往往难以达到 84 Gy,也是导致近期疗效与生存情况不及 SBRT 的重要原因[18]。
综上所述,对于 NSCLC 脑转移患者,在全身治疗开展早期给予 SBRT,能够改善患者生存质量,同时并不会导致不良反应的增加。
参 考 文 献
[1] MULVENNA P, NANKIVELL M, BARTON R, et al. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy (QUARTZ): results from a phase 3, non-inferiority, randomised trial[J]. Lancet, 2016, 388(10055): 2004-2014.
[2] GOLDBERG S B, GETTINGER S N, MAHAJAN A, et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases: early analysis of a non-randomised, open-label, phase 2 trial[J]. Lancet Oncol,2016, 17(7): 976-983.
[3] 王洋 , 方健 , 聂鋆 , 等 . 非小细胞肺癌脑转移放疗时机的选择及疗效预后分析 [J]. 中国肺癌杂志 , 2016, 19(8): 508-514.
[4] JOHUNG K L, YEH N, DESAI N B, et al. Extended survival and prognostic factors for patients with ALK-rearranged non– small-cell lung cancer and brain metastasis[J]. J Clin Oncol, 2016, 34(2): 123.
[5] SOON Y Y, LEONG C N, KOH W Y, et al. EGFR tyrosine kinase inhibitors versus cranial radiation therapy for EGFR mutant non-small cell lung cancer with brain metastases: a systematic review and meta-analysis[J]. Radiother Oncol, 2015, 114(2): 167-172.
[6] COSTA D B, SHAW A T, OU S H I, et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non–small-cell lung cancer and brain metastases[J]. J Clin Oncol, 2015, 33(17): 1881.
[7] MAGNUSON W J, LESTER-COLL N H, WU A J, et al. Management of brain metastases in tyrosine kinase inhibitor– naïve epidermal growth factor receptor–mutant non–small-cell lung cancer: a retrospective multi-institutional analysis[J]. J Clin Oncol, 2017, 35(10): 1070-1077.
[8] SHIN S M, COOPER B T, CHACHOUA A, et al. Survival but not brain metastasis response relates to lung cancer mutation status after radiosurgery[J]. J Neurooncol, 2016, 126(3): 483491.
[9] SAHGAL A, AOYAMA H, KOCHER M, et al. Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for 1 to 4 brain metastases: individual patient data metaanalysis[J]. Int J Radiat Oncol Biol Phys, 2015, 91(4): 710-717.
[10] 金福军 . 全脑放疗联合靶向药物与单独全脑放疗治疗非小细胞肺癌脑转移疗效及安全性的 Meta 分析 [D]. 重庆 : 重庆医科大学 , 2017.
[11] CHURILLA T M, BALLMAN K V, BROWN P D, et al. Stereotactic radiosurgery with or without whole-brain radiation therapy for limited brain metastases: a secondary analysis of the North Central Cancer Treatment Group N0574 (Alliance) randomized controlled trial[J]. Int J Radiat Oncol Biol Phys, 2017, 99(5): 1173-1178.
[12] SPERDUTO P W, YANG T J, BEAL K, et al. Estimating survival in patients with lung cancer and brain metastases: an update of the graded prognostic assessment for lung cancer using molecular markers (Lung-molGPA)[J]. JAMA Oncol,2017, 3(6): 827-831.
[13] HALASZ L M, UNO H, HUGHES M, et al. Comparative effectiveness of stereotactic radiosurgery versus whole‐brain radiation therapy for patients with brain metastases from breast or non–small cell lung cancer[J]. Cancer, 2016, 122(13): 2091100.
[14] 陈韦 .XRCC1 SNP 与晚期 NSCLC 患者放疗疗效的关系 [D]. 西安 : 第四军医大学 , 2014.
[15] PARTL R, FASTNER G, KAISER J, et al. KPS/LDH index: a simple tool for identifying patients with metastatic melanoma who are unlikely to benefit from palliative whole brain radiotherapy[J]. Support Care Cancer, 2016, 24(2): 523-528.
[16] 任正婷 . 伽玛刀立体定向放疗早期非小细胞肺癌疗效及生存质量分析 [J]. 中华放射医学与防护杂志 , 2012, 32(6):621-625.
[17] SCHULER M, WU Y L, HIRSH V, et al. First-line afatinib versus chemotherapy in patients with non–small cell lung cancer and common epidermal growth factor receptor gene mutations and brain metastases[J]. J Thorac Oncol, 2016, 11(3): 380-390.
[18] MARTÍNEZ P, MAK R H, OXNARD G R. Targeted Therapy as an Alternative to Whole-brain Radiotherapy in egfr-mutant or alk-positive Non–small-cell Lung Cancer With Brain Metastases[J]. JAMA Oncol, 2017, 3(9): 1274-1275.
查看更多