侵袭性肺曲霉病(IPA)常发生在免疫功能低下的个体中,如长期中性粒细胞减少、造血干细胞移植后、器官移植受者或血液系统恶性肿瘤的患者。近年来,在流感患者中发生IPA的报道越来越多,与流感相关侵袭性肺曲霉病(IAPA)和与新型冠状病毒感染(COVID-19)相关的侵袭性肺曲霉病(CAPA)是2种最常见形式,其中大部分患者是非免疫力低下人群。本文中我们将对IAPA和CAPA的流行病学、发病机制、临床表现、诊断和治疗进行讨论。
IAPA和CAPA的发病率具有地区差异。一项比利时和荷兰2009—2016年的队列研究显示,在入住重症监护病房(ICU)的流感患者中证实流感是发生IPA的独立危险因素。IAPA的发生率为19%(83/432),90天死亡率为51%。加拿大2014—2019年的队列研究中显示,IAPA发生率为7.2%(8/111),死亡率为50%(4/8)。中国台湾地区2015—2016年的研究中显示IAPA发生率为(21/124)16.9%,死亡率为66.7%(14/21)。中国2017—2018年的一项研究中IAPA发生率为28.1%(18/64),死亡率为44.4%(8/18)。一项意大利2020年2—4月的队列研究中显示,入住ICU的重症COVID-19患者中,CAPA发生率为27.8%(30/108),90天死亡率为44%。荷兰的一项研究中CAPA发生率为19.4%(6/31),死亡率为66.7%(4/6)。美国威尔士的一项研究中CAPA发生率为14.1%(19/135),死亡率为57.9%。法国的一项研究中CAPA发生率为33.3%(9/27),死亡率为33.3%(3/9)。德国的一项研究中CAPA发生率为26.3%(5/19),死亡率为60%(3/5)。中国武汉的一项队列研究中CAPA发生率为1%(1/99)。中国浙江的一项研究中CAPA的发病率为7.7%(8/104)。中国江苏的一项研究中CAPA发生率为23.3%(60/257)。
IAPA和CAPA的发病机制尚不完全清楚,包括病毒感染和曲霉菌本身等因素。流感病毒和COVID-19会导致上皮细胞的损坏、高炎症反应和免疫反应受损等。首先,病毒感染会破坏上皮细胞的屏障功能。重症流感会破坏呼吸道上皮细胞和清除曲霉分生孢子所需的相关纤毛功能,从而导致对抗侵袭性肺曲霉病的保护性上皮屏障的广泛破坏。虽然COVID-19通过血管紧张素转换酶(ACE)受体进入呼吸道上皮,并不会造成和流感一样的上皮损伤,但是它会导致弥漫性肺泡和内皮血管细胞损伤,毛细血管通透性增加和液体渗漏导致充血、水肿和弥漫性炎症浸润。其次,病毒感染可激活炎症细胞,促发炎症介质瀑布样释放。在肺部,病毒感染的细胞会释放损伤相关模式分子(DAMP),这些分子模式会被相邻的上皮细胞和肺泡巨噬细胞检测到。随后这些细胞的激活导致促炎细胞因子的释放,包括白细胞介素-6(IL-6)、γ干扰素(IFN-γ)、白细胞介素-1β(IL-1β)和肿瘤坏死因子- α(TNF- α), 以及各种趋化因子。这些免疫介质触发巨噬细胞和中性粒细胞的进入,进一步加剧了局部炎症反应。高炎症反应是流感和COVID-19的共同表现,其特征是高浓度的循环炎性细胞因子、急性期反应物、铁蛋白和噬血细胞作用,其中一些是噬血细胞综合征(HPS)的典型特征。最后,在流感和COVID-19中也观察到淋巴细胞减少,CD4+和CD8+淋巴细胞的减少常伴随着T细胞介导的免疫反应受损。宿主对曲霉的防御涉及多种免疫作用,第一层防御层是气道上皮的防御作用。气道中先天免疫屏障的完整性对于防止曲霉进入肺实质的侵袭性生长至关重要,因此流感和COVID-19引起的气道损伤使患者易患与病毒性肺炎相关的IPA。第二层是肺泡巨噬细胞和中性粒细胞。这些细胞通过吞噬和释放活性氧(ROS)以及产生细胞因子和趋化因子来消除分生孢子。流感病毒已被证明可以抑制肺泡巨噬细胞和中性粒细胞中还原型烟酰胺腺嘌呤二核苷磷酸(NADPH)氧化酶依赖的ROS的产生,影响其杀菌能力。这种对ROS产生的短暂抑制模拟了慢性肉芽肿性疾病(CGD)的表型。CGD患者在遗传上缺乏NADPH氧化酶复合物2型的一种成分,并且对侵袭性曲霉病高度敏感。此外,这些患者的ROS缺乏导致巨噬细胞中非典型自噬小体的形成缺陷,这一过程被称为LC3相关吞噬作用(LAP)。LAP对于消除吞噬细胞中的曲霉至关重要。因此可以推测流感病毒对ROS的抑制可能导致LAP受损,从而导致曲霉不受抑制地生长。
1. 临床症状 重症流感患者常见的临床表现为发热、咳嗽、呼吸困难等,重症COVID-19患者常见的临床表现为发热、呼吸困难、低氧血症和急性呼吸窘迫综合征等。IAPA和CAPA患者缺乏特异性的临床症状,但临床上当重症流感和COVID-19患者出现在恰当的抗生素治疗后仍持续发热≥3天,或使用抗生素期间持续退热至少48h后复发发热、胸膜炎性疼痛、呼吸困难、咯血、经过恰当的抗生素治疗和呼吸支持后呼吸功能持续恶化等症状出现时应怀疑IAPA或CAPA,可通过影像学检查和真菌学检查进一步完善诊断。2. 影像学表现 重症流感并发肺炎患者的影像学表现为肺实变影、斑片状、磨玻璃影、肺空洞、多叶段渗出性病灶,个别可见胸腔积液。COVID-19患者影像学早期表现为多发小斑片影及间质改变,以肺外带明显,进而发展为双肺多发磨玻璃影、浸润影,但COVID-19患者晚期影像学表现不具有特异性,可表现为由于细菌性肺炎、坏死性肺炎引起的肺空洞或伴有小叶中央结节的“树芽”征。因此,仅以放射学表现不足以定义CAPA和IAPA患者。由于IAPA和CAPA的在ICU中的高发生率和死亡率,建议在重症流感患者影像学出现肺浸润时即完善检查并考虑IAPA的诊断。重症COVID-19患者影像学若表现为多个肺结节或肺空洞时即完善检查并考虑CAPA的诊断,因为它们很少单独出现在COVID-19患者中。3.支气管镜检查 诊断性支气管镜检查观察到上皮斑块、假膜或溃疡是诊断曲霉菌性气管支气管炎的重要依据,但是COVID-19患者进行支气管镜检查有产生气溶胶的风险,为了医护人员的健康,不建议将该检查作为COVID-19患者的常规检查。4. 真菌学检测 在IAPA和CAPA的诊断中,肺活检显示浸润性真菌元素和培养时曲霉菌生长或组织中曲霉菌聚合酶链反应(PCR)是诊断的“金标准”,但是对于COVID-19患者,肺活检是高风险程序,因此临床应用有限。支气管肺泡灌洗液(BALF)中半乳甘露聚糖(GM)的检测和培养是IAPA和CAPA患者的重要检测方法,以BALF GM指数≥1.0作为阳性阈值具有较高的敏感性。IAPA患者中BALF GM检测及培养的敏感性分别为88%和63%,CAPA患者中BALF GM检测及培养的敏感性分别为100%和63%。血清GM的检测也有助于IAPA和CAPA的诊断。以血清GM指数>0.5作为阳性阈值,IAPA患者中血清GM的敏感性为65%,CAPA患者中仅为34%。血清1,3-β-D-葡聚糖(BDG)检测也可有助于IAPA和CAPA的诊断。一项对ICU患者中侵袭性真菌感染的研究表明,以血清BDG>80pg/ml作为阳性阈值,连续2次阳性检测结果产生了90%的特异性。但是BDG检测对曲霉菌没有特异性,需要排除使BDG浓度升高的其他原因。侧流层析分析(lateral flow assay,LFA)也有助于IPA的诊断,在入住ICU的IPA患者中,BALF LFA的敏感性为88%,特异性为89%,且LFA评估迅速,可用于快速筛查。但是LFA目前应用于IAPA和CAPA患者中的诊断价值尚不明确,仍需要深入研究。非支气管镜的支气管肺泡灌洗液(non-bronchoscopic lavage, NBL)和曲霉菌PCR也有助于IPA的诊断,但目前应用于IAPA和CAPA患者中的诊断价值,仍需要深入研究。
2019年欧洲癌症研究和治疗组织/美国真菌病研究组(EORTC/MSG)更新了侵袭性真菌病的定义和诊断,采用分级诊断,分为确诊(proven)、临床诊断(probable)和拟诊(possible)。但是宿主因素仍是拟诊和临床诊断的必备要素,而IAPA和CAPA患者大部分不具有传统的宿主因素,因此,此诊断标准不适用于IAPA和CAPA患者。Blot等制定了针对ICU患者中IPA的临床诊断标准,进行诊断前患者必须满足下呼吸道标本曲霉培养阳性,以此为“准入标准”会存在漏诊的风险,且CAPA患者进行BALF有产生气溶胶的风险,为了保护医护人员,临床上不推荐患者常规行BALF。
2020年,由29名国际专家组成的团队从准入标准、宿主因素、临床特征和真菌学证据四个方面对IAPA进行阐释,并制定IAPA诊断新标准。诊断同样采用分级诊断,分为确诊和临床诊断。除了流感诊断检测呈阳性外,患者还需要将临床综合征与流感相符作为定义的一部分。为避免最初流感抗原检测呈阴性,但入院后(通过PCR)检测流感呈阳性,导致漏诊患者的风险,该诊断标准按时间尺度(例如ICU入住前1周至入院后72~96h之间)提出建议。准入标准是:与入院时间相关的流感PCR或抗原检测呈阳性,且伴有呼吸窘迫症状需入住ICU。同时将IAPA的诊断分为曲霉菌性气管支气管炎和非曲霉菌性气管支气管炎。具体诊断标准参考表1。
表1 流感相关侵袭性肺曲霉病的诊断标准
注:PCR.聚合酶链反应;GM.半乳甘露聚糖;BALF.支气管肺泡灌洗液
IAPA一般为重症患者,需要入住ICU诊断和治疗。但是临床医师对IAPA的认识仍不足,1份关于IAPA的国家调查报告,邀请了体外生命支持组织(ELSO)、美国危重病医学会(SCCM)和欧洲危重病医学会(ESICM)的20093名成员参加。共收到565份答复,其中90%来自重症监护病房医师。值得注意的是,40%的受访者来自美国,37%来自欧洲,22%来自其他国家和地区,调查结果显示:许多临床医师不知道流感与曲霉病之间的关系,63%(n= 347)的受访者在过去5年中从未听说过或见过IAPA。所以需要普及IAPA的知识,规范其诊疗流程。由来自7个欧洲国家、美国和中国台湾地区的专家小组,制定的患者入住ICU后诊断流程(图1),以此规范和普及临床IAPA的诊断流程。
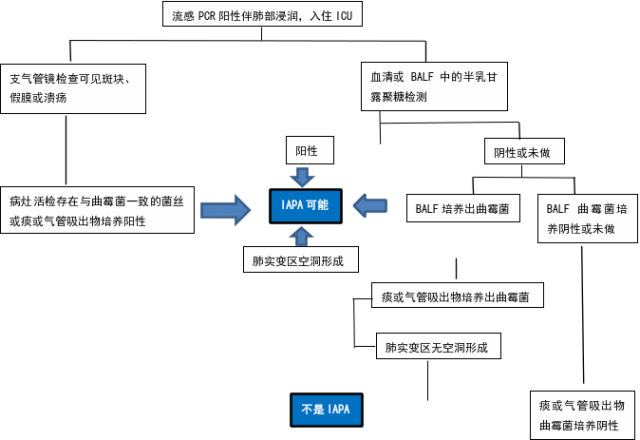
注:PCR.聚合酶链反应;ICU.重症监护病房;BALF.支气管肺泡灌洗液;IAPA.流感相关侵袭性肺曲霉病
图1 流感相关侵袭性肺曲霉病诊断流程图
2020年由22名国际专家组成的团队对CAPA进行阐释,并制定了CAPA诊断新标准。诊断采用分级诊断,分为确诊、临床诊断、拟诊。此诊断的准入标准是:患者伴有呼吸窘迫需要入住ICU,且入院到入住ICU前2周内新型冠状病毒(SARS-CoV-2)反转录聚合酶链反应(RT-PCR)检测呈阳性,或在入住ICU后72~96h内RT-PCR呈阳性。同时将CAPA的诊断分为曲霉菌性气管支气管炎和非曲霉菌性气管支气管炎。具体诊断标准,见表2。
表2 与新型冠状病毒感染相关的侵袭性肺曲霉病的诊断标准

注:SARS-CoV-2.新型冠状病毒;RT-PCR.反转录聚合酶链反应;PCR.聚合酶链反应;BALF.支气管肺泡灌洗液;GM.半乳甘露聚糖;NBL.非支气管镜的支气管肺泡灌洗液
IAPA和CAPA的抗真菌治疗策略参考IPA的治疗策略。但是鉴于IAPA和CAPA的高发病率和ICU死亡率,通过进行抗真菌预防可能是一种可行的管理策略。然而,目前尚无抗真菌药物获准用于ICU患者的预防治疗。
IPA的一线治疗选择包括伏立康唑和艾沙康唑,其他选择包括棘白菌素、脂质体两性霉素B和泊沙康唑。伏立康唑是IPA的一线治疗用药,但伏立康唑在应用中有几个缺点,比如治疗窗窄,易发生药物相互作用。因此,使用伏立康唑建议进行治疗药物监测(therapeutic drug monitoring, TDM)以确保血浆浓度维持在目标范围内(1-5.5mg/L)。相较于伏立康唑,艾沙康唑的毒性小,药物相互作用较少。但是对于正在接受肾脏替代疗法或其他体外治疗的患者或肥胖患者建议进行TDM。棘白菌素不建议单一应用,且对于肥胖患者和使用地塞米松患者建议进行TDM。脂质体两性霉素B是ICU中治疗IPA的替代选择,但是脂质体两性霉素B具有肾毒性,在临床应用是需要进行肾功能监测。最近,泊沙康唑被证明在治疗IPA方面不劣于伏立康唑。泊沙康唑被证明对中性粒细胞减少型急性髓系白血病患者和异基因造血干细胞移植后移植物抗宿主病患者有效,使这些高危患者组的IPA发病率降至2%以下,可归因死亡率下降。该药物良好的安全性、静脉注射制剂的可用性、肺组织中的积累以及针对唑类耐药性烟曲霉的良好残留活性,使该药物成为ICU重症流感患者预防用药的合适候选。但是泊沙康唑应用于ICU患者的临床经验仍然有限,有待在进一步临床研究中积累。
作者:中国人民解放军总医院 刘继红 谢 菲
主任医师,博士,博士后导师
解放军总医院呼吸与危重症医学部重症医学科主任
中华医学会呼吸学分会危重症学组委员
中华医学会结核病学分会危重症学组副主任委员
中国医师协会呼吸学分会危重症学组委员
中国医师协会急救复苏专委会危重病与人工生命支持学组委员
全军呼吸专业委员会危重症学组委员
北京市医学会呼吸危重症学组委员
主持国家自然科学基金、国家十三五重点研发计划、后勤科研重点项目等多项国家及省部级课题
第一完成人获得解放军总医院医疗成果一等奖、中国产学研创新成果一等奖,主要完成人获得军队科技进步一等奖
本文由中国医学论坛报社呼吸与危重症编委会编委、呼吸危重症领域主编
空军军医大学西京医院宋立强教授组稿









