查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





如果说原研药是从无到有的创新存在,是科技进步和智慧结晶的代表,那么仿制药则是以原研药为“偶像”,从各个方面不断向其靠近的存在。以舒更葡糖钠为例,我们知道,肌肉松弛药(简称肌松药)是确保全麻手术顺利实施的要素之一,但只要使用肌松药,就有可能发生术后肌松残余。肌松残余是麻醉恢复期的“隐形杀手”,是造成患者并发症及死亡的重要因素。舒更葡糖钠是全球首个特异性结合性肌松拮抗创新药物,可逆转不同程度的肌松,改善全麻手术患者的预后。那么其仿制药品在通过《关于开展仿制药质量和疗效一致性评价的意见》后,与原研药品还可能有哪些差异?临床中应如何选择?基于以上问题,本次特别邀请了复旦大学药学院程能能教授和药剂学系沙先谊教授,共话舒更葡糖钠结构特性和临床应用价值,以促进麻醉药物的合理应用和精细化管理,帮助提高医疗机构的综合医疗水平以及患者就医体验,让更多患者获益。
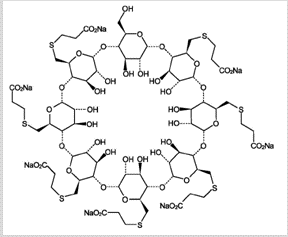
图 单-羟基舒更葡糖化学结构式

程能能
复旦大学药学院药理学系教授、博士生导师
上海市临床药理学专业委员会主任委员
上海市药理学会常务理事
中国药理学会荣誉理事
复旦大学教学名师,国家级精品课程《药理学》主讲教授
研究方向:药物临床定量评价,药物不良反应研究

沙先谊
复旦大学药学院,教授,博士生导师
中国药学会青年药剂学专委会委员
中国药促会创新研发专委会委员
上海市药学会理事、中药专委会副主任委员
上海青年科技启明星 ,上海市药品审评专家
国家执业药师职业资格认证工作专家
美国ASCO会员
研究方向:药物新剂型与新制剂的研究与开发
主持承担完成的国家自然科学基金、上海市科委等纵向课题近20项,企业合作课题50余项;在ACS Nano、Nano Letters、Biomaterials等学术期刊发表SCI论文70多篇,他引2000余次;申请专利10余项,授权专利5项;荣获上海市药学科技二等奖、中国药学会赛诺菲青年生物药物奖等奖项,已获得新药证书1项;新药临床批件2项。
当前化学注射剂仿制品
一致性评价的标准仍待完善
沙先谊教授:2016年《关于开展仿制药质量和疗效一致性评价的意见》(以下简称《一致性评价》)的发布,标志着中国仿制药质量和疗效一致性评价工作全面展开。整体来看,注射剂仿制药的一致性评价会对仿制药体外水平的质量和临床方面的疗效进行评估,虽然生物等效和临床等效并不作为注射剂仿制药一致性评价硬性要求,但仍然需要评估某些特殊注射剂仿制药和原研药在疗效方面存在差异性的可能性。
首先,对于舒更葡糖钠注射剂来说,由于是血管内给药,仿制药与原研药基本不存在药物吸收速度/程度的差异,因此相较于药物的有效性,我们应更看重药物的安全性,这也影响着药品的质量。与原研药相比,影响仿制药质量因素主要包括核灭菌工艺、处方、辅料等,而这些因素往往也正是原研药的核心技术,仿制存在较高的技术瓶颈。
第二,从疗效角度分析,目前我们通常认为血管内注射给药后,药物进入到体循环,血药浓度能够代表和反映药物的疗效水平。但从药理学角度,疗效的强弱取决于药物在靶部位/靶组织的分布。所以对于某些药物,即使仿制药的外周血包括循环血药浓度与原研类似,也并不能够直接反映药物在疗效上的一致。
综上,个人认为,对于注射剂的临床一致性评价,还需针对不同的疾病和药物的种类,根据药物动力学和作用机制相应进行精准化的调整和修订。
程能能教授:我们知道,国家批准仿制药上市的主要目标是在节省成本的前提下,让其与原研药临床等效,也就是说仿制药的安全性有效性就需要与原研药一致,可以完全替代原研药。
对于注射剂以外的其他类型仿制药品,在与原研药做一致性评价时,保证主要化学结构相同的同时,如果有相同的药物吸收速度和程度,就可以推论两种药物具有相同的临床疗效。但舒更葡糖钠注射剂属于血管内给药,在一致性评价标准中没有对药物吸收过程的评估,只有对制药或化学等效的评估。那么通过了一致性评价化学等效性的舒更葡糖钠仿制药,能不能就代表着其与原研药有着相同的临床等效性?这一点仍有待考量。
首先,我们从舒更葡糖钠的药理作用方面分析。与传统药物作用于机体靶点不同,舒更葡糖钠是通过与罗库溴铵和维库溴铵产生药物螯合作用。而舒更葡糖钠的化学结构复杂,包含40个手性中心,这就意味着虽然仿制药与原研药虽然化学结构相同,但很可能存在位置异构体。常规是采用色谱技术作出的化学等效一致性评价,但我们知道常规的色谱技术难以辨别不同的手性结构,因此舒更葡糖钠仿制药的化学等效的结果可能存在一定偏差。如果这些手性结构偏差会对药物螯合作用产生重要影响,那么仿制药与原研药在临床等效方面可能还会存在差异。
其次,目前对于注射剂仿制药在化学的制剂工艺这方面是不是能够达到充分的一致?如果仿制药的制剂工艺与原研药有差异,那么可能导致舒更葡糖钠仿制药除主要成分外的杂质成分与原研药不尽相同,这些差异会不会直接影响药物螯合作用,进而对疗效、药物起效时间以及药物持续作用时间产生影响?这也是仿制药应用于临床后需要重点考察的方向。
化学注射剂仿制品一致性评价
关于特殊结构、药物动力学
及疗效方面的特殊考虑
沙先谊教授:在临床实际用药过程中,部分麻醉药品仿制药与原研药可能在起效速度、麻醉深度和持续时间等方面存在一定程度的差异性。
其原因可能在于,从化学结构的角度来看,仿制药与原研药的成分一样,质量标准相同,理论上疗效应该一致。但经过进一步深层次的分析,麻醉药品的疗效最终取决于药物在靶组织或靶器官的分布,才能够让药品发挥相应的药理作用,因此,药物动力学的评价尤为重要。对于特殊品种的注射剂仿制药的评价我们还应特殊考虑以下三点。
第一,舒更葡糖钠特殊的三维结构对药物代谢的影响。舒更葡糖钠是经过修饰的γ-环糊精衍生物,三维结构与一个凹陷的缩短的圆锥体相似,罗库溴铵和维库溴铵正好适配其凹槽,结合后形成一个复合体,因此本身分子较大,在代谢时会为肾脏增加负担。如果药物的立体结构发生微小变化,就有可能引起药物在体内分布、结合以及循环时间等差异性,最终影响药物在体内消除过程,产生有效性和用药安全的相关风险。目前对于非微粒型注射剂的评价技术要求中一般并不包括体内的相关药代动力学研究内容,在一定程度上,无法充分反映仿制药与原研药在人体内的动力学,包括分布、代谢、排泄方面的一致性。
第二,舒更葡糖钠特殊的手性结构是否能够影响其与肌松药的结合能力。舒更葡糖钠中环糊精结构可以通过氢键作用,吸附/包合其他物质,产生增溶作用,但如果仿制药和原研药在手性结构、杂质含量方面的不同,可能会导致与肌松药的结合能力不同,影响药物的临床疗效。
第三,舒更葡糖钠与肌松药结合进入到血液循环后的代谢速度和效率。随着舒更葡糖钠与肌松药结合量的不断增加,分子量会越来越大,那么药代动力学也会随之发生改变,患者的机体代谢负担也会随之增加。如果仿制药与原研药的代谢速度和效率有差别,在血液循环过程中还会出现肌松药再次释放的情况,进而会影响用药安全。
综合来看,个人认为对于血管内给药的麻醉药品,在开展一致性评价时,除严格规定的药学一致性评价以外,应考虑开展药代动力学的评估,有利于保证仿制药在有效性和安全性的一致。
程能能教授:如前面提到,舒更葡糖钠的化学结构复杂,包含40个手性中心。每种不同的手性结构有着不同的稳定性,这也会影响舒更葡糖钠的排泄形式。
我们知道,舒更葡糖钠原研药是能够与肌松剂结合,发生螯合作用,并最终以这种螯合形式排除体外。而由于舒更葡糖钠复杂的手性结构,仿制药能否具有同样的稳定性,以确保药物以螯合形式排出体外,让肌松药没有重新在体内释放的机会,这一点在一致性评价中没有进行评估,而这一点也可能影响仿制药的临床疗效和安全性。
希望未来对于仿制药品的一致性评价应该秉持更加科学的态度,以确保后期临床用药安全性和有效性。
多角度、更科学地评估化学注射剂
手性结构的药物等效性和安全性
程能能教授:影响化学注射剂仿制药和原研药安全性和有效性差异的因素包括药物药剂学、药理学(药代动力学和药效学)以及治疗学三大因素。
我们常规认为,仿制药物与原研药在分布、代谢和排泄(DME)方面是一致的,那么再加上化学实体一致,我们就可以推论仿制药进入血管后与原研药的作用和DME就是一致的。
但舒更葡糖钠的特殊性在于其结构复杂,仿制药很难像其他小分子化学一样,与原研药保持完全高度的一致,药物杂质是否会在体内发生变化,是影响药物安全性的关键。
在有效性方面,仿制药与肌松药螯合物的结合速度、螯合物作用持续时间,以及仿制药是否以螯合物形式排泄是影响仿制药有效性的重要因素。
沙先谊教授:化学药物注射剂中手性药物生物等效性的评估方法主要有两种,一是采用单纯化学分析方法的PK研究,例如色谱分析技术;二是通过药效指标的方法评估,例如舒更葡糖钠对肌松药的清除和结合能力的相关药效学指标。但由于舒更葡糖钠手性位点多,手性分离难度较大,又无法在健康人群开展相关动力学研究,所以可以考虑采用超滤等分离方法,在体外对舒更葡糖钠的结合能力进行比较与分析,间接的评价仿制药在疗效和安全性与原研药一致。
正如程教授所说,常规认为化学结构一样,那么一般就认为仿制药的安全性和有效性也应该与原研药一致。但是从更深层次角度分析,对于特殊结构的药物,基于药物的作用机制,舒更葡糖钠并非直接与体内靶点结合,而是与肌松剂结合,起到“解毒”效果。而仿制药与原研药在有关物质量和种类不同,可能导致舒更葡糖钠与肌松剂的结合能力发生改变,进而影响舒更葡糖钠仿制药的“解毒”效果,对安全性产生影响。
综上,对于具有特殊作用机制的血管内给药的化学药品注射剂,目前的一致性评价的技术要求仍待完善,需要发展更加精准化和个体化的评价标准,以期保证结论的合理性和科学性。
严格的临床试验是原研药的最直接优势
沙先谊教授:原研药最重要的优势在于,其上市前经过了严格的临床试验,充分证明了其有效性和安全性,并且多年来在临床实践中得以印证。
仿制药上市前的有效性和安全性一般是基于药学一致性评价的结果,药学一致性评价的结果与临床实际情况是否有差异,需要在仿制药上市以后再作进一步分析和评估。
程能能教授:原研药通过临床试验,具有最直接的安全性和有效性相关证据。而仿制药具有的是间接证据,依赖现有的一致性评价体系,通过替代指标来间接推论其临床获益和风险。那么仿制药的安全性和有效性目前还取决于间接证据,即一致性评价体系的完善程度。然而,一套标准可能不适用于所有药物。相信日后一致性评价标准的发展方向必然是逐渐精准化、个性化。
查看更多