查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





帕金森病合并体位性低血压及卧位高血压的临床特征分析
作者:柳竹1,苏东宁1,刘亘梁1,王雪梅1,王展1,马惠姿1,冯涛1,2,3
作者单位
1. 首都医科大学附属北京天坛医院运动障碍性疾病科 北京100070
2. 国家神经系统疾病临床医学研究中心 北京100070
3. 北京脑重大疾病研究院帕金森病研究所 北京100070
自主神经功能损害是帕金森病(Parkinson’s disease,PD)患者常见的非运动症状。体位性低血压(orthostatic hypotension,OH)与卧位高血压(supine hypertension,SH)这一对相反的心血管系统自主神经功能受损症状常存在或并存于PD 患者中,仅29%的PD 患者既没有OH也没有SH[1,2]。社区流调显示健康老人OH的发生率约为2%,在高血压得到控制的老人中增加到5%,在高血压未得到控制的老人中增加到19%[3]。对于同时存在OH和SH的PD患者,SH相关的心脑血管并发症的风险经常被判断为与慢性高血压相似,给予相应治疗的结果可能增加OH的风险;另一方面,OH的治疗也可能加重SH,增加心脑血管疾病的风险。在PD患者中,心血管自主神经功能障碍的患者更有可能表现出认知障碍,并且增加心脑血管疾病发生的风险[4]。但目前少有针对PD患者合并OH及SH的临床研究及其与心脑血管风险之间的研究。此外,多项研究表明多巴胺能药物可能会诱发OH,或加重PD患者OH的血压下降[5-7]。因此,本研究将药物的影响也纳入观察范围,探讨更全面的PD患者血流动力学特征。
1.1 一般资料
连续观察2018年1月至2019年6月我科收治的合并OH的PD患者198例。所有入组患者依据卧位高血压的诊断,在仰卧位休息至少5 min后测量的收缩压≥140 mmHg和/或舒张压≥90 mmHg[4,10],分为卧位高血压组(SH组)及无卧位高血压组(无SH组)。
入组标准:①年龄18~80 岁;②符合国际帕金森病和运动障碍学会2015 年帕金森病临床诊断标准[8];③在床旁卧立位试验中符合OH诊断:由仰卧位变为直立位后3 min 内收缩压持续下降至少20 mmHg或舒张压持续下降10 mmHg[9];④可配合各项量表评估。
排除标准:①排除继发性PD合征、PD叠加征或多巴反应肌张力障碍;②排除入组前即诊断患有肾功能不全等可能造成自主神经系统损害的基础疾病;③排除脱水、急性失血、药物(如降压药和抗抑郁药)、心输出量减少(如缩窄性心包炎、心肌病和主动脉瓣狭窄)、内分泌疾病(如肾上腺功能不全和嗜铬细胞瘤)和血管过度扩张(如类癌综合征);③排除严重OH需要服用升压药物者。
患者知晓研究内容,患者或家属签署知情同意书。本研究已通过首都医科大学附属北京天坛医院伦理委员会审核(No. KY2016-028-01)。
1.2 方法
1.2.1资料收集及量表评估 详细记录临床信息,内容包括性别、发病年龄、病程、目前患有的心脑血管疾病(心肌梗死、脑梗死、脑出血等)、现使用药物情况、体质指数等。采集血液样本,包括血糖、血脂、同型半胱氨酸等。由2名运动障碍专科医生测评多项运动功能及非运动功能量表。其中简易智能精神状态检查量表(mini-mental state examination, MMSE)总分30分,总分<27分即为认知功能障碍(21-26为轻度、10-20分为中度、0-9分为重度)。蒙特利尔认知评估(montreal cognitive assessment, MoCA)满分30分,总分≤26分表明存在认知功能障碍,评分越低表明认知功能障碍越严重。
1.2.2 血压测量卧立位试验:患者在床边仰卧位休息5min后,记录血压和心率;随后在床旁站立,在站立即刻和1、3、5min时记录血压和心率,记录站立时最低的血压值。采集时间为急性左旋多巴冲击试验服药前以及服药后1、2、3h。每个时间点血压均测量2次,取平均值。服药前及服药后出现OH的患者纳入本研究。临床显著OH为站立姿势下的平均动脉压(mean arterial pressure, MAP)≤75mmHg;MAP=(收缩压+2x舒张压)/3[11]。
1.2.3 急性左旋多巴冲击试验急性左旋多巴冲击试验前72h停服多巴胺能受体激动剂,试验前12h停服左旋多巴、复方多巴及其他抗PD药物。予左旋多巴/苄丝肼(美多芭,上海罗氏制药公司)口服,采用阶梯式给药方法,最大剂量200/50mg。采用MDS-UPDRS评价服药前及服药后1h、2h和3h临床改善率,最大改善率%=(服药前评分-服药后最低评分)/服药前评分x100%。
1.2.4 量表测评所有研究对象均进行量表测评,包括运动功能及非运动功能量表。
1.3 统计学处理
应用SPSS 22.0 统计软件进行数据分析。符合正态分布以及方差齐性的计量资料以(x±s)表示,t检验;不符合正态分布计量资料用M(95%CI)表示,秩和检验;计数资料以率表示,χ2检验;各组间和组内血压分析,重复测量方差分析;PD患者伴发OH及SH的相关因素分析采用二元Logistic 回归分析;P<0.05 为差异有统计学意义。

本组共纳入OH-PD患者198 例,平均年龄(62.68±10.17)岁,平均病程(9.28±3.72)年。123 例(62.1%)纳入SH组,75例纳入无SH组。
2.1 2组临床资料比较
2组间年龄、性别、病程、左旋多巴等效剂量无明显差异。与无SH 组相比,SH 组同型半胱氨酸略高(P=0.043),余各项心脑血管病高危因素差异无统计学意义(P>0.05);SH 组MDS-UPDRS III 运动功能总分及姿势步态异常得分更高(P<0.05);SH 组在服药前卧立位试验及急性左旋多巴冲击试验后收缩压下降最大差值较高(P<0.05),但出现临床显著OH的发生率较低(P<0.05);其他指标2 组间差异无统计学意义(P>0.05),见表1、图1。Logistic 回归分析显示,无SH 的
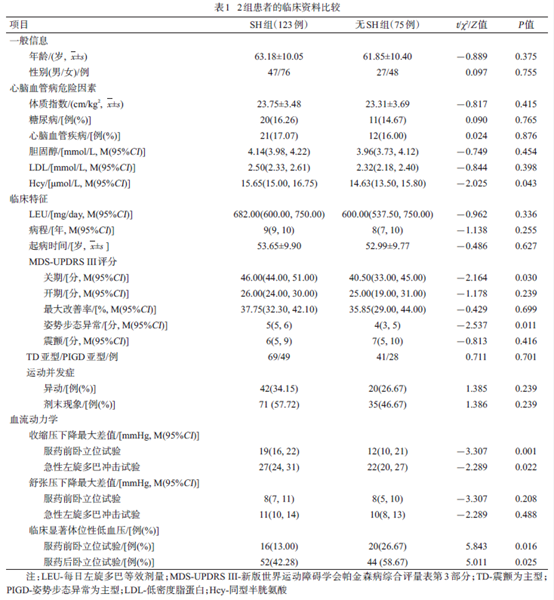
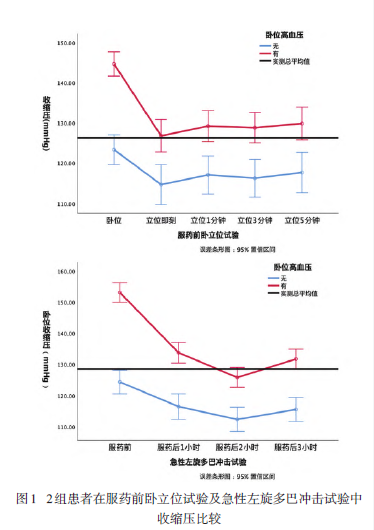
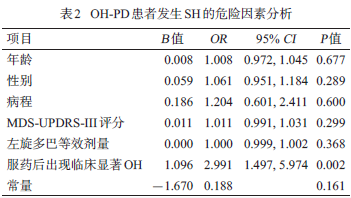

PD-OH 患者出现临床显著OH 的风险是有SH 的PD-OH患者的近3倍(OR=2.991, P=0.002),见表2。
2.2 2组各量表评分比较
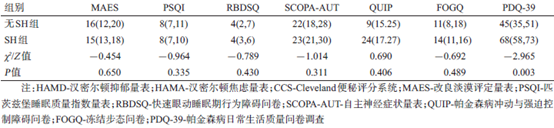
SH组和无SH组间各非运动症状量表评分差异无统计学意义(P>0.05)。虽然SH 组的生活质量评分(PDQ-39)明显高于无SH 组(P<0.05),见表3,但因PDQ-39 与疾病严重程度有关,为去除疾病严重程度等因素对结果的影响,采用一般线性模型对年龄、病程、性别、MDS-UPDRS III(关期)等项目进行校正后,差异无统计学意义(F=1.541,P=0.217)。
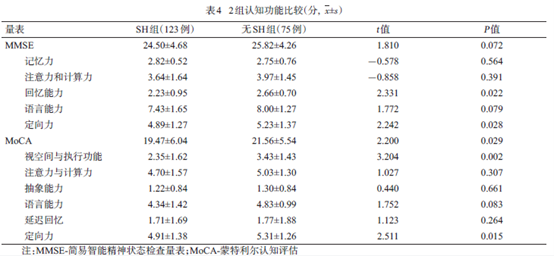
2.3 2组患者的认知功能比较
2组认知功能评分结果显示,SH组的MMSE量表回忆能力子项、定向力子项、MoCA量表总分、视空间与执行功能子项、定向力子项的评分均低于无SH 组(均P<0.05),见表4。
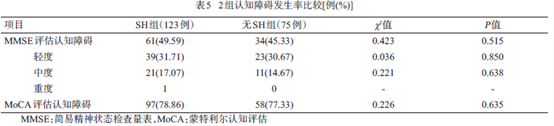
95例(47.98%)PD-OH 患者经过MMSE评估有认知障碍,其中轻度62 例(31.31%)、中度32例(16.16%),重度1例(0.5%)。155例(78.28%)PD-OH
患者经过MoCA量表评估后有认知障碍。各认知障碍及不同程度的认知障碍发生率SH组与无SH组间差异无统计学意义,见表5。
Schmidt 等[12]回顾性研究结果显示48%的PD患者有夜间高血压,尤其是OH患者,但PD 患者同时患有OH 和SH 的发生率尚无明确数据。在本研究中,PD-OH患者中同时存在SH的发生率高达62.1%,填补了这一方面的数据空白,证实同时存在OH和SH这两种相反的自主神经受损症状在PD患者中极为常见,应引起注意。PD患者同时出现OH和SH表明二者可能有共同的机制。研究发现尿钠排泄与肾脏灌注压相关,SH可能唤起压力性钠尿,导致相对的日间低血容量和OH[4]。两者同时发生的另一个可能是共同决定因素,如血管压力感受器受损[13],导致血压变异性增大,血压大幅度波动。
慢性高血压与心脑血管的风险升高有关,如左心
室肥大、充血性心力衰竭、心房颤动和慢性肾衰竭。但我们没有发现PD-OH患者伴有SH明显增加心脑血管风险的证据。与无SH组相比,SH组同型半胱氨酸略高(P=0.043),余各项心脑血管疾病高危因素无明显差异。但基于本研究为横断面研究,应做前瞻性队列研究进一步明确。
此外,我们发现虽然PD 合并OH和SH 的患者在体位性变化时血压下降更显著,但SH却是服用左旋多巴后血压下降出现有临床显著OH的保护因素。这提示适当的SH未明显增加心脑血管疾病风险,且对严重的OH起到一定保护作用。无SH的PD-OH 患者出现
临床显著OH 的风险是有SH 的PD-OH 患者的近3倍。与慢性高血压的长期后遗症不同,OH对PD患者的风险是直接的健康威胁。同时存在OH和SH 的患者中没有显示出高血压治疗的长期益处,PD患者中的SH可能与非PD患者的SH不同,后者是持续的,动脉硬化等可能更普遍[9]。
普遍认为OH可增加PD患者跌倒的风险,其原因包括冻结步态、慌张步态和姿势反射受损等[14]。40%的PD患者出现过跌倒,其中29%由于OH引起的一过性晕厥[15]。在本研究中,SH组的MDS-UPDRS III 运动功能总分及姿势步态异常得分更高,提示对于PD-OH
合并SH的患者,血压下降更为明显,姿势步态障碍更为凸显,需注意防护,且在选择制定降压方案时需更为谨慎。
除了跌倒的直接风险外,较无OH 的PD 患者,PD-OH患者痴呆的风险增加。Kim等[16]在一项针对87例新发PD的研究中,发现14 例痴呆患者,其中10 例伴OH,11 例伴SH;在13 例同时患有OH和SH的患者中,9 例患有痴呆,其余4 例有轻度认知障碍。本研究中,伴有SH 的PD-OH 患者中有39 例(31.71%)为轻度认知障碍,21 例(17.07%)为中度认知障碍,唯一的1 例重度认知障碍患者也在SH 组。但SH 组和无SH 组PD-OH 患者的认知障碍发生率差异无统计学意义。另外,本研究还发现伴有SH 的PD-OH 患者MoCA认知评分显著低于无SH组,尤其是视空间与执行功能、定向力。Anang JB 等[17]发现卧立位血压测试中收缩压下降超过10 mmHg的患者患痴呆症的风险比无OH的PD患者高7 倍。因伴有SH的PD-OH患者收缩压下降值更高,对于伴有SH 的PD-OH 患者对认知功能的影响值得进一步探讨。
综上所述,PD患者中合并OH及SH的发生率高,共同出现提示可能有共同的机制。尚未发现PD-OH伴有SH 较PD-OH 无SH 的患者存在增加心脑血管疾病的证据,且合并SH的PD-OH患者出现临床显著OH的发生率更低,适当的SH在OH中可能起到一定保护作用。PD-OH 伴SH 患者较无SH 的患者姿势异常得分增高,认知功能评分降低,需注意跌倒和痴呆风险。

[1] Fanciulli A, Gobel G, Ndayisaba JP, et al. Supine hypertension in Parkinson's disease and multiple system atrophy[J]. Clin Auton Res, 2016,26: 97-105.
[2] Umehara T, Matsuno H, Toyoda C, et al. Clinical characteristics of supine hypertension in de novo Parkinson disease[J]. Clin Auton Res,2016, 26: 15-21.
[3] Biaggioni I. Orthostatic Hypotension in the Hypertensive Patient[J]. Am J Hypertens, 2018, 31: 1255-1259.
[4] Jordan J, Fanciulli A, Tank J, et al. Management of supine hypertension in patients with neurogenic orthostatic hypotension: scientific statement of the American Autonomic Society, European Federation of Autonomic Societies, and the European Society of Hypertension[J]. J Hypertens, 2019, 37: 1541-1546.
[5] Zhu S, Li H, Xu X, et al. The Pathogenesis and Treatment of Cardiovascular Autonomic Dysfunction in Parkinson’s Disease: What We Know and Where to Go[J]. Aging Dis, 2021, 12: 1675-1692.
[6] Palma JA, Gomez-Esteban JC, Norcliffe-Kaufmann L, et al. Orthostatic hypotension in Parkinson disease: how much you fall or how low you go[J]? Mov Disord, 2015, 30: 639-645.
[7] Sanchez-Ferro A, Benito-Leon J, Gomez-Esteban JC. The management of orthostatic hypotension in Parkinson’s disease[J]. Front Neurol, 2013, 4: 64.
[8] Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson's disease[J]. Mov Disord, 2015, 30: 1591-601.
[9] Espay AJ, LeWitt PA, Hauser RA, et al. Neurogenic orthostatic hypotension and supine hypertension in Parkinson’s disease and related synucleinopathies: prioritisation of treatment targets[J]. Lancet Neurol, 2016, 15: 954-966.
[10] Fanciulli A, Jordan J, Biaggioni I, et al. Consensus statement on the definition of neurogenic supine hypertension in cardiovascular autonomic failure by the American Autonomic Society (AAS) and the European Federation of Autonomic Societies (EFAS) : Endorsed by the European Academy of Neurology (EAN) and the European Society of Hypertension
(ESH)[J]. Clin Auton Res, 2018, 28: 355-362.
[11] Hiorth YH, Pedersen KF, Dalen I, et al. Orthostatic hypotension in Parkinson disease: A 7-year prospective population-based study[J]. Neurology, 2019, 93: e1526-e1534.
[12] Schmidt C, Berg D, Herting, et al. Loss of nocturnal blood pressure fall in various extrapyramidal syndromes[J]. Mov Disord, 2009, 24:2136-2142.
[13] Goldstein DS. Dysautonomia in Parkinson’s disease: neurocardiological abnormalities[J]. Lancet Neurol, 2003, 2: 669-676.
[14] Fasano A, Canning CG, Hausdorff JM, et al. Falls in Parkinson’s disease: A complex and evolving picture[J]. Mov Disord, 2017, 32: 1524-1536.
[15] Fanciulli A, Campese N, Goebel G, et al. Association of transient orthostatic hypotension with falls and syncope in patients with Parkinson disease[J]. Neurology, 2020, 95: e2854-e2865.
[16] Kim JS, Oh YS, Lee KS, et al. Association of cognitive dysfunction with neurocirculatory abnormalities in early Parkinson disease[J]. Neurology, 2012, 79: 1323-1331.
[17] Anang JB, Gagnon JF, Bertrand JA, et al. Predictors of dementia in Parkinson disease: a prospective cohort study[J]. Neurology, 2014, 83: 1253-1260.
查看更多