查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





一般资料:患者男性,45岁,于2020年6月就诊。
主诉:右上腹疼痛伴发热半月。
现病史:乙肝病史20余年,发现肝硬化5年,后服用恩替卡韦治疗。
查体:肝病面容,右肝肋缘下可及肿块,余无明显阳性体征。
肿瘤标记物:AFP>1210ng/ml。
乙肝定性及定量:乙肝表面抗原(HBsAg)、乙肝e抗体(HBeAb)、乙肝核心抗体(HBcAb)阳性;HBV-DNA 2.29×103拷贝数/ml。
生化:Alb 30.6g/L,GPT 193.9U/L,GST 289.83U/L,TBIL正常。
上腹部增强MRI:肝右叶肿块,考虑肝癌伴出血,肝右静脉及门静脉分支受侵可能大,轻度肝硬化,如图1所示。
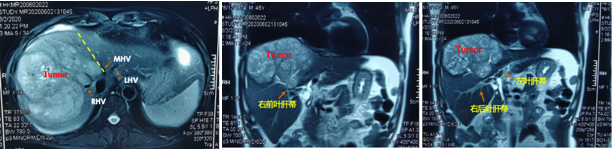
图1:基线期肝脏上腹部增强MRI
诊断:肝右叶恶性肿瘤(BCLC B-C期),乙肝后肝硬化(Child-Pugh A级)。
治疗方案:由于患者肿瘤紧贴肝中静脉(MHV)、包绕肝右静脉(RHV),且左肝偏小,评估肿瘤不可切除。故于2020年6月4日起,开始予患者应用经动脉化疗栓塞 (TACE),每月1次,共3次,方案为奥沙利铂80mg+表柔比星20mg+碘油10ml,术中所见如图2所示。TACE后一周予以患者免疫治疗,方案为替雷利珠单抗200mg ivgtt。

图2:TACE治疗术中所见
影像学及疗效评价:患者分别于2次TACE后及3次TACE治疗后(手术前)复查腹部MRI,在术前腹部增强MRI时见:1、肿瘤完全坏死;2、肿瘤显著缩小;3、肝右静脉显露;4、肝中静脉远离;5、右前叶肝蒂清晰,病灶变化如图3所示。治疗期间AFP、异常凝血酶原变化如图4所示。
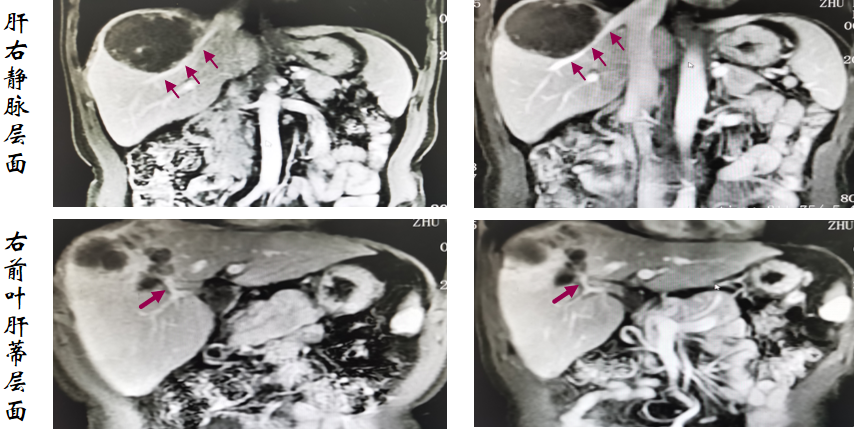
图3:左右分别为2次TACE治疗后及术前影像学变化
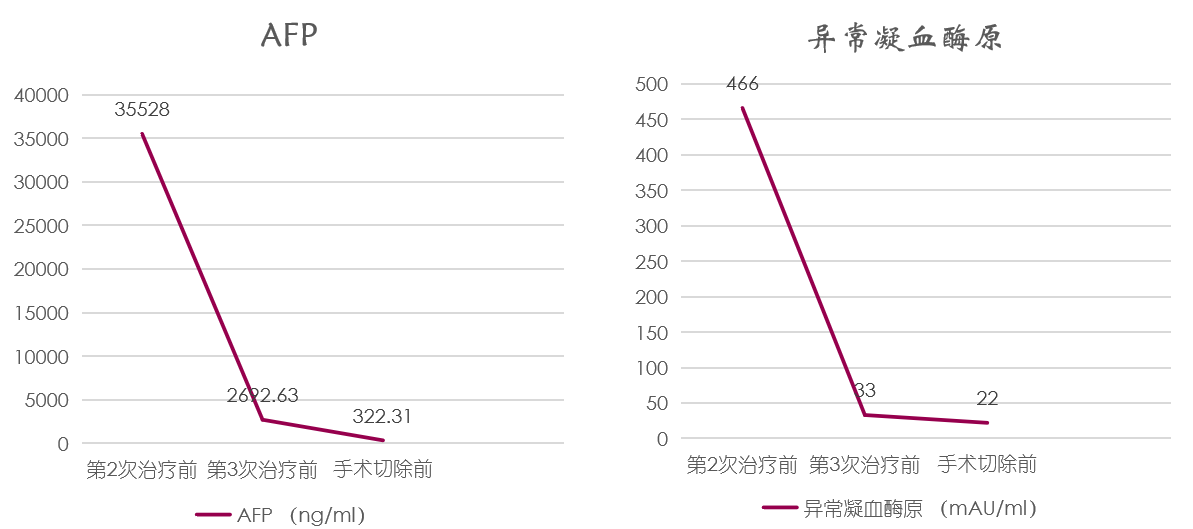
图4:TACE治疗后血液指标变化
安全性评价:患者治疗期间曾间断于TACE治疗后出现发热,体温最高为39℃,对症处理后改善;WBC最低降至2.46×109/L,未予特殊处理。
治疗方案:患者于2020年8月行肝癌手术治疗,术中:1.切除胆囊,鞘内解剖、切断门脉右前支、肝右动脉前支;2.切断肝中静脉(MHV),左侧紧贴MHV切开,显露MHV主干,右侧从右前、右后叶界线切开,肝内靠近肝门处切断右前叶肝蒂,紧贴肝右静脉(RHV)表面切除肿瘤,全程显露RHV主干;3、肝段切除范围5、8、大部7段,R0切除,术中所见如图5所示。
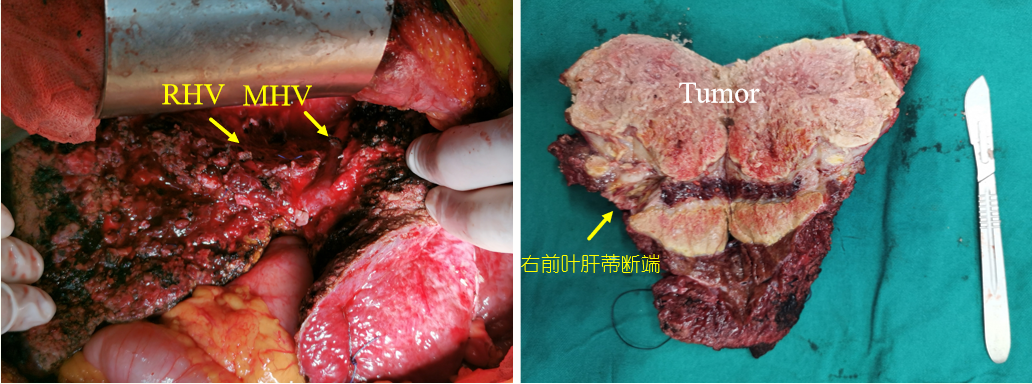
图5:肝癌术中所见
术后病理(2020年8月31日):镜下肿瘤组织全部变性坏死,切缘未见肿瘤累及(肿瘤距最近切缘3mm),如图6所示。
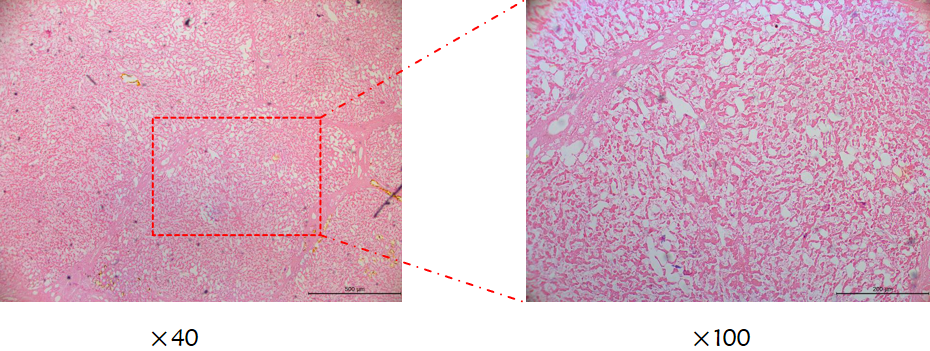
图6(a):术后病理(TACE+PD-1单抗),镜下肿瘤组织完全坏死
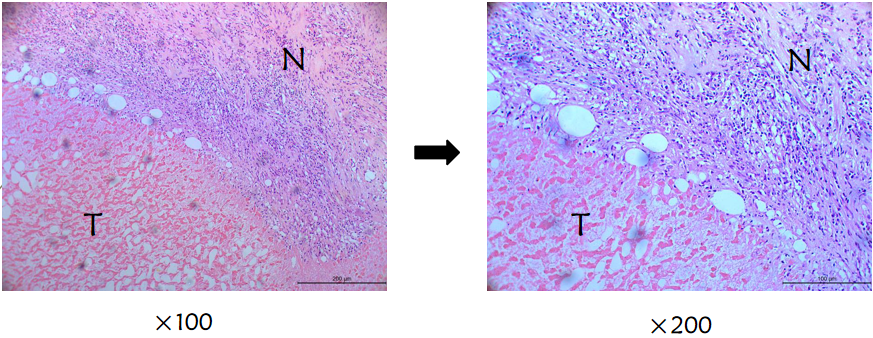
图6(b):术后病理(TACE+PD-1单抗),肿瘤组织完全坏死,细胞结构不可见;交界区见大量淋巴细胞浸润(T:肿瘤组织,N:癌旁组织)
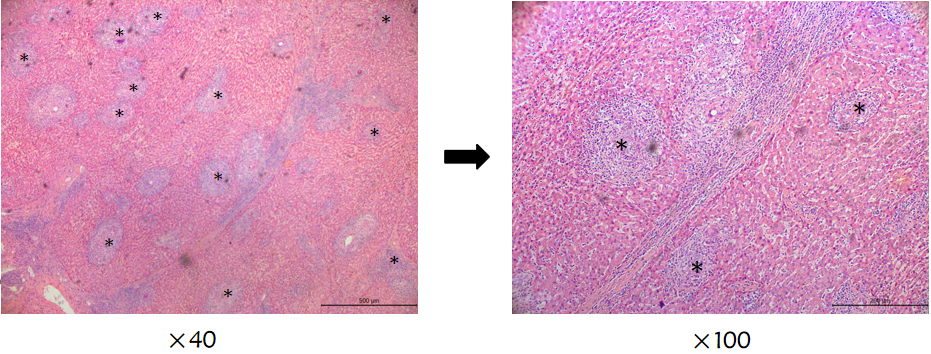
图6(c):术后病理(TACE+PD-1单抗),癌旁组织见多量的非坏死性肉芽肿形成;汇管区见淋巴细胞明显浸润,*为肉芽肿

图6(d):术后病理(TACE),仍可见存活的肿瘤组织,交界区可见淋巴细胞浸润;癌旁组织未见个别肉芽肿(T:肿瘤组织,N:癌旁组织)
患者于术后第6周进行TACE辅助治疗1次,并使用替雷利珠单抗进行免疫治疗,并且每三个月1次进行门诊随访,复查肿瘤标志物见AFP显著降低。
本例患者中年男性,乙肝病史20余年、肝硬化病史5年,以“右上腹疼痛伴发热半月”来诊。结合患者病史及辅助检查结果,明确诊断为肝右叶恶性肿瘤(BCLC B-C期),乙肝后肝硬化(Child-Pugh A级)。
患者上腹部增强MRI结果可见肿瘤紧贴肝中静脉、包绕肝右静脉,左肝偏小,评估肿瘤不适合手术切除根治,根据《原发性肝癌诊疗规范(2019年版)》[1]治疗推荐,在术前予以患者三周期TACE联合替雷利珠单抗的新辅助治疗。治疗后,患者AFP、异常凝血酶原等血液指标均较前明显改善,腹部增强MRI结果显示肿瘤完全坏死、体积显著缩小,评估肿瘤可切除。遂予患者手术切除原发病灶,结合术后病理,考虑病理学完全切除(pCR)。
患者在术后6周时,接受TACE辅助治疗1次,联合替雷利珠单抗免疫治疗。患者每三个月一次进行门诊随访。截至目前,患者复查肿瘤标志物AFP水平明显降低,患者未见复发征象。
原发性肝癌是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁我国人民的生命和健康[1]。肝癌起病隐匿,早期诊断困难,病情进展迅速,大部分患者初诊时即诊断为疾病中晚期,无法行根治性手术治疗。近年来,通过肝癌降期转化治疗的成功尝试,可以使不能手术但具有潜在手术性的患者在接受局部或系统治疗后,控制肿瘤进展、降低临床分期、改善肝功能,从而使手术治疗有了可行性,有助于提高患者预后,改善患者生存。因此,肝癌降期转化治疗也成为当前肝癌临床研究的热点之一[2]。
目前中晚期肝癌的转化治疗主张TACE、靶向治疗、免疫治疗、射频消融、HAIC等多种手段联合使用,其中“靶向+免疫”是经典的治疗选择,但“TACE+免疫”、“TACE+靶向”也是重要的治疗选项,TACE能够使肿瘤部分坏死,肿瘤抗原入血递呈加强,从而使靶向或免疫治疗作用大大加强,两者联合治疗的效果明显要好于二者单独的作用。
替雷利珠单抗是国内自主研发的创新型PD-1抑制剂,其具有与PD-1高亲和力和特异性结合的能力;此外通过基因工程技术对抗体Fc段改造,使其与巨噬细胞FcγR的结合能力最小化,从而防止巨噬细胞通过抗体依赖的细胞吞噬作用清除激活的T细胞, 避免抗PD-1治疗发生耐药[3]。研究显示,替雷利珠单抗单药治疗经治晚期肝癌患者,ORR达12.2%,DCR达56.3%[4]。此外,替雷利珠单抗治疗中国晚期肝癌患者的疗效也可圈可点,2019年CSCO会议上的口头报告指出[5],替雷利珠单抗治疗中国不可手术的晚期HCC患者ORR达17%,DCR为56%,在同类药物中处于领先水平。期待不远的将来,多中心随机对照研究(RCT)能为肝胆外科医生针对不同类型肝胆肿瘤提供更精准的治疗方案、开辟新的治疗途径,攻克中晚期肝癌的治疗瓶颈,为我国肝癌患者带来福音。
参考文献:
[1] 吴孟超, 汤钊猷, 刘允怡,等. 原发性肝癌诊疗规范(2019年版)[J]. 中国实用外科杂志, 2020(2):121-138.
[2] XU JM, et al. New progression and direction of translational medicine on colorectal cancer[J]. Chin J Dig Surg, 2018, 17(4): 357 -361.
[3] Zhang T, Song X, Xu L, et al. The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions[J]. Cancer Immunology, Immunotherapy, 2018.
[4] BGB-A317-001.
[5] 沈琳,2019 CSCO.
中国医学论坛报编辑|金金 整理
查看更多