查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





AML一直是临床治疗的棘手难题,其中诊断时检查出的不良基因突变是造成患者预后较差的重要原因,因此《中国复发难治性急性髓系白血病诊疗指南(2023年版)》表示1:对于此类患者应积极寻找可靶向的突变基因,并选用相应的靶向治疗药物(例如FLT3抑制剂,IDH1抑制剂以及BCL-2抑制剂等)进行治疗。IDH基因突变是AML老年患者中常见的基因突变类型,根据IDH同工酶的不同,IDH1突变可分为三种类型,其中IDH1和IDH2是较为常见的IDH突变类型,IDH1/2基因突变均可导致异柠檬酸脱氢酶对异柠檬酸的亲和力降低,对α酮戊二酸及NADPH的亲和力增强,从而促使α 酮戊二酸还原为2-羟基戊二酸,而高水平的2-羟基戊二酸可竞争性抑制α酮戊二酸依赖酶的活性从而影响细胞代谢、提高DNA/组蛋白的甲基化水平,最终可能通过阻断细胞分化而发挥促进肿瘤发生的作用2。IDH1 突变发生率为 6%-16%3-4,IDH2 突变发生率为 8%-19%3,研究还发现IDH1/2突变的发生随着年龄的增长而提高(图1),老年患者的突变率高达21%(p<0.001)5。
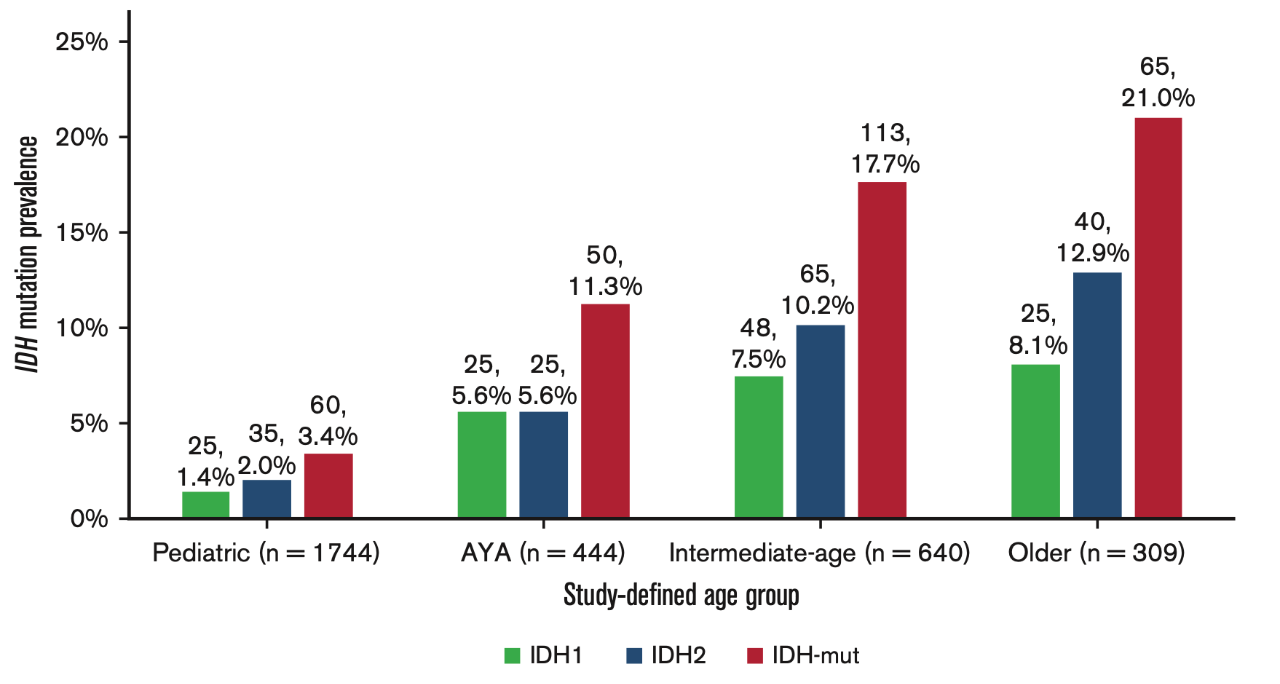
图1 IDH突变在不同年龄段患者的发生率
另外,IDH突变AML患者常合并其他突变类型,一项研究发现47.2%的IDH突变患者出现NPM1共突变,其中53.7%是IDH1突变患者,而DNMT3A(34.4%)和FLT3-ITD(21.8%)也是IDH突变患者常见的共突变类型(图2)5。
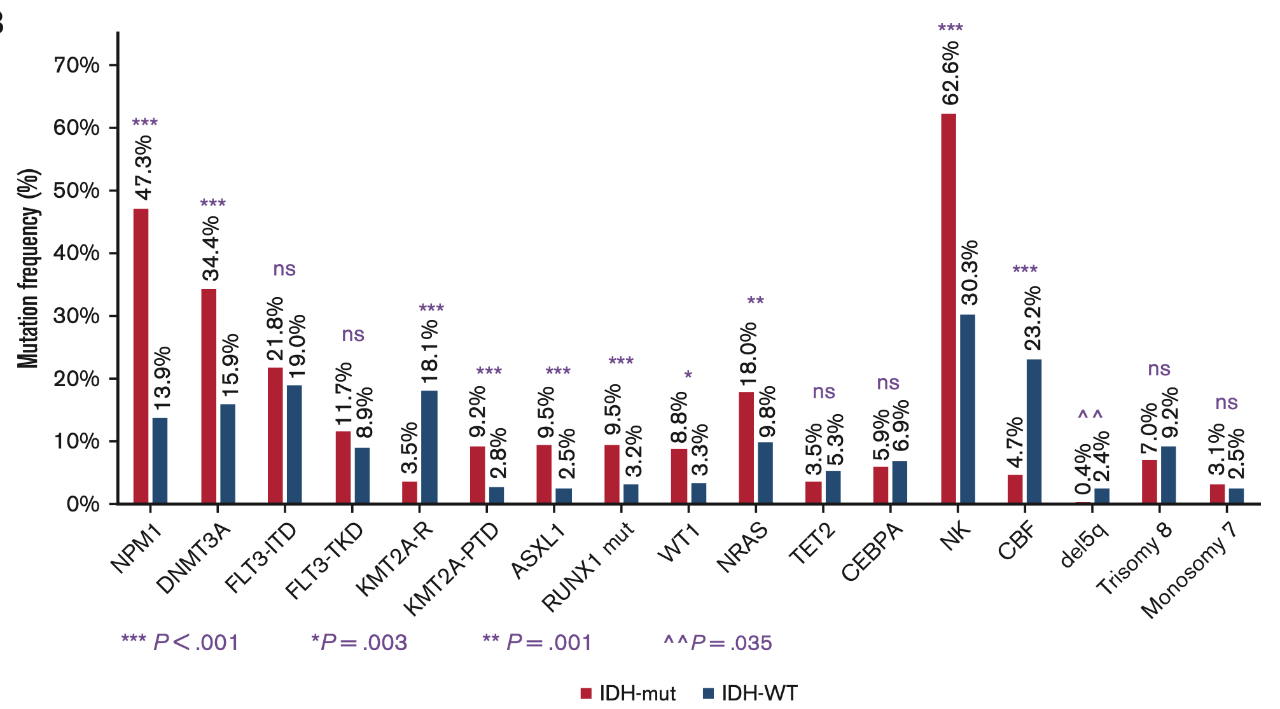
图2 IDH突变患者的共突变发生情况
尽管IDH1/2突变均可促进肿瘤发生,但是有关IDH突变是否可导致患者较差预后的临床证据一直存在争议6-7。
一项纳入3141例患者的META分析表明5 :IDH突变与IDH野生型患者的OS(50.3% vs 55.4%)和EFS(35.6% vs 40%)无显著性差异,但IDH突变患者处于中等风险组的比例显著大于IDH野生型患者(51.6% vs 35.6%)(P<0.001)。
而另一项纳入了33项研究,共12,474例病例的荟萃分析发现8:
如果将IDH1/2共同视作整体的IDH突变,则IDH突变对于患者的OS(HR,1.05;95%CI,0.89-1.23,P=0.4944)和EFS均无显著影响(HR,0.97;95%CI,0.80-1.18,P=0.6393)。
但是亚组分析结果显示:IDH1突变对于患者OS(HR,1.17;95%CI,1.05-1.31,P=0.0047)和EFS(HR,1.29;95%CI,1.07-1.56,P =0.0110)存在显著的负面影响,并且IDH1突变亚组的患者完全缓解率更低(RR, 1.21; 95% CI, 1.02–1.44, P = 0.0289)。而对于IDH2突变患者,研究发现患者OS(HR,0.78;95%CI,0.66–0.93,P = 0.0053)和EFS(HR,0.65;95%CI 0.49–0.86,P = 0.0026)均显著延长。
而2024年新发布的VIALE-A研究结果显示9,在中位时间43.2个月的随访后,维奈克拉(VEN)+阿扎胞苷(AZA)组和安慰剂+AZA组的OS分别为14.7个月和9.6个月,在IDH1突变人群中,OS分别为10.2和2.2个月,在IDH2人群中分别为27.5和13.0个月(图3)。
这些研究数据表明IDH突变不同亚组对于患者的预后影响存在明显差异,组合分析不利于体现不同IDH突变对于患者预后价值,而亚组分析结果表明IDH1突变对于患者生存存在显著负面影响,而IDH2突变则对于患者长期生存更加有利。
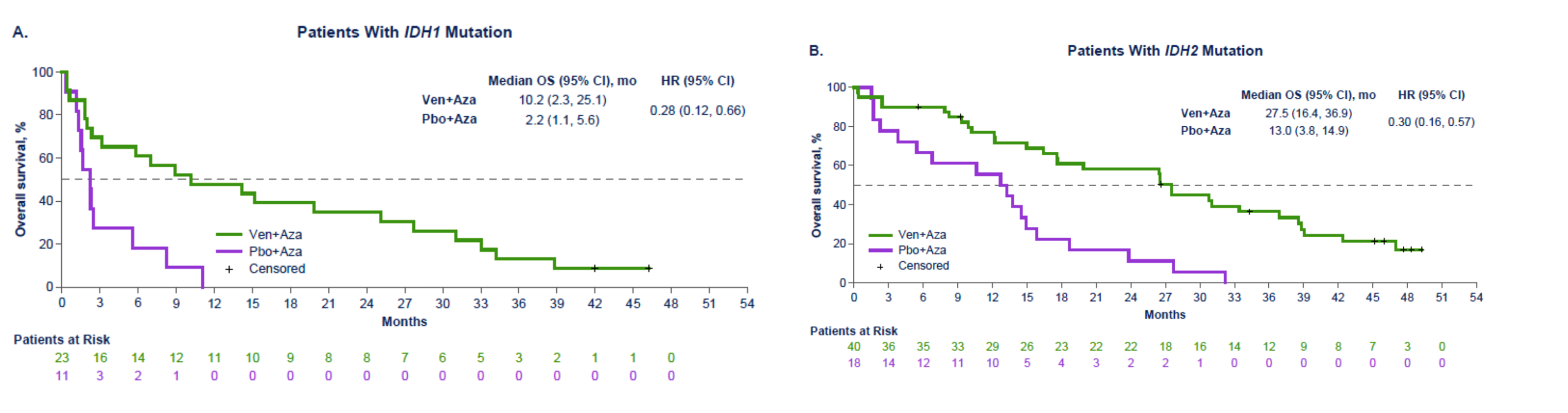
图3 IDH1和IDH2患者的生存情况
在IDH1抑制剂问世之前,BCL-2抑制剂VEN和去甲基化药物是IDH1突变患者重要的治疗选择。VIALE-A研究结果证明VEN联合去甲基化药物AZA可以为IDH1突变患者提供一定的生存获益,但是患者希望进一步延长生存的需求仍未满足。
鉴于IDH1突变对于AML患者预后存在明确的负面影响,靶向药物IDH1抑制剂成为了IDH1突变AML患者重要的治疗选择。2022年,中国国家药品监督管理局(NMPA)批准了IDH1抑制剂艾伏尼布(IVO)的新药上市申请,至此,IVO成为国内目前唯一可及的IDH1抑制剂,填补了相关领域的治疗空白。在单药治疗方面,AG120-C-001研究结果表明,IDH1抑制剂IVO单药治疗IDH1突变AML患者完全缓解/完全缓解伴不完全血液学恢复率(CR/CRh)可达31.8%,在21%CR/CRh患者中IDH1突变得到清除10-11。
另一项IVO关键中国桥接研究发现12:在30例可评估IDH1突变复发难治AML患者中,CR+CRh率为36.7%,11例患者均达到CR。预估6个月CR+CRh的持续缓解率为90.9%,2例(6.7%)患者在达到CR或CRh后接受造血干细胞移植。患者总体中位无事件生存期(EFS)为5.5个月,中位OS为9.1个月。
前期机制研究表明,IVO作为IDH1抑制剂可诱导细胞分化从而实现白血病的治疗,与现有直接杀伤肿瘤细胞的治疗方法机制不同,因此IVO联合治疗成为研究者积极探索的方向。IVO的关键AGILE研究显示14,在接受IVO联合AZA治疗后,患者中位OS高达29.3个月,显著高于安慰剂+AZA治疗组的7.9个月(P<0.0001)。
另一项研究13发现使用IVO联合方案治疗新诊断(ND)的IDH1突变AML患者复合缓解率(CRc)可达93%,总体缓解率(ORR)100%,≥5个治疗周期的应答者IDH1突变清除率为71%。ND AML患者总体中位无事件生存期(EFS)为36个月,12和24个月OS率分别为79%和67%(图4)。对于R/R AML患者,此方案CRc和ORR可达63%和75%,≥5个治疗周期的应答者IDH1突变清除率为50%。中位EFS为6个月,中位OS为9个月(图4)。除此之外,研究还发现对于接受IVO 500 mg + VEN 400 mg + AZA 75 mg/m2三药联合治疗患者ORR高达100%,CRc可达85%。这些研究结果证明,IVO联合治疗可以为IDH1突变AML患者提供显著的疾病缓解和生存获益,是未来值得探索的研究方向。
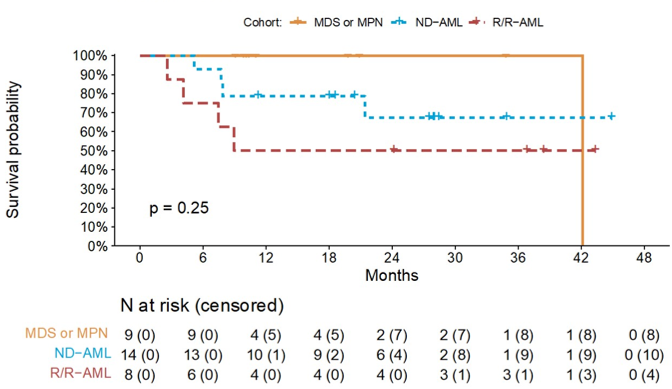
图4 ND 和R/R AML患者生存情况
近年来有关IDH突变对于AML患者预后的影响一直存在争议,但是IDH亚组分析表明,IDH1/2突变对于患者预后存在截然相反的影响,其中IDH1突变显著影响患者生存,而IDH2突变则对于患者生存更加有利。目前国内唯一上市IDH1抑制剂IVO可有效清除IDH1突变,延长生存,并且IVO联合VEN,以及AZA等治疗探索也展现出积极成果,表明IVO联合治疗可以为IDH1突变AML患者提供更多生存获益,是未来具有临床价值的探索方向。

宋献民 教授
主任医师,博士生导师
上海交通大学附属第一人民医院血液科主任
上海市医师协会血液专业分会会长
中华医学会血液学分会造血干细胞移植学组委员
中华医学会血液学分会实验诊断学组委员
上海免疫学会血液免疫专委会副主任委员
国家重点研发计划(干细胞与转化重点专项) 首席专家
上海造血干细胞移植联盟(ASCT-SH) 候任主席
学术方向:造血干细胞移植
参考文献
1.中华医学会血液学分会白血病淋巴瘤学组. 中华血液学杂志, 2023,44(9) : 713-716.
2.Yang, Hui et al. Clinical cancer research : an official journal of the American Association for Cancer Research vol. 18,20 (2012): 5562-71. doi:10.1158/1078-0432.CCR-12-1773;
3.DiNardo, Courtney D et al. American journal of hematologyvol. 90,8 (2015): 732-6. doi:10.1002/ajh.24072;
4.Marcucci, Guido et al. Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 28,14 (2010): 2348-55.doi:10.1200/JCO.2009.27.3730;
5.Zarnegar-Lumley, Sara et al. Blood Adv. 2023 Oct 10;7(19):5941-5953.
6.Boissel, Nicolas et al. Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 28,23 (2010): 3717-23. doi:10.1200/JCO.2010.28.2285;
7.Green, Claire L et al. Blood vol. 116,15 (2010): 2779-82. doi:10.1182/blood-2010-02-270926;
8.Xu, Qingyu et al. Clinical cancer research : an official journal of the American Association for Cancer Research vol. 23,15 (2017): 4511-4522. doi:10.1158/1078-0432.CCR-16-2628;
9.Pratz, Keith W et al. American journal of hematology vol. 99,4 (2024): 615-624. doi:10.1002/ajh.27246.
10.Pollyea DA, et al. Oral on ASCO 2018. Abstract 7000.
11.DiNardo CD, et al. N Engl J Med. 2018 Jun 21;378(25):2386-2398.
12.Sun M, et al. Blood Sci. 2024 Jun 20;6(3):e00196.
13.Lachowiez, Curtis A et al. Blood cancer discovery vol. 4,4 (2023): 276-293. doi:10.1158/2643-3230.BCD-22-0205;
14.De Botton, et al. 2023 ASCO ABSTRACT #7012.
M-TIBSO-CN-202409-00002
查看更多