查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





周玉超 综述 李世军 审校
DOI:10.3969/j.issn.1006-298X.2024.03.014
[基金项目]江苏省肾脏病医学创新中心项目(CXZX202202)
[作者单位]东部战区总医院 国家肾脏疾病临床医学研究中心(南京,210016)
摘 要
肝肾综合征(HRS)是一种有独特病理生理机制的肝硬化相关肾损害,其中,肝肾综合征相关急性肾损伤(HRS-AKI)是需要重点关注的亚型。除经典的血流动力学紊乱外,HRS-AKI的发病机制还涉及肠道细菌移位、系统性炎症、肾脏微循环障碍、肝硬化心肌病等。早期诊断和治疗可改善HRS-AKI预后,人血白蛋白联合特利加压素是目前广泛推荐的一线治疗,而肝移植是唯一的根治手段。本文就HRS-AKI新定义、诊断及分期标准、发病机制和诊治进展作一综述。
关键词 晚期肝硬化 肝肾综合征 急性肾损伤 人血白蛋白 特利加压素
acute kidney injury
ZHOU Yuchao, LI Shijun
National Clinical Research Center for Kidney Diseases, Jinling Hospital, Nanjing 210016, China
ABSTRACT
Hepatorenal syndrome (HRS) is a type of cirrhosis-related renal damage with a unique pathophysiological mechanism. HRS-AKI is the subtype that needs special attention. In addition to the classical mechanisms of hemodynamic disorders, the occurrence of HRS-AKI also involves a variety of pathophysiological mechanisms such as intestinal bacterial translocation, systemic inflammation, renal microcirculation disorders and cirrhotic cardiomyopathy and so on. Early diagnosis and treatment can improve the poor prognosis of HRS-AKI. Albumin plus terlipressin is a widely recommended first-line treatment,nevertheless liver transplantation is the only definitive treatment for HRS. This article reviews the new definition, diagnostic and grading criteria, pathogenesis, and treatment of HRS-AKI.
Key words advanced cirrhosis hepatorenal syndrome acute kidney injury human albumin terlipressin
急性肾损伤(AKI)是肝硬化的常见并发症,影响着患者死亡率及肝移植后慢性肾脏病(CKD)的发病率。肝硬化可通过多种机制导致AKI,如低血容量、急性肾小管坏死(ATN)、肾小球肾炎等,肝肾综合征(HRS)是其中一种具有独特发病机制的类型。基于新的研究进展,HRS的诊断和分型标准得到更新,其中HRS相关AKI(HRS-AKI)的定义旨在加强HRS的早期诊断和干预,以改善其预后。本文拟介绍HRS-AKI的新定义、诊断及分期标准、发病机制及治疗的最新进展。
1996年,国际腹水俱乐部(ICA)提出HRS是发生于晚期肝硬化及门静脉高压(PHT)患者的一组临床综合征,其特点为内源性血管活性系统激活相关的血流动力学异常及肾功能损害[1]。HRS通常分为两型:1型HRS多表现为短期内迅速进展的急性肾衰竭,诊断标准为2周内血清肌酐(SCr)翻倍并≥2.5 mg/dL,预后极差;2型HRS进展相对缓慢,多表现为难治性腹水。早期诊断和治疗是改善HRS预后的关键,随机对照(RCT)研究表明HRS疗效与确诊和启动治疗时SCr水平呈负相关[2]。为了使HRS患者得到更及时的诊断和治疗,2015年ICA参考改善全球肾脏病预后组织(KDIGO)-AKI概念及分期,更新了HRS的分型、分期标准(表1)。基于肾功能异常是否符合AKI分别定义为HRS-AKI(即原1型HRS)和肝肾综合征-非急性肾损伤(HRS-NAKI,即原2型HRS,包括HRS相关急性肾脏病和HRS-CKD)[3]。欧洲肝脏研究协会(EASL)遵循新的《HRS-AKI诊断标准》,提出了一套肝硬化合并AKI的诊疗方案。前瞻性验证研究表明,该方案可获得非常好的应答率,不会延误HRS-AKI治疗的启动时机[4]。但截至目前,基于HRS-AKI新定义的研究报道仍较少。
HRS:肝肾综合征;HRS-AKI:肝肾综合征相关急性肾损伤;HRS-AKD:肝肾综合征相关急性肾脏病;HRS-CKD:肝肾综合征相关慢性肾脏病;SCr:血清肌酐;eGFR:估算的肾小球滤过率;RBC:红细胞计数;HPF:高倍镜视野;*SCr基线值:如果无法获得7 d前的SCr,可将3月内的SCr作为基线
新的《HRS-AKI诊断标准》摒弃了“2周内SCr翻倍并≥2.5 mg/dL”的要求,重点关注SCr较基线值的变化,有利于早期发现AKI。但以SCr作为唯一的标志物仍存在诸多不足,特别是SCr对于发现AKI存在一定滞后性,可能错过逆转HRS-AKI的重要窗口期。寻找更理想的标志物仍是亟待解决的问题。尿量减少对于HRS-AKI具有诊断和预后判断价值,一项危重慢性肝病患者中的研究发现,如将少尿纳入HRS-AKI诊断标准,则其诊断率明显提高,以尿量标准诊断为AKI 3期的患者病死率最高[5]。2019年,ICA的2名肝病学家和2名肾病学家建议将“尿量≤0.5 mL/(kg·h),持续≥6h”纳入HRS-AKI的诊断标准[6],但尿量受到利尿剂等因素的影响,目前尚未将其纳入HRS-AKI诊断和分期标准。血浆胱抑素C能预测因肝硬化并发症住院患者发生AKI、HRS和死亡率,可作为早期识别肾脏事件和死亡高危患者的良好标志物[7]。有研究者运用电子病历系统和机器学习建立AKI预测模型,可提前48 h预测AKI的发生[8]。Tian等[9]运用机器学习对MIMIC数据库进行分析,建立了肝硬化患者AKI的多种预测模型,其中XGB模型预测效能最佳(AUC 0.832),但该模型并非针对HRS-AKI。信息化和大数据对于预测HRS-AKI具有潜在价值,能否将其应用于临床改善HRS-AKI患者的预后还有待新的前瞻性研究。
晚期肝硬化患者还因多种机制导致AKI,如低血容量、ATN、肾小球肾炎等。不同类型AKI的治疗及预后不同,必须加以鉴别。其中HRS-AKI与ATN的鉴别尤为重要。尿液中性粒细胞明胶酶相关脂质运载蛋白、肾损伤分子1、肝脂肪酸结合蛋白和白细胞介素18等新型尿液标志物对于鉴别ATN与HRS-AKI具有较高的准确率,在ATN时上述标志物较HRS-AKI时升高更为明显[10]。
HRS-AKI的发生主要与晚期肝硬化、PHT继发的循环紊乱有关。全身炎症状态在HRS-AKI中也发挥着重要作用[11](图1)[12]。
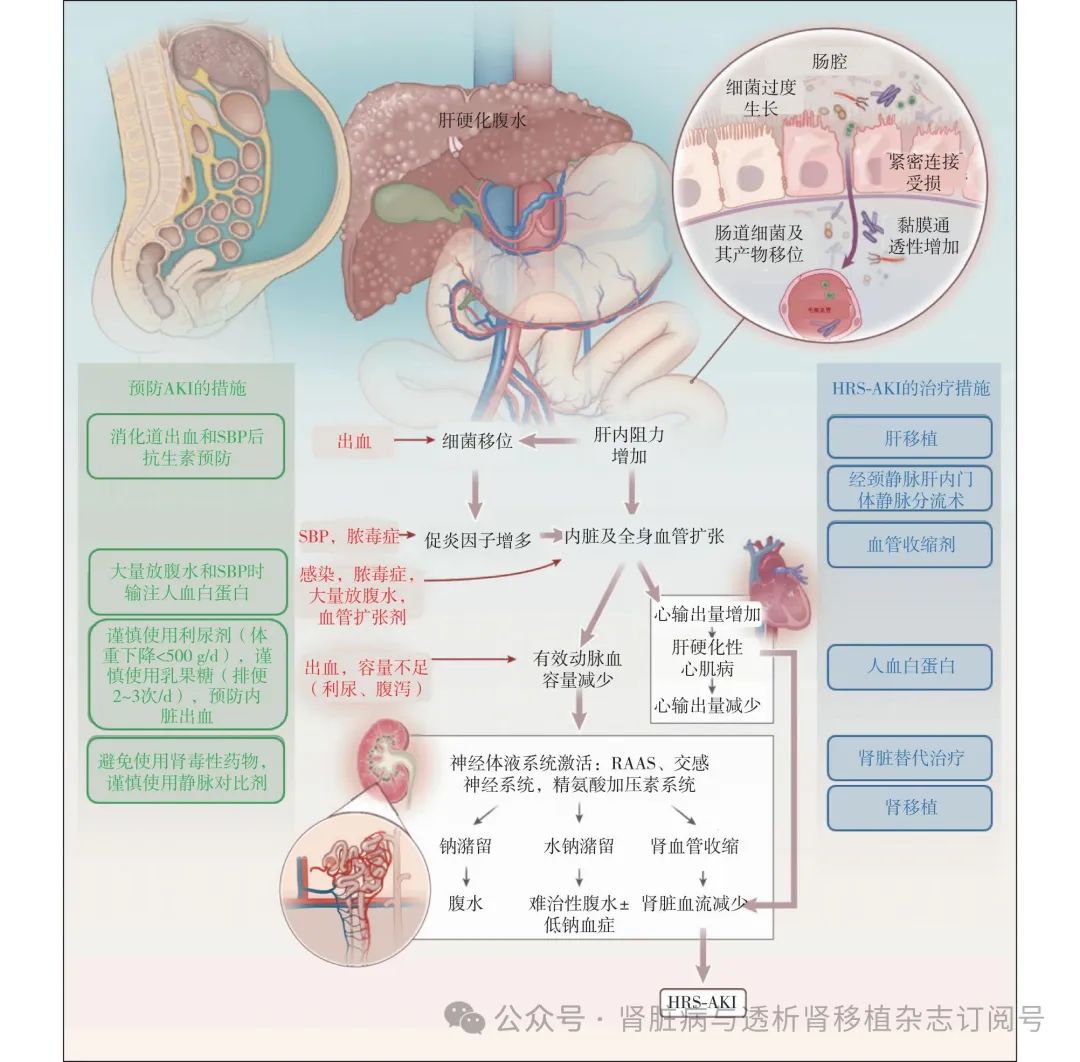
图1 HRS-AKI发病机制和干预[12]
AKI:急性肾损伤;SBP:自发性腹膜炎;HRS-AKI:肝肾综合征相关急性肾损伤;RAAS:肾素-血管紧张素-醛固酮系统
循环功能障碍 PHT导致内脏血管床剪切应力增加产生强效血管扩张因子(一氧化氮、前列腺素等)。血管扩张导致有效动脉血量(EABV)减少,血管阻力降低,动脉充盈不足出现低血压。激活交感神经系统、肾素-血管紧张素-醛固酮系统(RAAS)及血管加压素,导致水钠潴留、自由水排泄障碍、肾血管收缩、肾小球滤过度(GFR)下降。
肠道微生物移位 肝硬化患者发生PHT时肠道黏膜屏障功能受损,肠道菌群失调,肠道细菌及其产物(包括细菌DNA、内毒素等)突破肠道黏膜防御机制,刺激肝脏Kupffer 细胞产生炎症因子。这些炎症因子进入外周循环进一步刺激白细胞释放更多炎症因子和各种血管活性物质,对循环功能障碍产生进一步影响。
系统性炎症 肠道细菌移位产生的病原相关分子模式(PAMPs)以及组织细胞损伤释放出的损伤相关分子模式(DAMPs)激活模式识别受体(PRR),诱发免疫炎症反应,使得肝硬化患者持续处于系统性炎症状态。Toll样受体(TLR)是最重要的一组PRR,其中TLR4在肝损伤后免疫反应的启动过程中发挥着关键作用[13]。
肾脏炎症和微循环障碍 HRS-AKI肾脏炎症的机制与脓毒症诱发肾衰竭的机制相似。DAMPs 和 PAMPs与肾小管上皮细胞的受体(如 TLR4)结合后,产生炎症因子、活性氧从而放大炎症信号。肾脏炎症反应失调导致肾小管代谢下调、线粒体损伤和肾小管上皮细胞周期停滞,损伤肾小管[14]。甲襞视频毛细血管镜观察功能性毛细血管密度(FCD)及红细胞加速(RBCA) 可反映微循环状态。晚期肝硬化患者随着Child-Pugh分级加重,FCD、RBCA下降,提示微循环状态随着肝功能恶化而恶化[15]。上述肾脏炎症和微循环障碍进一步促进HRS-AKI发生。
肝硬化心肌病 肝硬化心肌病是指无其他已知心脏疾病的肝硬化患者出现心脏收缩、舒张功能障碍和伴QT间期延长的电机械耦合异常[16]。肝硬化时机体通过增加心输出量来代偿循环功能障碍,形成高动力循环,肝硬化心肌病使心脏应激反应异常,难以维持代偿性高动力循环,间接导致了HRS的发生。
其他机制 (1)肝肾反射有研究发现,人为阻断经颈静脉肝内门体静脉分流(TIPS),使门静脉压力急剧升高,可使肾血流量急剧减少。这种肝肾直接交互作用涉及肝脏内的渗透压感受器、化学感受器。它们能感知特定的刺激,并通过神经回路做出反应直接影响肾脏[17]。(2)腹内高压(IAH):肝硬化患者常合并难治性腹水和IAH。肝硬化小鼠模型中观察到,腹腔内压升高超过10 mmHg的小鼠SCr升高,肾脏病理显示肾小管管腔收缩、肾间质炎症细胞浸润及充血[18]。引流腹水降低腹腔内压可使肾动脉阻力指数显著下降,肌酐清除率和尿量显著增加[19]。(3)胆汁管型肾病:胆汁淤积时,部分胆汁酸和胆红素由肾脏排出。胆汁酸可导致肾小管阻塞,或通过炎症反应、氧化应激和血流动力学紊乱等机制造成肾损伤,病理可见肾小管上皮损伤和胆汁管型形成[20]。(4)肾上腺功能不全:24%~47%的失代偿期肝硬化腹水患者存在相对性肾上腺功能不全,也被称为肝肾上腺综合征。此类患者平均动脉压更低,血浆肾素活性、去甲肾上腺素浓度更高,HRS-AKI发生率和死亡率更高[21]。
一般性治疗 必须严格戒酒,鼓励患者摄入适量蛋白质以避免营养不良,蛋白质摄入量应根据每例患者的需求、合并症、是否存在肝性脑病及肾功能等情况而定。详细询问用药情况,以排除非甾体类抗炎药或其他肾毒性药物。暂停利尿剂、非选择性β受体阻滞剂和RAAS 抑制剂。对于容量超负荷患者应严格限制水钠摄入,无明显容量超负荷的患者应尝试给予精准的容量复苏(首选人血白蛋白,次选晶体液),如评估认为IAH和肾静脉充血是主要致病环节,可行腹腔穿刺或使用利尿剂。在床旁超声(POCUS)指导下制定容量管理策略有助于改善疗效[22]。如高度怀疑感染,尤其自发性腹膜炎,应行影像学检查、腹腔穿刺、血液、尿液及腹水培养,尽早使用抗生素治疗。
药物治疗 通常包括扩充血浆量和收缩内脏血管以逆转血流动力学异常。数十年来,人血白蛋白普遍用于肝硬化患者的扩容治疗。除具有扩容作用外,人血白蛋白还有重要的抗氧化和抗炎特性,有助于稳定血管内皮功能。人血白蛋白还能与内毒素结合,减少其对循环和肾功能的负面影响[23]。然而,人血白蛋白的临床试验结果却相互矛盾。ANSWER研究中,对于肝硬化腹水患者,在标准治疗基础上补充人血白蛋白可降低总死亡率及肝脏相关死亡率,同时降低感染、肾功能损害(包括HRS)、肝性脑病、电解质紊乱等并发症的发生率[24]。而在 MACHT研究中,米多君联合人血白蛋白未能降低肝硬化并发症(包括肾损害)的发生率[25]。ATTIRE研究中,相较于标准治疗组,通过补充更多人血白蛋白将血清人血白蛋白水平维持在>30 g/L未能降低肾功能不全的发生率,反而导致肺水肿发生率升高[26]。特利加压素是赖氨酸加压素衍生物,对血管加压素V1受体的选择性更高。特利加压素收缩内脏血管,降低门静脉血流量和压力,并使潴留在内脏血管床的血液回到体循环增加EABV,进而改善平均动脉压和肾脏灌注,逆转HRS。近期发表的系统综述显示,特利加压素在HRS逆转方面比其他血管活性药物更有效,并改善短期生存率[27]。特利加压素在欧洲和世界各地作为HRS的标准治疗[28],EASL推荐人血白蛋白联合特利加压素作为HRS-AKI的一线治疗。在北美进行的OT-0401、REVERSE 和 CONFIRM三项随机对照试验显示,特利加压素有利于逆转 HRS、缩短重症监护室住院时间和减少肾脏替代治疗。2022年美国食品与药物管理局(FDA)根据 CONFIRM 试验的结果,批准了特利加压素用于治疗成人 HRS-AKI[2,29]。CONFIRM研究中特利加压素最常见的不良反应包括腹痛(19.5%)、恶心(16%)、呼吸衰竭(15.5%)、腹泻(13%)和呼吸困难(12.5%)。鉴于CONFIRM研究中观察到呼吸衰竭高发,FDA发布了严重或致命呼吸衰竭的黑框警告。谨慎选择特利加压素的治疗对象至关重要,心肌或肠道缺血患者应禁用特利加压素,肝移植优先级高的患者[终末期肝病模型(MELD)≥35)],特利加压素的风险很可能大于获益,且特利加压素相关的不良反应可能导致患者失去肝移植机会。此外,SCr>5 mg/dL 的患者不太可能从特利加压素中获益,慢加急性肝衰竭(ACLF)3级的患者呼吸衰竭的风险很大,不推荐特利加压素治疗[30]。
手术 手术治疗包括TIPS和肝移植。TIPS有效降低门静脉压力,但可能加重肝脏缺血诱发肝衰竭,对于残余肝功能较好的患者,TIPS可改善预后[31]。肝移植是目前HRS-AKI唯一的根治方法,肝移植后肾脏恢复率可达76%,1年生存率为97%[32]。
器官支持 主要包括人工肝支持系统和肾脏替代治疗。RELIEF研究发现分子吸附再循环系统(MARS)虽能降低SCr、胆红素水平,改善肝性脑病,但未能改善28 d存活率[33]。对于缩血管药物治疗无应答的1型HRS患者,肾脏替代治疗不能改善30 d及180 d存活率[34]。
新兴疗法 重组人松弛素2 (serelaxin)是一种新型的肾血管舒张剂,可降低肾血管阻力,增加肾血流量,逆转内皮功能障碍。肝硬化动物模型研究发现serelaxin能降低肝内血管阻力,改善门静脉高压。一项探索性Ⅱ期随机临床试验发现,代偿期肝硬化患者使用serelaxin治疗后,肾动脉总血流量增加了65%[35]。但目前尚未见其在HRS-AKI患者中的研究报告。
小结:HRS新的定义、诊断和分型分期标准突出了对HRS-AKI进行更早诊断和干预的期望,还需要进一步的研究来验证生物标志物、临床预警系统等的临床应用价值。人血白蛋白联合血管收缩剂仍是目前最受推荐的HRS-AKI的治疗方案,特利加压素和去甲肾上腺素优于米多君/奥曲肽联合,关于人血白蛋白的剂量仍存在争议。肝移植是目前HRS-AKI唯一的根治方法,新的治疗药物仍有待开发。
参考文献


来源:肾脏病与透析肾移植杂志订阅号
查看更多