查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





实现乙肝表面抗原(HBsAg)血清学阴转或血清学转换是慢性乙型肝炎(CHB)治疗的理想终点,但目前已批准的抗乙型肝炎病毒(HBV)药物却很少能达到这一目标。近日,厦门大学夏宁邵教授团队开发了一种基于B细胞表位的新型治疗“疫苗”(CR-T3-SEQ13),这种颗粒蛋白可通过诱导HBV耐受小鼠体液免疫反应,进而有效清除HBsAg,同时研究人员在多种体内外模型中证实了CR-T3-SEQ13对HBV感染的治疗潜力,为研发乙肝原创药物提供了新思路。论文3月29日在线发表于《消化道》(Gut)杂志。

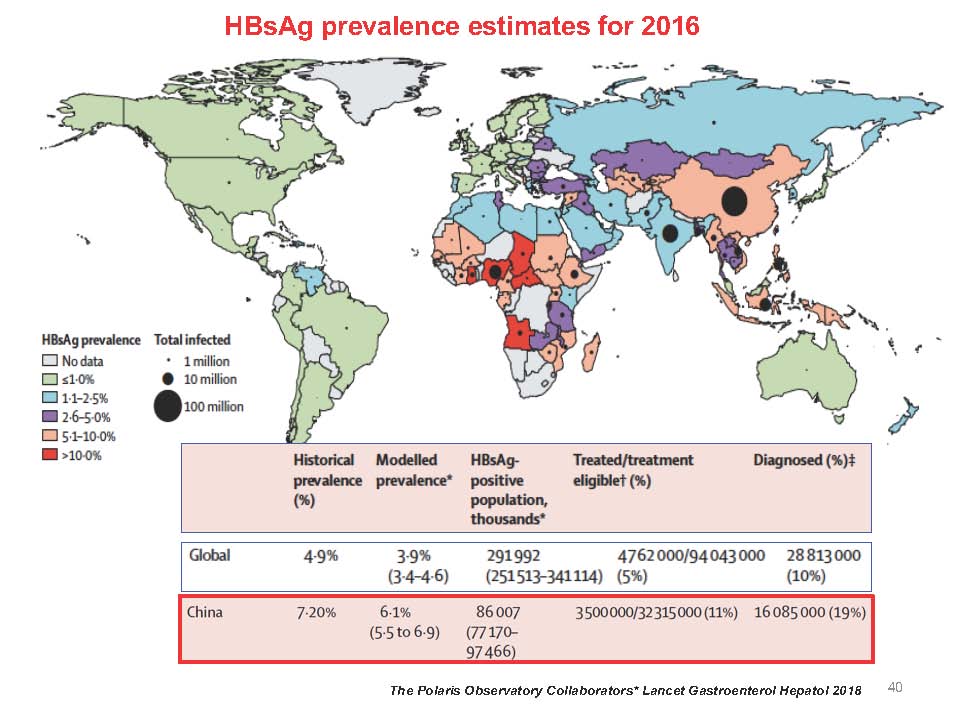
目前,全球乙肝防控形势依然严峻,尽管乙肝疫苗显著减少了HBV新发感染,但目前全球仍有约2.5亿慢性HBV感染者,若未及时得到有效治疗。我国乙肝诊断率和治疗率也不是很乐观,约8600万的慢性乙肝感染者中,只有1600万例得到了诊断,在适合治疗的3200万例患者中,只有350万例接受了治疗。
慢性乙肝患者体内高水平的HBsAg是导致免疫耐受的重要原因,通过有效抑制HBsAg并持续一定的时间,有望重建HBsAg特异的B细胞和T细胞应答,进而提高临床治愈率。目前,大多数乙肝治疗性疫苗是基于诱导体内T细胞免疫应答发挥作用,但是缺乏有效清楚病毒的抗体反应,因此临床疗效有限。夏宁邵教授团队在前期研究中发现,抗体除具备经典的病毒中和作用以外,还能通过Fc介导的调理作用高效清除体内的HBsAg,同时研究人员还确定了识别非免疫优势sA表位的E6F6抗体在动物体内具有持久有效的HBsAg清除功能。
本研究中,研究人员基于蹄蝠HBV核心抗原(HBcAg)提取出一种新型具有免疫增强作用的载体CR-T3,该载体可在免疫耐受个体中诱导体液或细胞免疫反应。将sA表位[HBsAg-aa113-135(SEQ13)]转移至CR-T3载体上,获得CR-T3-SEQ13候选治疗性疫苗分子。
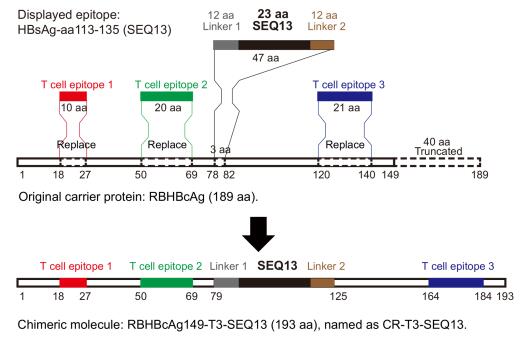
CR-T3-SEQ13可在多种HBV耐受动物模型中刺激机体产生识别sA表位的类E6F6抗体,进而有效降低各模型小鼠体内HBsAg、HBV DNA水平;在非人灵长类动物模型中,CR-T3-SEQ13能诱导食蟹猴产生高滴度的sA表位抗体,其免疫后多抗血清通过被动免疫可有效清除HBV耐受小鼠体内的病毒。目前,该团队正在积极推进CR-T3-SEQ13乙肝治疗性疫苗向临床转化。
查看更多