查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:郑州市中心医院卒中中心 张昊晗 贾新州
【摘要】
背景和目的:静脉注射阿替普酶 (rt-PA) 会增加急性缺血性卒中出血性转化的风险。我们研究的目的是评估预测 rt-PA 治疗后出血性转化风险的临床、实验室和影像学预测因素。我们还评估了与脑微出血相关的增加出血性转化风险的因素。
方法:2009 年 1 月 1 日至 2013 年 12 月 31 日期间入院的连续急性缺血性卒中患者如果接受静脉注射 rt-PA、入院时进行了脑部MRI(DWI)、GRE和FLAIR,则纳入研究。在 24 小时后(18~36 h) 行MR或CT以评估是否存在出血性转化。回顾性分析临床数据、血脂水平、血小板计数、MRI 和CT。
结果:该研究包括 366 名患者,平均年龄 67 ± 15 岁;女性占46%,白人占88%。美国国立卫生研究院卒中量表 (NIHSS) 的中位数为 6(四分位距为 3~15)。在 87 名 (23.8%) 患者中观察到出血转化,在 95 名 (25.9%) 中发现脑微出血。出血性转化患者往往年龄较大、非白种人、有房颤、基线 NIHSS 评分较高、胆固醇和甘油三酯水平较低、脑微出血和有非腔隙性梗死。脑微出血患者更可能年龄较大、患有高血压、高脂血症、既往有中风病史,并且既往使用过抗血栓药物。在多变量分析中,种族、NIHSS 评分、非腔隙性梗死和脑微出血的存在与 rt-PA 治疗后的出血性转化独立相关。
结论:脑微出血的存在是 rt-PA 治疗后急性缺血性卒中患者出血性转化的独立预测因素。
缺血性卒中的出血转化(HT)是指梗死组织的出血,被认为是卒中自然演变的一部分,其发生可能是由于梗死组织的再灌注或增强侧支循环对梗死组织的再灌注。 静脉注射阿替普酶 (rt-PA) 是治疗4.5 小时内急性缺血性卒中 (AIS) 患者的最有效治疗方法。 然而,HT 是缺血性卒中后的并发症,可能导致不良,且接受 rt-PA 的患者发生 HT 的风险增加。
存在各种方法来定义症状性脑出血 (SICH)。最常用的 HT 分类是依据欧洲合作急性卒中研究 I (ECASS I) 中定义的分类。它将 HT 分为 1 型和 2 型出血性梗死 (HI),以及 1 型和 2 型肺实质血肿 (PH)。 根据与出血相关的神经系统恶化的证据和时间,HT 分为有症状或无症状。大的 PH(脑实质血肿) 2 型与不良预后相关,但无症状 HT 的数据尚不清楚。
一些临床、实验室和影像学因素与 HT 相关,但只有少数被认为是独立的危险因素。与 HT 风险相关的临床因素包括年龄较大、糖尿病病史、心房颤动、既往使用抗血小板药物。收缩压升高,卒中严重程度用NIHSS评分评估。实验室因素包括高血糖、低密度脂蛋白或总胆固醇降低和肾功能损害。弥散加权成像 (DWI) 上的每搏量和初始计算机断层扫描 (CT) 头部的实质衰减程度与 HT 相关。既往研究评估了脑微出血 (CMs) 患者使用 rt-PA 后发生 HT 和 SICH 的风险。 然而,CMs 作为缺血性卒中 HT 的独立危险因素的作用及其在出血发展影响中的影响作用仍有待确定。
我们研究的目的是:(1) 评估临床、实验室和影像学因素对 rt-PA 后 HT 风险的独立影响,以及 (2) 评估与 CMs 相关的因素作为 HT 的预测因子。
方法
纳入人群
这是一个回顾性队列,纳入在 2009 年 1 月 1 日至 2013 年 12 月 31 日期间就诊于艾奥瓦大学医院和诊所的连续 AIS 患者。该研究已获得艾奥瓦大学机构审查委员会的批准。如果患者:(1) 接受了静脉内 rt-PA;(2) 入院时具有可解释的 DWI、梯度回波序列 (GRE) 和流体衰减反转恢复 (FLAIR) 序列的头颅磁共振成像 ;(3) rt-PA 后 24 小时 (18-36)的 CT 头部或 MRI 以评估 HT;(4) AIS出院诊断。如果患者没有进行后续成像或具有不可解释的 DWI、GRE 和 FLAIR 图像,则他们被排除在研究之外。
从艾奥瓦大学卒中登记处提取以下基线特征:(1) 人口统计学,(2) 病史,(3) 社会史,(4) 入院前抗血栓药物,(5) 入院 NIHSS 评分,(6)入院血压,(7) 实验室检查(血小板、血脂),和 (8) 出院情况。
成像协议
MRI 图像来自 1.5T Siemens Espree 或 1.5T Avanto 临床扫描仪(Espree 或 Avanto;Siemens, Erlangen, Germany)。MRI 图像包括 DWI、FLAIR 和 GRE。DWI 的典型参数为 TR/TE = 2900/79,b = 0 和 b = 1000 sec/mm,切片厚度为 5 毫米,间隔为 2 毫米;对于 FLAIR,TR/TE = 9000/99-110,5-mm 厚度,2-mm 间隔,翻转角 180 度,采集矩阵 288 × 384;对于 GRE,TR/TE = 418-800/18-25,5 毫米厚度和 2 毫米间隔。头部的 CT 图像是用 5 毫米切片获得的。
成像评估
研究人员 (NT) 对所有 DWI 图像进行了回顾性评估(对临床结果不知情),并确定了所有提示 AIS 的 DWI 病变,并根据 (1) 侧向性(右侧、左侧或两者)、(2) 位置(皮层、深部、皮层和深部、脑干、小脑或多个位置)对它们进行分类, (3) 血管区(大脑前动脉、大脑中动脉、大脑后动脉、基底动脉/小脑前下动脉/小脑上动脉或椎动脉/小脑后下动脉),以及(4)基于病变外观(腔隙性与非腔隙性梗死)进行相关机制的推测。腔隙性梗死被定义为内囊、丘脑、基底节或脑干中的 DWI 病变大小为≤ 1.5 cm 。
白质病变,也称为脑白质疏松症,使用半定量 Fazekas 和 Schmidt 评分量表在 FLAIR 上进行独立评估。一名研究人员(NT 或 AS)在不了解临床结果的前提下,评估了 FLAIR 图像。两人都独立审查了最初的 70 次扫描,具有良好的评分者间可靠性,与卒中神经病学家 (NN) 的读数相比,在 Fazekas 和 Schmidt 量表上,深部白质的 kappa 为 0.77,脑室周围白质评分为 0.82。在最初的 70 次扫描后,剩余的被分配给 2 位评估者并再评估一次。深部白质中的 FLAIR 高信号分级为0~3 级,0——无病变,1——点状病灶,2——融合病灶开始,3——融合改变。类似地,脑室周围白质中的 FLAIR 高信号按 0~3 的等级分级,0——没有变化,1——帽状或铅笔薄衬里,2——平滑的晕圈,和 3——延伸到深部白质的不规则改变,对应于急性卒中 DWI 病变的 FLAIR 高信号不考虑用于评估脑白质疏松症。
CMs 由一位同样不了解临床结果的卒中神经学家 (NN) 在 GRE 上进行评估。CMs 被鉴定为直径小于 10 mm 的小圆形或椭圆形均匀低信号病变(如 Green-berg 等人所述),并在脑观察者微出血量表上评级。然而,只有 BOMBS 评级量表上的某些 CMs 被考虑进行评估。即GRE 上均匀的圆形或椭圆形低信号病灶被。外观苍白且形状不规则的 CMs 被认为是不确定的 CMs 并被排除在外。与头颅 CT 相比,审查了基底神经节中的低信号病变。如果在相应位置的 CT 中有钙化,CMs被排除为不确定。GRE 低信号病变被认为是由于小皮质血管(如果可用的话,用 T2 上的血流空洞确认)或来自颞骨和眼眶的部分体积伪影,也被排除为不确定的 CMs。根据 BOMBS 标准,确定了 CMs 在 7 个位置的分布——皮质/灰白色交界处、皮质下白质、基底神经节、内外囊、丘脑、脑干和小脑。皮层和皮层下白质中的 CMs 被认为是叶 CMs,而基底神经节、丘脑和内外囊中的 CMs 被认为是深部 CMs。
HT 在rt-PA 给药后18~36小时进行 CT/MRI 头部评估。成像上 HT 的存在和类型由 2 个神经专家的 1 个读取(NT 或 AS)。HT 是在 ECASS Ⅰ 研究分类的基础上记录的。因为确定有症状的 HT 的标准有些随意,并且无症状的 HT 和有症状的 HT 是同一连续体的一部分,所以我们独立于临床症状考虑了所有 HT。
统计分析
为了测试 HT 的潜在预测因子的相关性,使用分类变量的卡方检验和连续变量的 t 检验进行单变量分析。对显著性水平为 0.1 的变量进行多变量逻辑回归分析。我们还评估了 HT 存在或不存在或 CMs 的临床、实验室和影像学因素的关联。使用 SAS 9.4 版 (Cary, NC) 进行分析。
结果
2009 年 1 月 1 日至 2013 年 12 月 31 日期间,艾奥瓦大学医院和诊所共有 447 例患者(其中 369 名逐级转运)接受了 rt-PA。其中,366 名患者符合研究纳入和排除标准。他们的平均年龄为 67 ± 15 岁,46% 为女性,88% 为白人,NIHSS 评分中位数为 6(四分位距为 3-15)。大脑 MRI 在静脉 rt-PA 治疗后的中位时间为 218 分钟(四分位距 168-331)。四名患者在 rt-PA 给药前进行了 MRI。44 名患者在 24 小时 (18-36h) 进行了 MRI,其中 34 个 用MRI 评估 HT 而非CT。在 87 名患者(23.8%)中观察到 HT。在 95 名患者 (25.9%) 中发现了 CMs。32 名 (33.7%) CMs 患者患有 HT,而 20% 没有 CMs 患者(p = 0.008,优势比 1.99,95% CI 1.2-3.3)。患有 CMs 的患者有 1 -5 个病灶,除了 2 名患有 7 - 10 个 CMs ,其中 1 名患有 PH。在 34 名未接受 CT 的患者中,在 rt-PA 给药后 24 小时 (18-36) 进行了脑部 MRI 进行 HT 评估。在 34 名患者中,6 名患有 HI,其中 3 名患有 1-5 CMs ;1 名患者的 PH 为 10 CMs 。6 名患者有远隔部位 HT,其中 4 名是 PH。两名患者在梗塞部位和远隔部位均有有 HT,这两个都是 PH。
表 1 显示了所有患者以及 HT、CMs 和 HT 伴或不伴 CMs 患者的基线临床特征。HT 患者年龄较大,更可能是非白人且有心房颤动,平均 NIHSS 评分较高,总胆固醇和甘油三酯水平较低。这些在高血压、糖尿病、高脂血症、既往卒中或 TIA、外周血管疾病、心肌梗塞、冠状动脉疾病、充血性心力衰竭或瓣膜病的病史的患者中没有差异。与没有 HT 的患者相比,HT 患者的吸烟史、饮酒史、抗血栓药物的使用史、入院时收缩压和舒张压以及血小板计数没有显著差异。
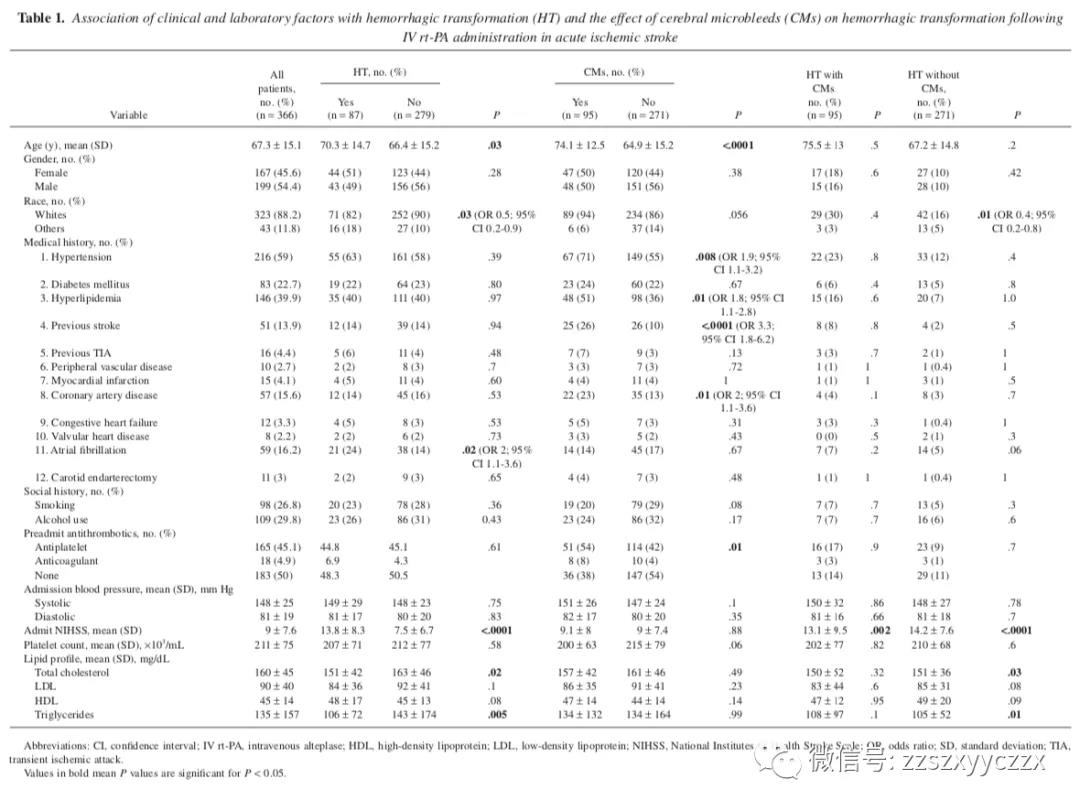
患有CMs 的患者年龄较大,有明显的高血压、高脂血症、冠状动脉疾病病史,既往有卒中病史,并且更有可能在中风前服用抗血栓药物。脂质水平与 CMs 存在与否无关。基线 NIHSS 评分是独立于 CMs 与 HT 显著相关的临床和实验室因素中的唯一变量。非白种人、较低的总胆固醇和甘油三酯水平仅在没有 CMs 的情况下与 HT 相关。有趣的是,年龄和房颤病史与有或没有 CMs 组的 HT 无关。
表 2 列出了在使用 rt-PA 后评估 DWI、FLAIR 和 GRE 图像与 HT 的成像因素的关联。接受静脉注射 rt-PA 的所有患者中约有 13.4% 的脑部 MRI 没有提示缺血性卒中的受限弥散病变。这些病例可能代表中风模拟、r-tPA 治疗的成功或 MRI 阴性卒中。具有提示缺血性卒中的弥散受限病变的患者更可能患有 HT。尽管如此,在 MRI 上没有梗死的患者中发现了 1 个 HI 和 1 个 PH,而有 PH 的患者有 1 个 CMs。卒中病变或血管区域的偏侧性与 HT 没有显著相关性。涉及皮层和深部白质的缺血性卒中患者更可能患有 HT,而那些仅涉及更深层结构和脑干的患者不太可能患有 HT。腔隙性梗死与 HT 风险较低相关。当我们将患者分为有和没有 CMs 的亚组时,DWI 病变侧向性、位置、血管区域和梗死的腔隙性质的结果相似。
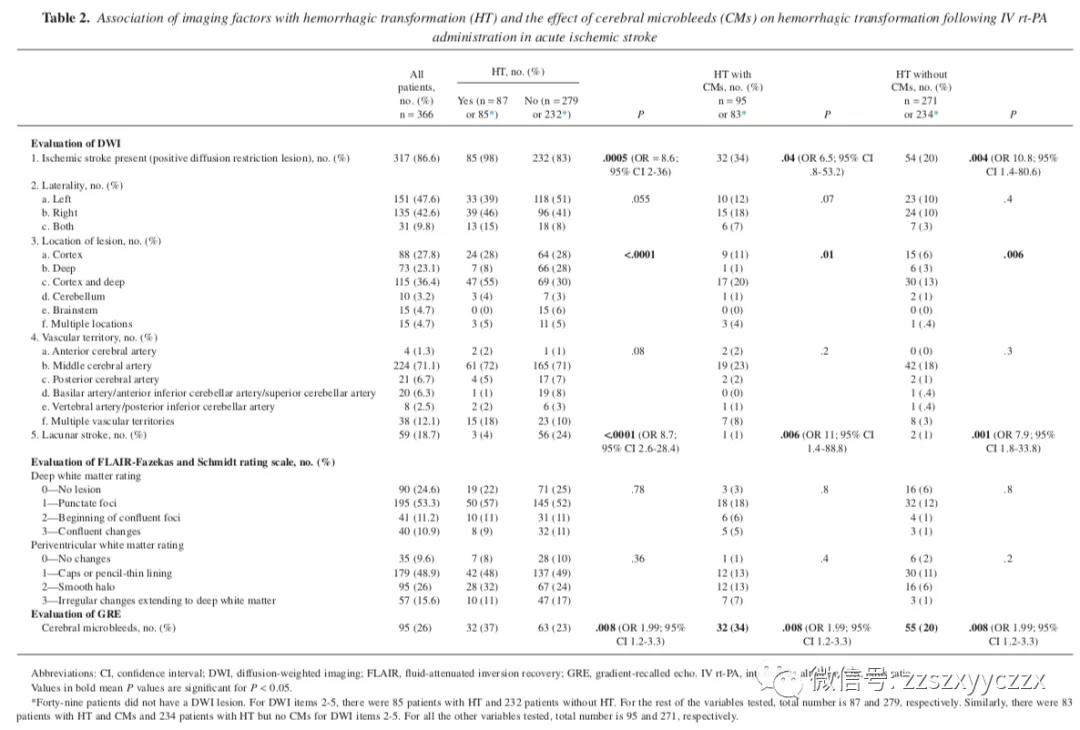
深部白质和脑室周围白质中 FLAIR白质病变的存在与 HT 无关。对于深部白质 (p = 0.49) 和脑室周围白质 (p = 0.58),对于 (1) 无脑白质疏松症(在 Fazekas 和 Schmidt 量表上为 0 比 1-3),以及 (2) 没有和深部白质 (p =0 .68) 和脑室周围白质 (p =0 .67) 的轻度变化与中度或重度脑白质疏松症(在 Fazekas 和 Schmidt 量表上为 0-1 对 2-3)。在存在脑白质病变时,CMs 对 HT 没有影响。然而,CMs 的存在与 HT 显著相关,优势比为 1.99。HT 的类型与 CMs 的存在(n = 32, 68.7% HI vs 31.3% PH)或不存在(n = 55, 69.1% HI vs 30.1% PH)无关(p =0 .97,未在表中显示) .
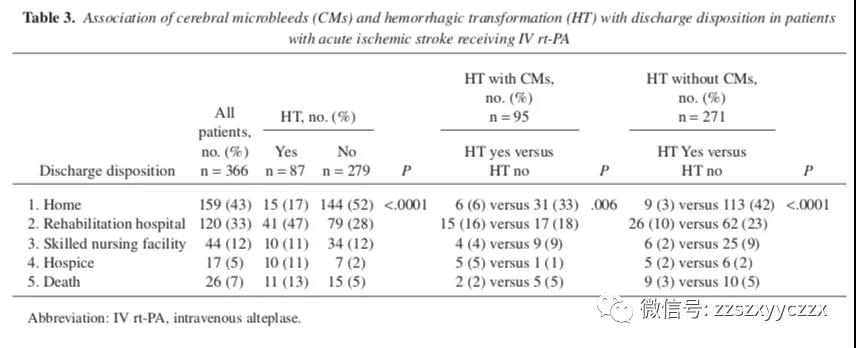
HT 患者出院回家的可能性较小,更有可能死亡或出院时接受康复治疗或临终关怀。伴或不伴 CMs 的HT患者出院回家的可能性较小。
表 3 显示出院后状态与 HT 和 CMs 的关联。在多变量分析中,包括在单变量分析中显著的变量和 p <0 .1 的变量。种族、心房颤动病史、NIHSS、总胆固醇、低密度脂蛋白、高密度脂蛋白、甘油三酯、DWI 上缺血性病变的存在、病变位置、血管区域、非腔隙性卒中和 CMs 都包括在分析中。
在多变量分析中,非白种人、总入院 NIHSS 评分、非腔隙性梗死和 CMs 的存在与 HT 风险独立相关,如表 4 所示。
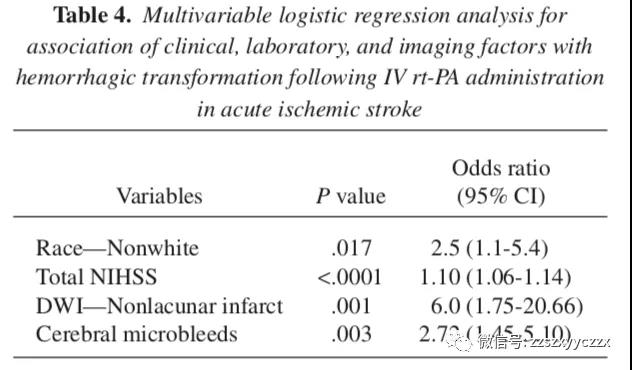
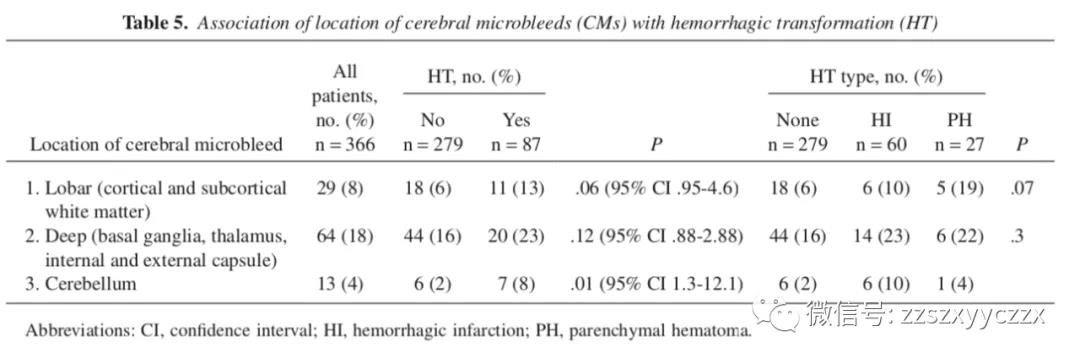
95 名患者在 MRI 上有 1 个或多个特定 CMs,按位置分布如下:皮质 (28)、皮质下白质 (2)、基底神经节 (57)、内外囊 (0)、丘脑 (11)、脑干 (4) 和小脑 (13)。在 29 名患者中发现了包括皮质和皮质下白质的脑叶的 CMs。在 64 名患者中发现了深部 CMs,包括基底神经节、内外囊和丘脑。7 名患者在脑叶和深部都有 CMs。CMs(脑叶或深部) 的位置与HT的发生风险间没有显著差异。然而,脑叶 CMs 的 HT 风险有增加的趋势。此外,脑叶 CMs 的存在有 PH 的趋势。13 名小脑 CMs 患者中有 7 名患有 HT。表 5 显示了随着 CMs 位置发生 HT 的风险。
讨论
我们的研究通过仔细分类脑部 MRI 结果(同时研究者对临床结果不知情)增加了关于 r-tPA 后 HT 预测因素的证据。我们还使用多变量模型来调整混杂效应(这是既往研究关注的问题)。在这种情况下,我们发现 CMs 和 HT 之间存在独立且牢固的相关性。
CMs 在即将接受 rt-PA 的 AIS 患者中很常见,因为本研究中 25.9% 的患者出现CMs。我们使用预处理 MRI 评估 CMs的识别率与的其他研究相当。 先前评估 CMs 存在的 SICH 风险的研究报告了混合结果。由Turc 等人、Gratz 等人、Fiehler 等人和 Kakuda 等人的研究显示,CMs 的存在或负担与不良结局或 SICH 的显著增加无关,尽管他们报告了脑内出血的增加。相反,Yan 等人和 Dannenberg 等人的研究表明,≥3CMs 和≥5CMs 的患者的 PH 和 SICH 分别显著增加。先前研究的两项荟萃分析研究显示SICH 存在 CMs,尤其是超过 10 个 CMs。在我们的研究中,我们评估了任何 HT 的存在并将它们分类为 HI 和 PH。在 HT 患者中,大约 31% 有 PH-1 和 2,剩余的为 HI-1 和 2。无论微出血存在与否,这种 PH 和 HI 的分布是相同的。尽管我们队列中CMs的数量较少,但我们发现,与无CMs的患者相比,有CMs的患者HI和PH的类型无同济学差异。因此,CM会增加HT的风险,但不会增加HT的类型。虽然HT与出现回家的可能性降低有关,但CMs的存在不能改变临床结局。本研究表明HT 是 CMs 以外的多种因素影响的结果,包括非腔隙性梗死、入院 NIHSS 和种族,并且它与出院预后不良有关。
Lin 等人和 Kongbunkiat 等人最近发表的荟萃分析报告说,脑白质病变与 rt-PA 治疗后颅内出血或 SICH 的风险增加有关。我们的研究没有发现此种相关性。目前存在几种视觉评定量表来评估脑白质病变,为了将我们的结果与之前的研究进行比较,我们回顾了 2 项荟萃分析中包含的 4 项研究,并使用 Fazekas 和 Schmidt 评分量表来评估脑白质病变。Neumann-Haefelin 等人的最早研究显示为中度至重度深部白质脑白质疏松症与 SICH 风险增加有关。相比之下,Fiehler 等人发现脑室周围白质病变,而不是深部白质脑白质疏松症,与 PH 风险增加有关。尽管 Choi 等人报道脑白质病变的存在与不良结局相关,但他们没有研究脑白质病变与 HT 的关联。国际卒中试验-3 的二次分析发现任何脑白质病变(通过 CT/MRI 评估)与 SICH 无关,但与不良预后结局(定义为6 个月时牛津差点分数>3-6 分)相关。这些研究表明,即使使用单一评分量表,这些研究的结果也存在很大差异。脑白质病变可能是与不良结果相关的混杂因素,但不一定与 HT 或 SICH 相关。在我们的研究中,2 名独立评估者在对 70 例具有良好评估者间可靠性的初始综合评估后,评估了 FLAIR 高信号。尽管在最初的 70 个病例之后进行的图像分级可能会有轻微的变化,但这不太可能解释我们研究中注意到的脑白质病变与 HT 的负相关性。
当皮层和深层结构同时受累时,HT 更常见,这表明这些可能是更大的存在。然而,脑干受累时未发现HT,前循环或后循环腔隙性梗死的可能性较小。这些发现与之前发表的报告一致。CMs 没有改变这些 DWI 成像特征对 HT 的影响。在我们的研究中,88% 的患者是白人,其余 11% 属于其他种族群体,包括黑人和亚洲人。我们研究中相对较少的少数群体可能是研究该人群 HT 风险的一个限制。
我们的研究还有其他局限性:(1)除34名患者外,其余患者在 rt-PA 给药后 24小时(18-36)进行的头 CT 检查评估HT,这些患者中采用MRI 代替 CT 作为作为 rt-PA 后的 24 小时随访成像。根据 ECASS I 对 HI 和 PH 的定义,对 GRE 进行评估以确定任何 HT。GRE MRI 在检测小出血方面比 CT 更敏感。(2) 我们没有在 rt-PA 给药前常规进行 MRI 以避免延误治疗。相反,我们使用了 rt-PA 后立即进行的 MRI。在评估 CMs 时,我们没有包括梗塞内的任何易感性变化。在给予 rt-PA 后,梗塞组织外的组织中仍有可能发生自发性微出血。Kimura 等人表明,在 rt-PA 后可能会出现新的额外缺血性 CMs。与没有新的额外缺血性 CMs 的患者相比,它更常与有症状的额外缺血性出血相关。在我们的研究中,6 名患者有远隔部位或额外的缺血性出血,其中只有 1 名患者有 1 个CMs。远隔部位的出血可能与先前存在的血管病变有关。(3)我们在大多数这些患者中没有进行 24 h NIHSS评分。因此,我们无法准确确定 HT 是有症状的还是无症状的。(4) 我们的研究只有 2 名患者超过 5 个 CMs。无法确定 CMs 负担对 HT 的影响。
该研究的主要优势如下:(1)我们通过多变量逻辑回归分析对可能影响 HT 的几个临床、实验室和影像学变量进行了系统评估,以确定独立预测因子。(2) 我们使用了单一机构的大样本量。Charidimou 等人的荟萃分析发现,CMs 负担的增加与 PH 风险的增加有关。这项荟萃分析的局限性在于它涉及来自多项研究的异质研究人群,并且在他们的分析中没有排除潜在的混杂因素。我们的研究建立在这项荟萃分析的局限性之上,因为它具有来自单一机构的更大样本量,并且排除了潜在的混杂因素。我们没有评估伴或不伴CMs患者或未接受 rt-PA 的脑白质病变卒中患者HT的发生率。对 AIS 患者的 CMs 和脑白质病变及其与 rt-PA 给药和未给药患者的 HT 关系的系统评估将有助于了解 CMs 和脑白质病变对 AIS 的真正影响。
总之,在消除混杂因素的影响后,MRI 上 CMs 的存在是 rt-PA 给药后 AIS 患者HT 的独立预测因子。它与高龄、高血压、高脂血症、冠状动脉疾病、既往中风史和先前使用抗血栓药物有关。CMs 不应被视为 rt-PA 给药的禁忌证,因为并非所有类型的 HT 都与更差的结果相关,并且不使用 rt-PA 治疗的 HT 卒中的自然病程和 CMs 的存在是未知的。然而,与患者讨论可能增加的 HT 风险是有用的。CMs 引起的 HT 是否超过 rt-PA 的益处尚不清楚。
来源:郑州市中心医院卒中中心
查看更多