查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





文章来源:JCO肿瘤论坛
Toshihiko Doi, Sarina A. Piha-Paul, Shadia I. Jalal, Sanatan Saraf, Jared Lunceford, Minori Koshiji, andJaafar Bennouna
本刊负责人:周芳坚 中山大学肿瘤医院
审校:苗儒林 北京大学肿瘤医院
翻译:张彬彬 沈阳市第十人民医院
摘要
研究目的:抗程序性死亡-1抗体pembrolizumab在程序性死亡配体-1(PD-L1)阳性的进展期实体瘤患者中进行了一项多队列、 IB期的临床试验(KEYNOTE-028)。本文报告在食管癌队列的研究结果。
对象和方法:本研究纳入标准为既往接受标准治疗失败、PD-L1阳性的食管或食管胃结合部鳞状细胞癌或腺癌患者。入组患者接受pembrolizumab每两周10mg/kg方案治疗,直至治疗满2年,或出现确切的疾病进展,或出现不可耐受的毒性反应。前6个月每8周进行一次疗效评价,之后每12周进行评价。主要研究终点为安全性和总体应率,由研究者根据实体瘤反应评估标准进行评估(RECIST 1.1版本)。
研究结果:83例食管癌患者采样评估PD-L1的表达,其中37例(45%)PD-L1阳性,纳入23例。中位年龄65岁;78%患者为鳞癌;87%患者因进展期或转移性疾病接受了≥2种前期治疗。截止数据收集前(2017年2月20日),中位随访时间为7个月(范围1-33个月)。9例患者(39%)发生了治疗相关的不良事件,最常见的是食欲下降、淋巴细胞减少、全身皮疹、皮疹(各2例(9%))。没有发生pembrolizumab所致的4级不良事件或死亡。总体反应率为30%(95% CI, 13%-53%);中位反应持续时间为15个月(范围6-26个月)。一项6基因干扰素γ基因表达印迹分析提示,使用pembrolizumab治疗患者中干扰素γ合成分数较高的患者进展延迟,治疗反应率增加。
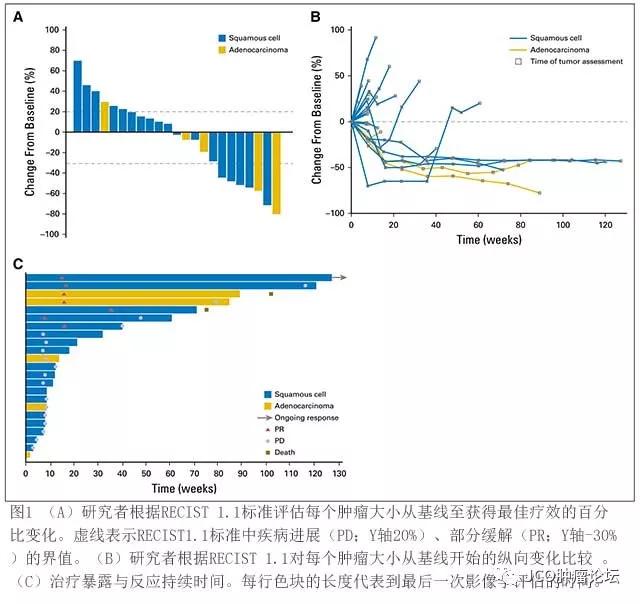
结论: Pembrolizumab在接受大量前期治疗、PD-L1阳性的进展期食管癌患者中显示出可控的毒性反应和持久的抗肿瘤活性。
查看更多