查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






作者:复旦大学附属中山医院心内科 黄浙勇 副主任医师

微弹簧圈应用历史悠长,主要应用于脑动脉瘤、胃肠道出血、外周血管性疾病等,近年来也用于冠状动脉穿孔栓塞治疗。各种微弹簧圈和输送微导管的介绍详见相关网站(www.evtoday.com/)[1]。
Tornado®栓塞微弹簧圈(Cook)为不透X线的柔软的铂金丝所制,一级螺旋结构较细,可随血管形状塑型,可有效栓塞小动脉,是国内最常用的冠脉穿孔栓塞弹簧圈[2]。
本节在简要介绍Cook弹簧圈栓塞基本操作技巧基础上,重点关注CTO侧枝穿孔的双向栓塞治疗。
一、【弹簧圈栓塞技巧】[1, 3]
1、微弹簧圈选择
为保证释放后充分贴壁,弹簧圈直径最好稍大于靶血管直径(如25%)[3]。由于需要栓塞的末梢冠脉或侧枝血管的直径大约1-2mm,因此推荐选择直径2-3mm(锥形渐细)、长度20mm的Cook微弹簧圈(型号MWCE-18S-3/2-Tornado,图1)。
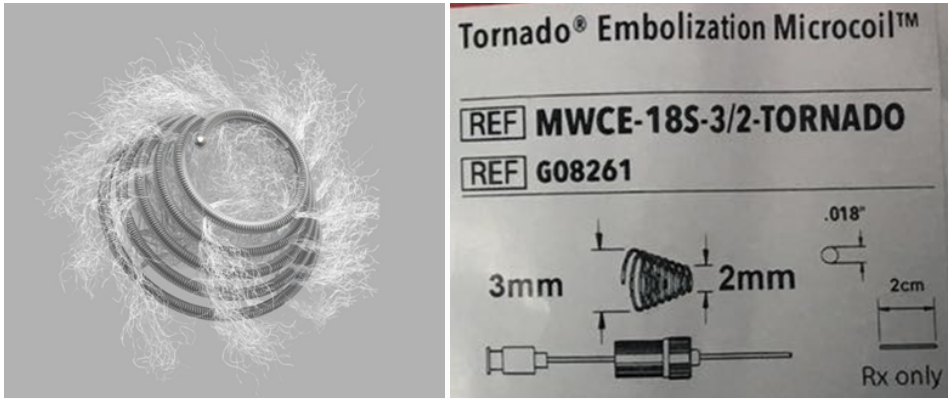
图1 MWCE-18S-3/2- Tornade主要参数
2、微导管选择
Tornado微弹簧圈金属丝的直径为0.018”,因此微导管内径必须≥0.018”。由于Corsair微导管头端内径只有0.015”(0.38mm),因此需要更换为Finecross微导管(内径0.018”,0.45mm)才能兼容Tornado微弹簧圈。
3、微导管到位
微导管超选择性造影确认微导管头端位置、穿孔位置,确保微导管所在血管为穿孔源血管。微导管头端距离穿孔点5-10mm左右为宜。若距离过大,则心肌梗死范围过大;若距离过近,铂金丝可能穿出穿孔点,进入心包腔。
4、冲洗微导管
在输送微弹簧圈前需要用生理盐水冲洗微导管,以排空残存血液或造影剂。Cook为纤维涂层微弹簧圈,可快速诱发血液形成血栓;而微导管内造影剂则可增加微弹簧圈输送时的粘滞阻力。
5、推送微弹簧圈
尽管Cook弹簧圈可用生理盐水冲洗推送,但谨慎起见,一般使用导丝推送。首先装载弹簧圈进入微导管(图2),然后采用普通工作导丝即可将导丝推送出微导管。其要点是尽量快速到位,避免“栓塞”于微导管内。弹簧圈头端出微导管后,若继续前送受阻,需要稍后撤微导管,强力推送可能穿出血管外。
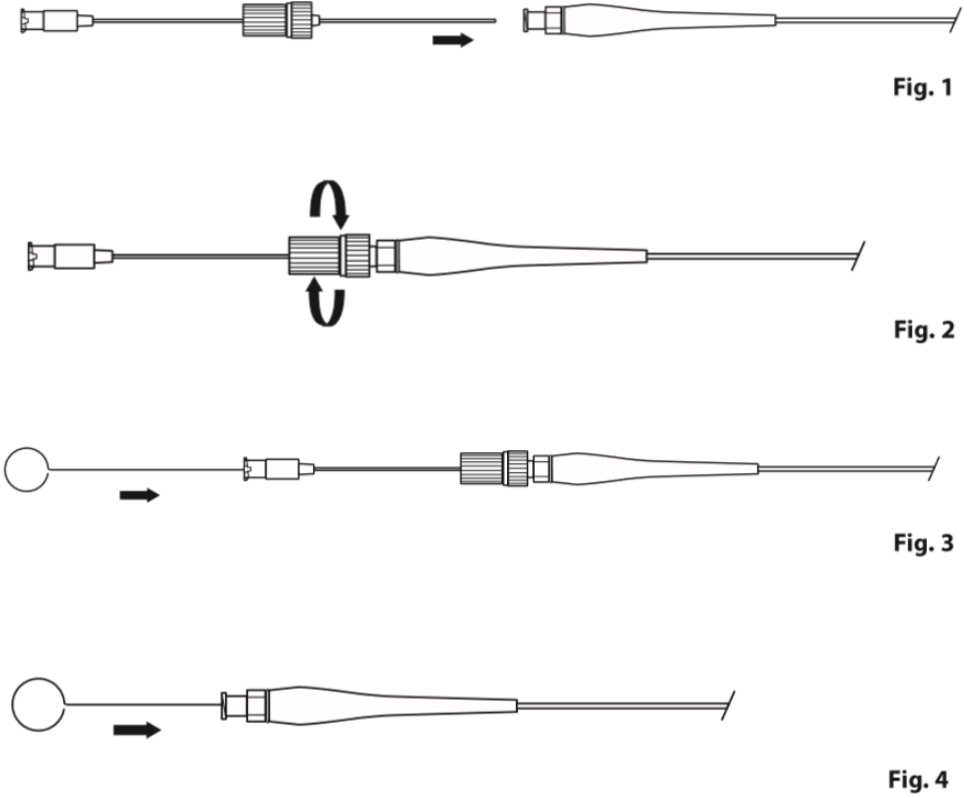
图2 弹簧圈装载。装载套管完全推入微导管,与微导管接头锁定,推送杆芯将弹簧圈尽可能远的送入微导管。()
6、重复栓塞
Cook弹簧圈释放后,确定弹簧圈形态、位置和效果。弹簧圈释放形态有助于预判栓塞部位和效果(图3)。弹簧圈可快速诱导局部血栓形成,如10-30秒钟后仍有渗漏,可重复栓塞。
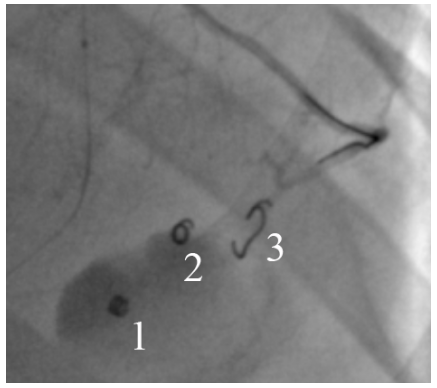
图3 弹簧圈释放形态。1和2呈“螺旋蜷缩状”,说明局部空间较大,提示释放于小血管外(心包内);3呈伸展状,形态走向与小血管一致,为有效栓塞。
二、【CTO侧枝穿孔的双向弹簧圈栓塞】
CTO病变逆向开通越来越普及,随之而来的是侧枝通道穿孔也越来越多。侧枝通道穿孔的严重性与穿孔部位有关:室间隔侧枝血管穿孔,往往破入左心室或右心室,甚少破入心包腔导致心包压塞;心外膜下侧枝扭曲,周围缺乏心肌组织和脂肪结缔组织支撑,不但容易穿孔,穿孔后也容易心包填塞。
与一般小血管穿孔不同,侧枝穿孔需要二步造影确定穿孔点位置和血流来源。①微导管轻力造影:CTO导丝通常在微导管支持下操作,由于微导管阻断部分血流,造影剂外渗现象不易发现。一旦怀疑侧枝穿孔,微导管造影可更好的确认穿孔的精确位置和严重程度。强调轻力,是因为大力推注造影剂可能导致穿孔的扩大。②双侧造影:由于侧枝血管的血液来源具有双源性,因此开通CTO病变后,侧枝穿孔封堵可能需要双向栓塞(图4)。
接下来我们以2个病例阐述侧枝穿孔的双源出血特性、及双向弹簧圈栓塞技术的应用。
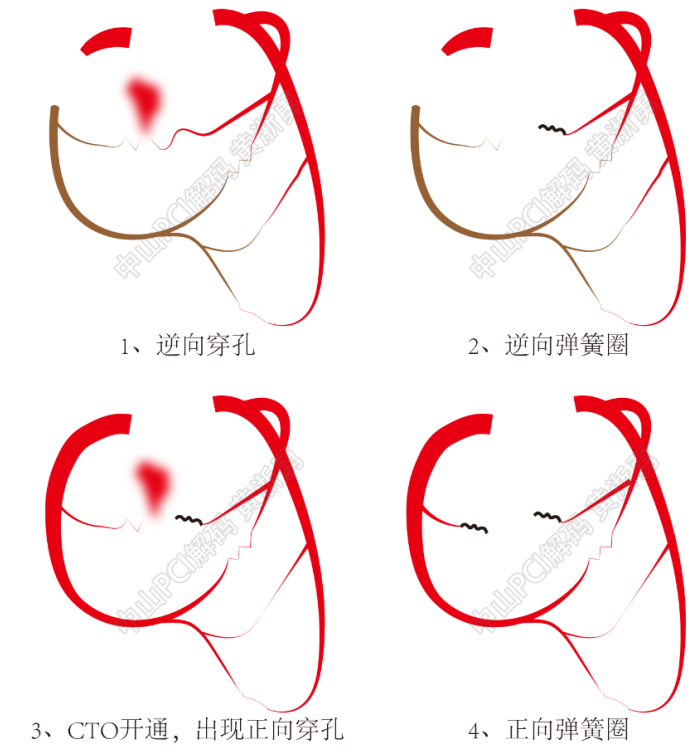
图4 双向弹簧圈栓塞的示意图
三、【双向栓塞病例1】(图5系列)
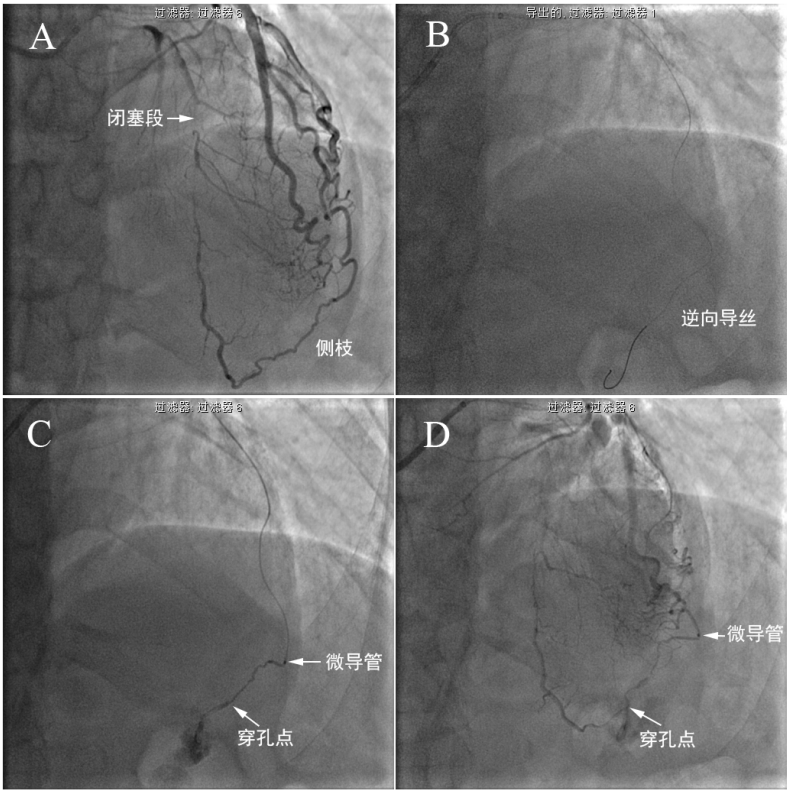
图5-1 侧枝穿孔发生。 62岁女性,不稳定性心绞痛。造影见前降支中段CTO病变,钝缘支向前降支提供心外膜下侧枝循环(A)。右冠临界病变。拟行经钝缘支逆向开通前降支CTO。6F EBU3.5+Guidezilla加强支撑,Corsair微导管在Sion导丝引导下经“回旋支-钝缘支-侧枝-前降支”成功送至前降支远端(B),微导管造影(C)和指引导管造影见心外膜下侧枝穿孔(D)。
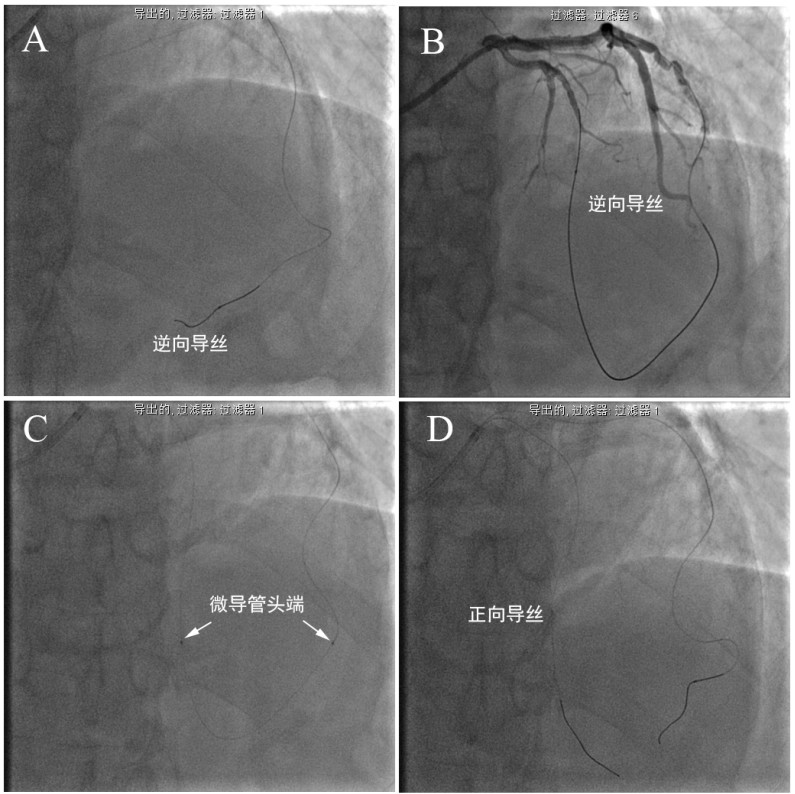
图5-2 逆向开通CTO。更换Gaia1导丝成功逆向通过闭塞段(A-B),延长导丝帮助下更换为150cm Finecross微导管并逆向推送至前向GC内,RG3导丝体外化,前向送入130cm Finecross微导管至前降支远端(C),正向送入Sion导丝,撤出正向微导管,正向导丝就位(D)。
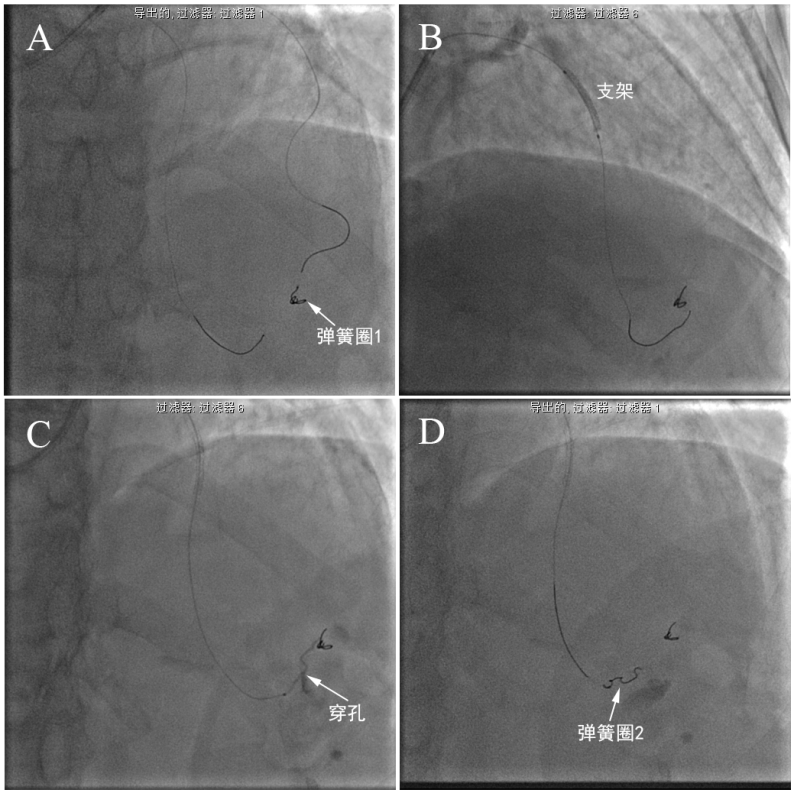
图5-3 双向弹簧圈栓塞。撤出逆向Guidezilla,回撤RG3导丝,经逆向Finecross微导管送入第一个弹簧圈栓塞穿孔部位(A,弹簧圈1)。前降支闭塞病变处球囊扩张后植入支架(B),复查造影示心外膜下侧枝仍有造影剂外渗,正向送入Finecross微导管至穿孔近端定位(C),然后经正向Finecross微导管送入第二个弹簧圈栓塞穿孔部位,复查造影示外渗消失(D,弹簧圈2)。床旁心超检查见中等量心包积液,心包穿刺抽出新鲜血液240ml。

图5-4 最后造影结果。
四、【双向栓塞病例2】(图6系列)
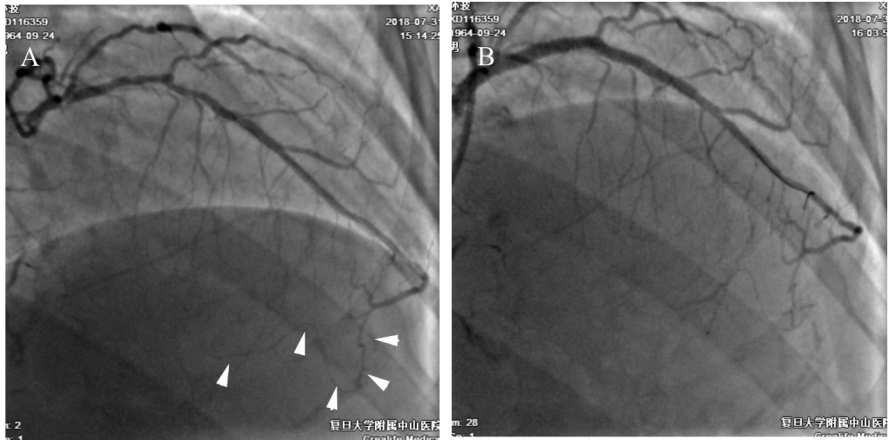
图6-1 造影和左冠PCI。54岁男性,活动后胸痛10余年。造影见左主干狭窄60%,前降支近中段长病变狭窄80%伴钙化。回旋支较小。右冠起始部完全闭塞。左冠提供右冠中远段侧枝循环,心尖部心外膜下侧枝迂曲(A,箭头)。PCI策略:鉴于右冠开口闭塞,无法确定开口位点,也无法提供良好支撑,故首选逆向径路开通。先于前降支-左主干植入2枚支架,完成左冠PCI(B),然后开始逆向开通右冠CTO。
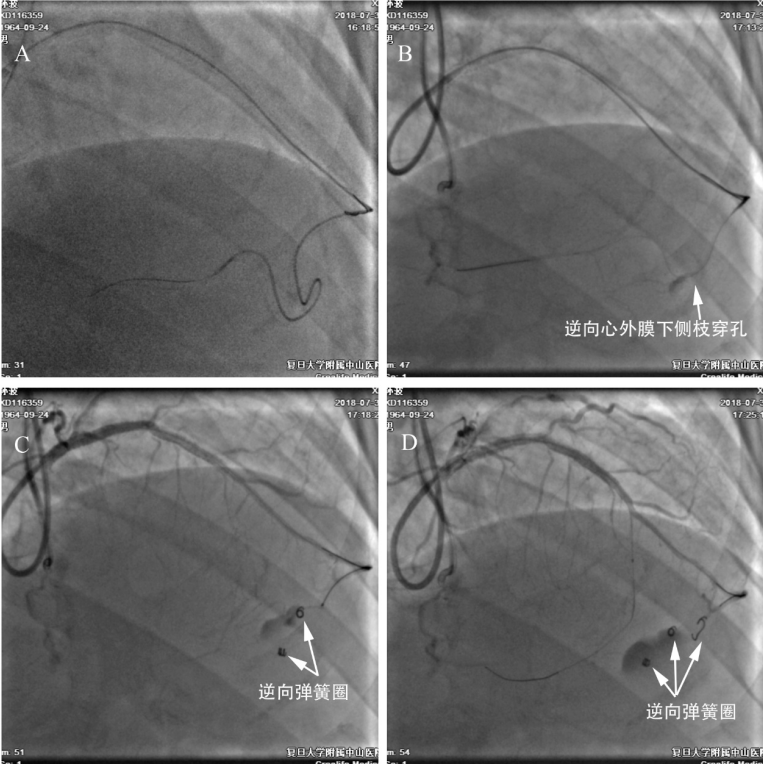
图6-2 侧枝穿孔和逆向栓塞。拟行逆向技术开通右冠CTO病变,0.014”Sion引导150cm Corsair微导管通过心尖部心外膜下侧枝送至右冠远段,先后尝试FielderXTR、Gaia3、Pilot200、CP12均不能逆行通过右冠闭塞段(A)。由于心外膜下侧枝极度扭曲,微导管也无法送至右冠近中段。逐撤出微导管,造影见侧枝穿孔(B),经逆向微导管送入3枚2*2mm弹簧圈,堵塞成功(C-D)。
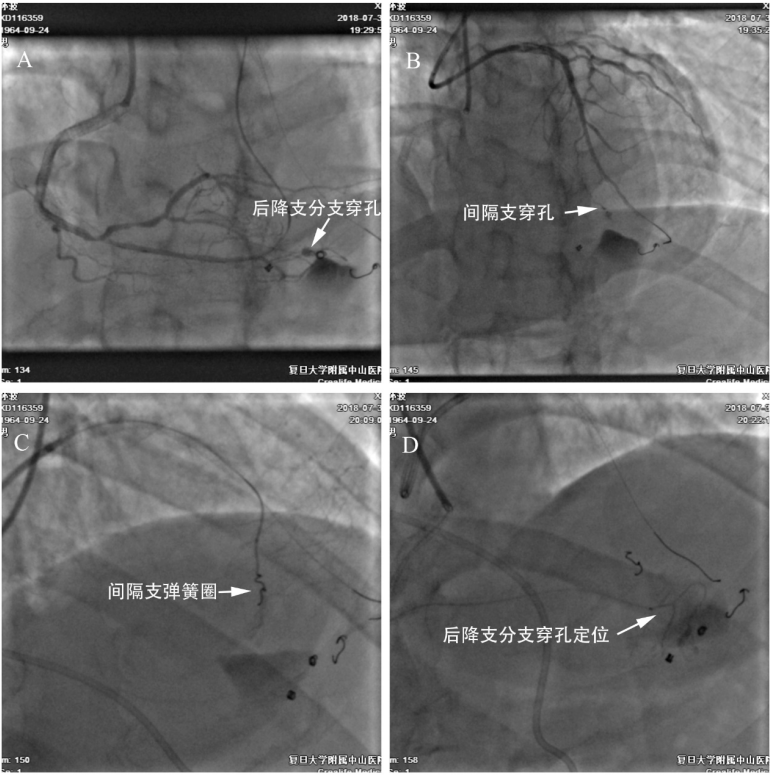
图6-3 侧枝的正向栓塞。逆向失败后改用正向技术,未成功。尝试经间隔支逆向介入,150cm Finecross微导管支持下CP20逆向推送至前向GC内,换入RG3导丝体外化,常规球囊扩张、IVUS检查后完成右冠PCI治疗。复查造影时发现后降支分支(原心外膜下侧枝封堵段的右室侧)明显穿孔,局部造影剂残留伴外渗(A)。同时间隔支也可见少量造影剂外渗(B)。此时患者出现胸闷、烦躁、大汗等心包填塞症状,血压从120/70mmHg下降至70/40mmHg,立即予剑突下心包穿刺并抽吸出500ml积血。同时调整Finecross微导管至穿孔近端,确定穿孔位置后,间隔支穿孔部位用弹簧圈1枚栓塞(C),后降支分支用弹簧圈2枚栓塞(D),复查造影示外渗消失。
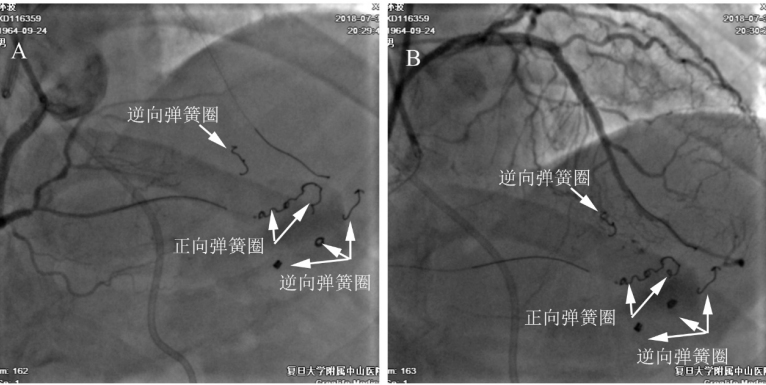
图6-4 最后造影结果。
【附:弹簧圈栓塞机制】
(1)机械阻塞:尽管螺旋状结构可增加横截面直径,但纤细的弹簧圈往往不足以完全阻塞血流。
(2)血栓形成:弹簧圈诱发的涡流、表面正电荷吸引负电荷的血小板和凝血因子、Cook微弹簧圈表面的致凝性合成纤维(最重要),可有效诱导血栓形成。
(3)血管炎:弹簧圈可诱发血管内膜炎,进一步促进血栓形成和纤维化,最终永久性期闭塞。
【参考文献】
1. Katsanos K, Patel S, Dourado R, et al. Lifesaving embolization of coronary artery perforation. Cardiovasc Intervent Radiol, 2009, 32: 1071-1074.
2. Cook官网. .
3. Ponnuthurai F A, Ormerod O J, Forfar C. Microcoil embolization of distal coronary artery perforation without reversal of anticoagulation: a simple, effective approach. J Invasive Cardiol, 2007, 19: E222-225.
点击链接,查看《中山PCI解码》系列文章:
查看更多