查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





引言:近年晚期结直肠癌的免疫治疗获得突破性进展,为患者带来了新希望。2021 ESMO于9月16-21日以线上会形式召开,也公布了多项结直肠癌免疫治疗进展数据。《中国医学论坛报》特邀中山大学附属第六医院的邓艳红教授,为大家解读结直肠癌免疫治疗研究最新数据。
专家简历

邓艳红 教授
主任医师、肿瘤学博士生导师
博士后合作导师
中山大学附属第六医院院长助理、肿瘤中心主任
国家药物临床试验机构(GCP)中心主任
广东省特支计划青年拔尖人才、广东省医学杰出青年人才
CFDA国家核查员
中国结直肠癌诊疗规范(国家卫健委)专家组成员
中国老年医学会肿瘤分会副会长
CSWOG结直肠癌专委会副主委
中国抗癌协会肿瘤支持治疗&精准专委会常委
CSCO结直场癌专业委员会&青委常委&委员
中国医师协会结直肠肿瘤分会肝转移专委会常委
广东省女医师协会消化肿瘤专业委员会主委
广东省医学会肿瘤学分会常委
曾留学美国西雅图Fred Hutchinson/华盛顿大学癌症研究中心,擅长结直肠癌、胃癌、胃肠间质瘤、食管癌、小肠癌、阑尾癌等消化肿瘤的免疫、靶向和化学治疗,研究方向为消化道肿瘤的药物敏感性和临床研究,所主导的FOWARC研究2次获得ASCO口头报告,在JCO、JAMA、Lancet Oncology、BJC、BMC cancer等杂志发表论文60余篇,其中第一作者或通信作者28篇。主持和参与多项国家自然科学基金和广东省自然科学基金,获国家科技进步二等奖2016(第五),广东省科技进步一等奖2018(第四),第六届中国女医师协会五洲女子科技奖-基础医学科研创新奖等
专家解读
一年一度的ESMO吸引着肿瘤领域全球学者、科学家、企业界的目光,而免疫治疗更是聚焦点,今年在结直肠癌免疫治疗领域也有几个研究值得关注。
MSI-H肠癌免疫治疗长期疗效得到确认
KEYNOTE-164研究证实了帕博利珠单抗在既往接受过≥2线(队列A)和接受过≥1线(队列B)的晚期MSI-H/dMMR结直肠癌患者中的疗效,率先带领MSI-H结直肠癌进入免疫治疗的年代。今年ESMO对KEYNOTE-164研究进行了最终长期的疗效和安全性数据的报道,是在首次分析后增加29.6个月的随访时间。结果显示,在中位随访时间接近5年后,确认队列A的ORR分别为32.8%,1例患者由初始评估为PR转为CR;队列B的ORR为34.9%,增加4例CR,总CR率达到14.3%。两组中位的OS分别为31.4个月和47个月,队列B已经远超了RAS野生型肠癌的中位生存。更值得一提的是,中位的持续缓解时间均未达到,3年持续缓解率高达93%,进一步证实,一旦有效的患者长期有效,甚至可能被治愈。此外,该研究允许进展后重启17周期的PD-1单抗治疗,共9例患者接受了帕博利珠单抗的再引入,其中2例患者再次获得PR,6例患者SD,有效持续时间超过12个月,也提示部分患者重启帕博利珠单抗后仍可见临床获益。
基于Ⅲ期的KEYNOTE-177研究阳性结果,帕博利珠单抗已经在今年6月正式在中国获批用于MSI-H的晚期结直肠癌的一线治疗适应证,给这类患者带来全新的选择和更长效生存的可能。
MSS肠癌免疫治疗探索在艰难中继续前行
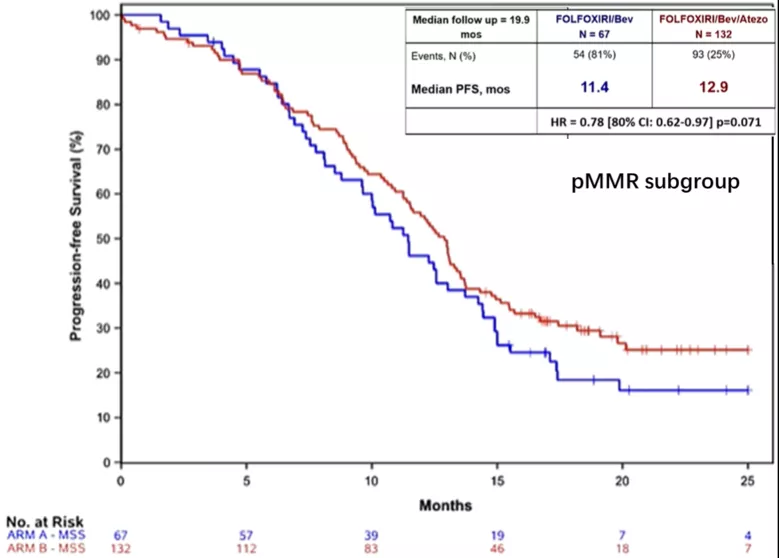
MSS肠癌免疫治疗的疗效一直难以突破,Regonivo研究的策略曾经让大家非常期待,在临床实践中却远达不到令人满意的效果。由于贝伐珠单抗是VEGF的抑制剂,被认为可以调节免疫微环境,而三药的化疗能最大程度地释放肿瘤抗原,因此三药联合贝伐珠单抗再联合免疫治疗也被大家所期待。AtezoTRIBE研究就是这样一个II期的临床研究,对四药联合阿特珠单抗一线治疗的疗效进行了探索。结果显示PFS从11.5个月延长到13.1个月(HR=0.69,80%CI 0.56-0.85,p=0.012);在MSS的亚组,PFS从11.4个月延长到12.9个月(HR 0.78,80% CI 0.62-0.97,p=0.071),更重要的是阿特珠单抗并没有显著增加不良反应,提示这种策略的潜在可行性。
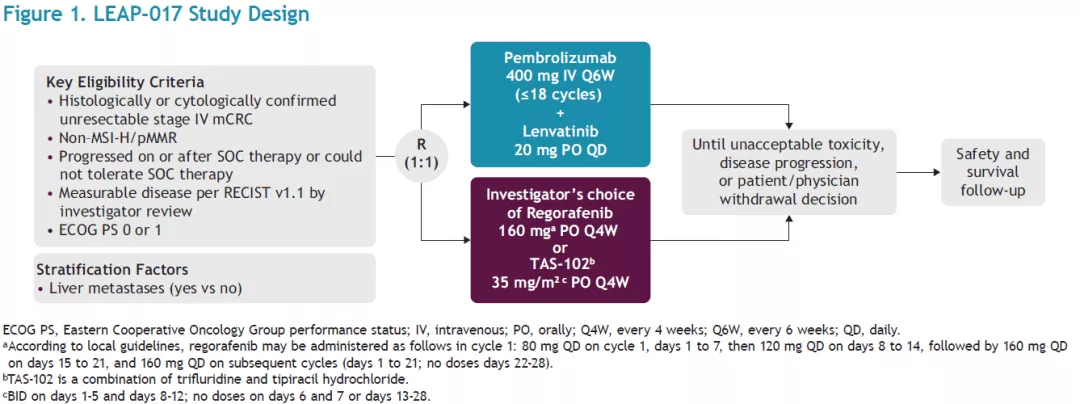
“可乐组合”用于各种实体瘤也有成功的经验,在肠癌后线治疗的初步探索研究中得到不错的疗效数据后,目前启动了Ⅲ期的LEAP-017研究,该研究将纳入年龄≥18岁,组织学/细胞学确认的非MSI-H/dMMR,不可切或转移性的Ⅳ期mCRC。患者经1:1随机分配分别接受帕博利珠单抗(400 mg,Q6w)联合Lenvatinib(20 mg,Qd)治疗,或接受标准的三线治疗,即(研究者选择)瑞戈非尼(160 mg Qd,Q4w)或TAS-102(35 mg/m2,Q4w),进行头对头的比较,这是个令人期待的MSS肠癌三线免疫治疗研究。
总之,随着科学技术水平的提高、基础和临床研究的发展,相信以PD-1单抗为代表的免疫治疗将给肠癌的患者带来更多新的应用场景。这有赖于科学家、临床医生和企业的无缝合作。
专家所提及的2021 ESMO最新公布的研究的详细数据罗列如下,以飨读者:
Abstract 432P:Pembrolizumab for previous treated, microsatellite instability-high/mismatch repair-deficient advanced colorectal cancer: final analysis of KEYNOTE-164
KEYNOTE-164终期分析:帕博利珠单抗治疗经治的MSI-H/dMMR mCRC
研究背景:帕博利珠单抗在美国获批用于既往接受治疗进展后且无合适治疗选择的MSI-H/dMMR实体瘤的2L治疗。Ⅱ期KEYNOTE-164研究提示帕博利珠单抗在既往接受过≥2线(队列A)和接受过≥1线(队列B)的晚期MSI-H/dMMR结直肠癌患者中显示出持久的获益和可控的安全性。本次将呈现KEYNOTE-164最终分析的疗效和安全性数据,是在首次分析后增加29.6个月的随访时间。
研究方法:研究纳入既往接受过治疗的局晚期不可切或转移性MSI-H/dMMR结直肠癌患者,接受帕博利珠单抗200 mg Q3w(≤35周期)治疗。疾病状态评估为SD或更佳者在疾病进展时可接受第二阶段帕博利珠单抗治疗(≤17周期)。主要研究终点是ORR,次要研究终点是DOR,DCR,PFS和OS。
研究结果:队列A和队列B首剂给药至数据截止的中位时间为62.2个月(60.8-65.2)和54.4个月(52.7-56.7)。队列A 纳入61例患者(100%为M1期,44.3%既往接受≥3L治疗);队列B纳入63例患者(93.7%为M1期,30.2%既往接受≥3L治疗)
●队列A的ORR分别为32.8%(95%CI,21.3-46.0;3 CR/17 PR);1例患者由初始评估为PR转为CR;队列B的ORR为34.9%(95%CI,23.3-28.0;9CR/13PR);较初始评估,增加4例CR;
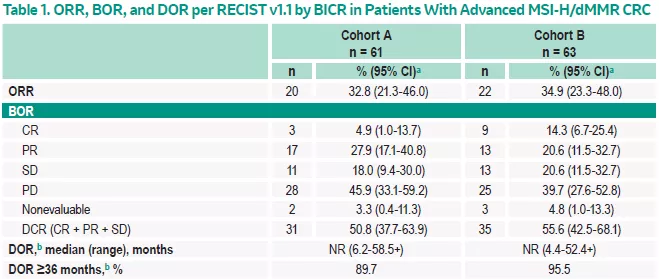
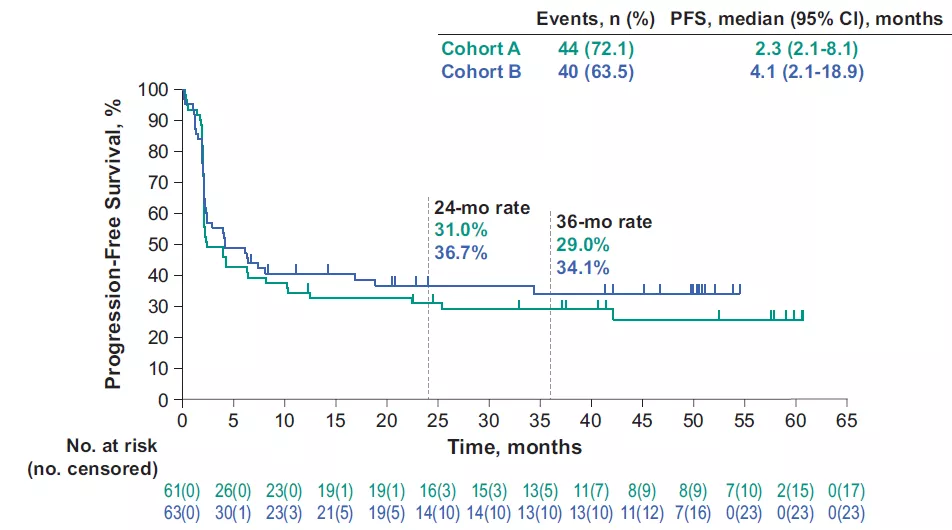
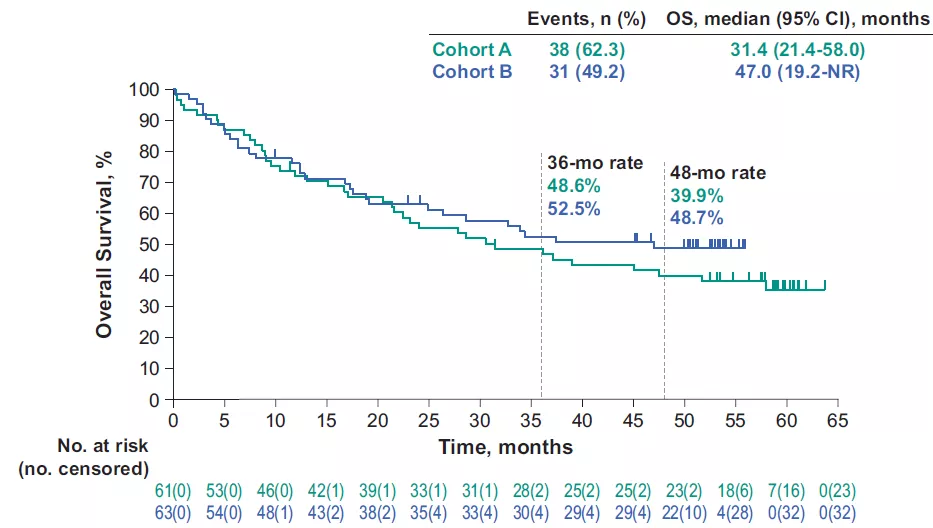
●队列A和队列B的中位PFS为2.3个月(95%CI,2.1-8.1)和4.1个月(95%CI,2.1-18.9);中位OS分别为31.4个月(95%CI,21.4-58.0)和47个月(19.2-NR);
●共有9例患者在PD并中断Pembro后接受Pembro治疗。队列A中有4患者完成了17个周期的治疗,2例患者中断治疗(1例因PD,1例因3级结肠炎);队列B中有2例患者完成治疗,1例因PD而中断治疗。每个队列中各有1例在第一和第二阶段均达到PR,第二阶段PR在开始第二阶段治疗后2个月达到 [中位第二阶段SD持续时间分别为12.07个月和20.4个月(4.1-20.5)] 。队列A和队列B在第二阶段治疗中分别有4例和2例SD[ 中位第二阶段SD持续时间为13.7个月(4.1-20.5)] 。
● TRAE发生率分别为64%和71%,3/4级TRAE发生率分别为16%和13%;未见5级TRAE;免疫相关AE和注射反应发生率分别为21%和38%。
研究结论:Pembro显示出持久的抗肿瘤活性,可延长既往及受过治疗的晚期MSI-H/dMMR CRC患者的OS,且安全性可控。第二治疗治疗数据提示经Pembro治疗后发生PD,部分患者重启Pembro后仍可见临床获益。
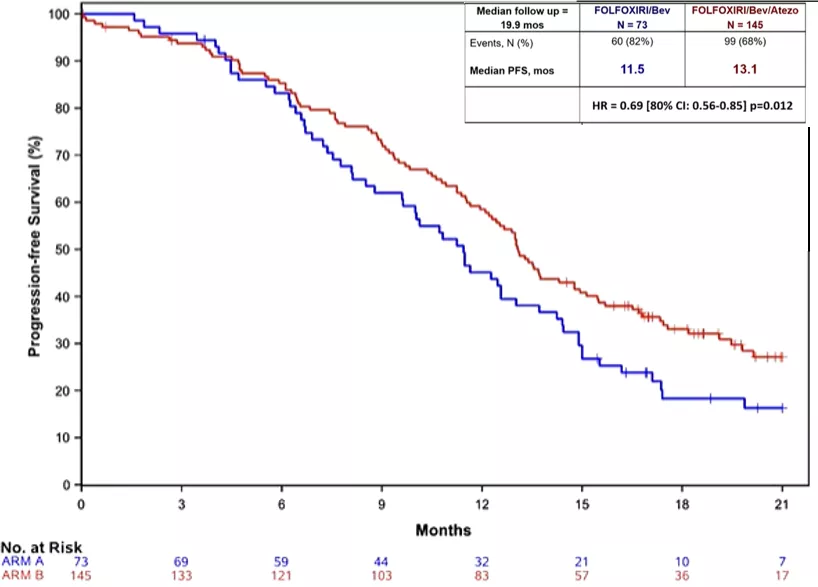
LBA20:FOLFOXIRI plus bevacizumab(Bev) plus atezolizumab(Atezo) versus FOLFOXIRI plus bev as first-line treatment of unresectable metastatic colorectal cancer(mCRC) patients: results of the phase Ⅱ randomized AtezoTRIBE study by GONO
研究方法:AtezoTRIBE是一项前瞻性、开放标签、II期对比试验,初始无法切除的mCRC患者(无论MMR状态)经随机1:2分组,分别接受8个周期的FOLFOXIRI/bev(A组)或FOLFOXIRI/bev/atezo(B组)→5-FU/bev或5FU/bev/atezo维持治疗,直到疾病进展。主要研究终点为PFS。
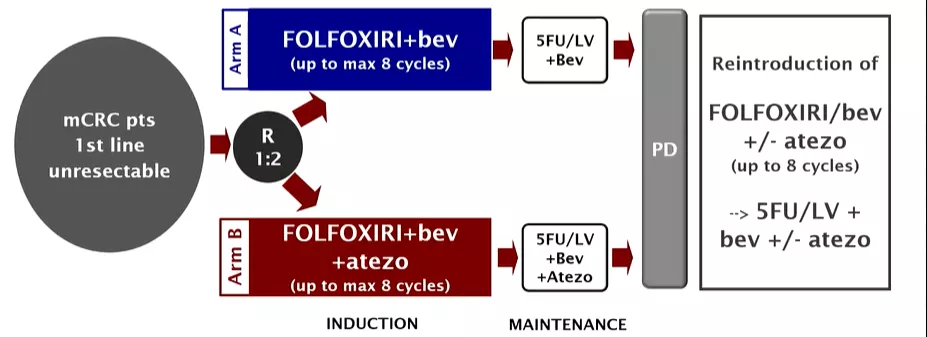
研究结果:从2018年11月到2020年2月,研究入组218例患者 (A/B组:73/145)。主要患者特征为(A/B组):右半肿瘤44%/44%,同步转移89%/86%,仅肝脏转移22%/22%,RASmt 71%/73%,BRAFmt 14%/8%,dMMR 7%/6%。
●中位随访时间为19.9个月(159个PFS事件,A/B组:60/99)。A组和B组的PFS分别为11.5和13.1个月(HR=0.69,80%CI 0.56-0.85,p=0.012);OS数据尚未成熟。
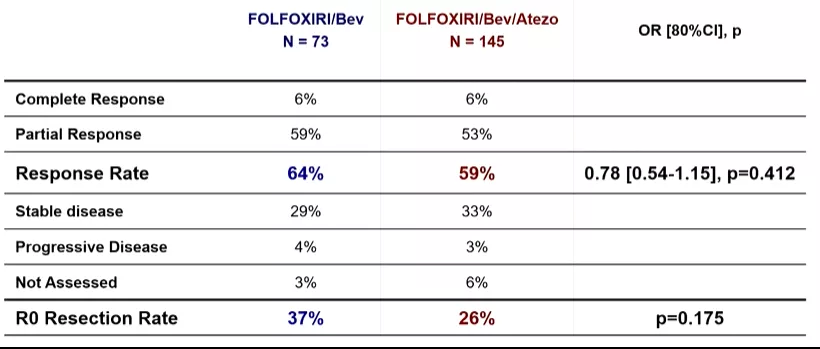
●ORR分别为64%和59%(OR=0.78,80%CI 0.54-1.15,p=0.412)
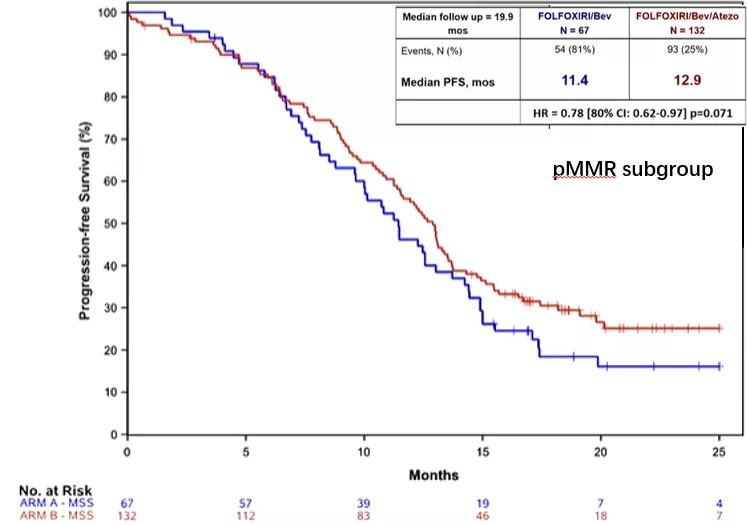
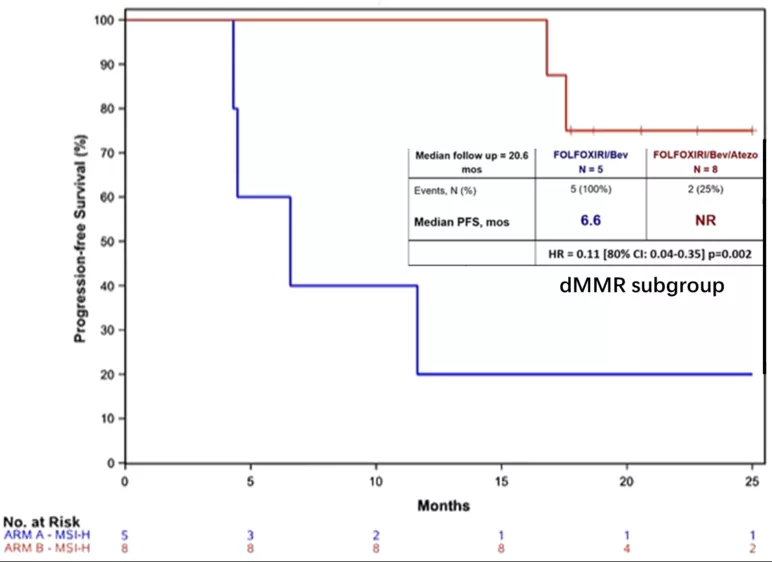
● 在dMMR亚组中(N=13,A/B组:5/8),A组和B组PFS分别为6.6个月和NR(HR 0.11,80% CI 0.04-0.357,p=0.002);在pMMR亚组中(N=199,A/B组:67/132),共147例(A/B组:54/93)PFS事件。B组较A组的PFS显著延长,分别为12.9个月和11.4个月(HR 0.78,80% CI 0.62-0.97,p=0.071)。
●两组3/4级不良反应发生情况相似,3/4级irAE发生率分别为1%和3%。
研究结论:该研究达到了主要研究终点:在FOLFOXIRI/bev中添加atezo可延长mCRC患者的PFS。虽然dMMR肿瘤的获益程度明显更高,但pMMR亚组也显示疗效信号。
506TiP:Pembrolizumab plus Lenvatinib versus standard of care for previously treated metastatic colorectal cancer: phase 3 LEAP-017 study
Ⅲ期LEAP-017研究:帕博利珠单抗联合仑伐替尼对比SOC治疗既往经治的转移性结直肠癌
研究设计:LEAP-017研究纳入年龄≥18岁,组织学/细胞学确认的非MSI-H/dMMR,不可切或转移性的Ⅳ期mCRC。患者经1:1随机分配分别接受帕博利珠单抗(400 mg,Q6w)联合Lenvatinib(20 mg,Qd)治疗或者接受(研究者选择)瑞戈非尼(160 mg Qd,Q4w)或TAS-102(35 mg/m2,Q4w)治疗。分层因素为是否伴肝转移。帕博利珠单抗持续应用两年,仑伐替尼在应用两年后可根据临床获益情况持续应用,直至发生疾病进展、不可耐受毒性或研究者/患者决定。
主要研究终点是OS,次要研究终点是PFS、ORR和DOR(RECIST v1.1,BICR)、安全性和耐受性(CTCAE v5.0)、基线评分改变和疾病恶化时间、身体功能、食欲减退和腹胀恶化的变化(EORTC QLQ-C30和EORTC QLQ-CR29)。探索终点包括健康状态(EQ-5D-5L)。
该研究计划入组434例患者。
审批号:MI-PD1-1976-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多