查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2021年5月,《自然回顾·胃肠肝素》(Nature Review Gastroenterol Hepatol)发表的关于分子免疫治疗时代下肝细胞癌局部区域治疗的文章,笔者将此文章分为多个部分进行梳理和翻译,以飨读者。本篇为第三部分。

中期肝细胞癌(HCC) 的局部治疗方法包括经动脉栓塞(TAE)、常规化疗栓塞(cTACE)、载药微球化疗栓塞 (DEB-TACE) 和经动脉放射栓塞 (TARE)(图 1)。
在两项以总生存(OS)期为主要终点的 RCT 发表后,化疗栓塞被确立为中期 HCC 的标准治疗,随后的荟萃分析显示了与最佳支持治疗或次优治疗疗法相比的生存获益。
作为这些研究的结果,多个肿瘤学术组织的指南和共识中建议, 对患有中期 HCC[巴塞罗那临床肝癌 (BCLC) B 期]的 HCC 患者推荐进行化疗栓塞,定义为无症状患者的肝脏局限型多结节病灶(体力状态为 0),Child-Pugh A 级或 B 级肝硬化,无失代偿,无门静脉侵犯或肝外转移。TACE 的正式技术和禁忌证随后得到了完善。
从那时起,已经报道了几项 Ⅲ 期试验,将化疗栓塞作为标准治疗,但没有一项试验显示出联合疗法或替代局部区域方法具有更优的生存获益(表 2,图 2)。
传统的 TACE 和 DEB-TACE 显示类似的结果,可以互换使用。大多数指南建议,一旦出现 TACE 难治性(定义为两次手术后未能达到客观缓解),就开始全身治疗。亚太肝病研究协会年会(APASL) 指南将 TACE 失败或难治性定义为:两次或多次 TACE 手术后 >50% 的存活肿瘤;连续两次或多次 TACE 手术后出现新肿瘤;或晚期 HCC的TACE后肿瘤标志物持续升高。尽管如此,在临床实践中,转向全身治疗的模式非常多样化。
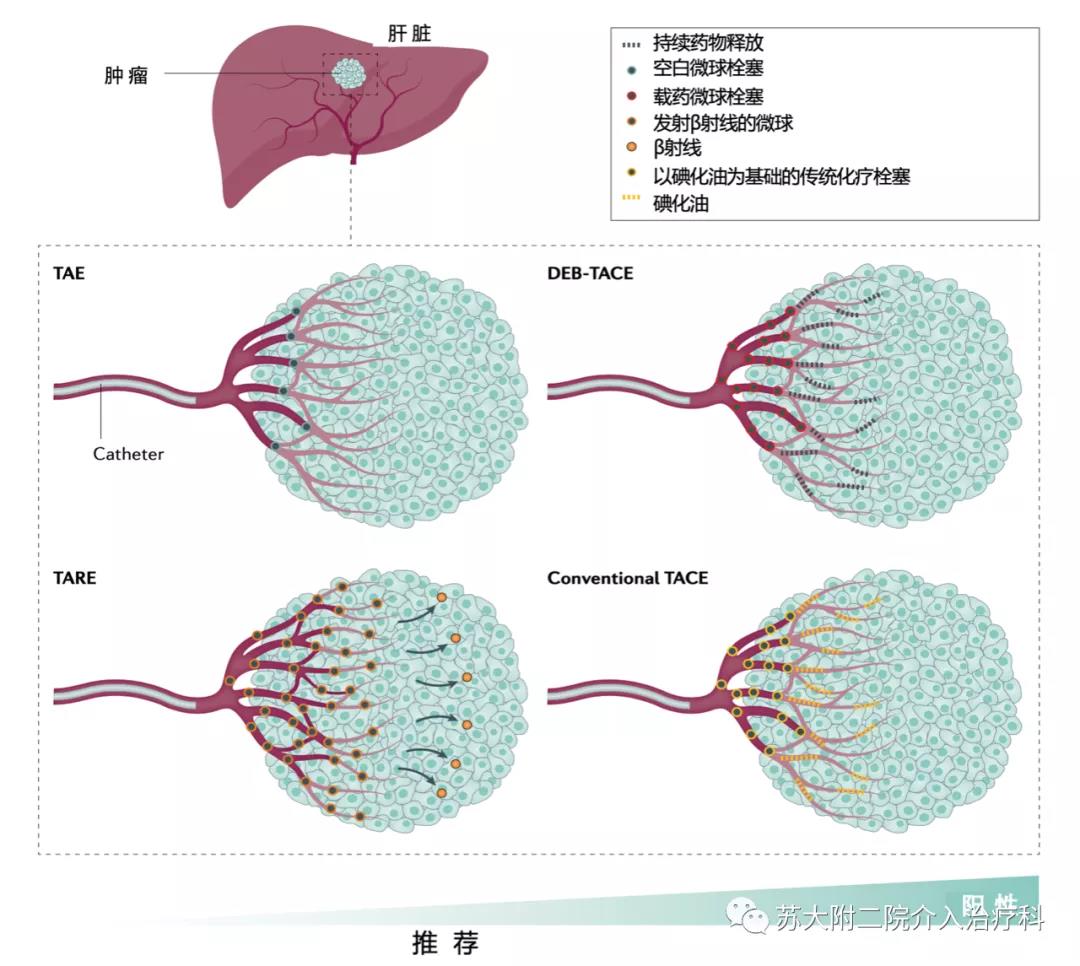
图1 动脉内治疗 动脉内治疗肝细胞癌(HCC)的技术说明。经动脉栓塞(TAE)旨在阻断肿瘤的动脉血供,导致肿瘤缺血,而经动脉化疗栓塞(TACE)则在阻断供血动脉之前释放抗肿瘤药物。已经出现了两种进行TACE的技术:传统的TACE,其中细胞毒性药物用碘化油混合后注入肿瘤,随后动脉血管栓塞;和载药微球TACE(DEB-TACE),其中携带阿霉素的微球被输送到靶部位,实现持续的药物递送,然后进行栓塞。经动脉放射栓塞(TARE)是TACE的放射治疗类似物,其中载钇-90微球沉积用于局部进行β-射线辐射。该方法已应用于所有HCC阶段。
根据在晚期HCC患者中测试免疫检查点抑制剂的研究结果,许多研究机构已经启动了单独或与局部区域疗法联合测试免疫检查点抑制剂在BCLC早期和中期疾病患者中的临床试验。
目前,抗 PD-1(纳武利尤单抗、帕博利珠单抗、纳武利尤单抗+伊匹木抵抗)和抗PD-L1(阿特利珠单抗,联合抗VEGF药物贝伐珠单抗)治疗已获批用于晚期 HCC。目前尚不清楚抗PD-1抗体是否比抗PD-L1抗体更有效。
理论上,人们会假设抗 PD-1 抗体可以阻断PD-1与其配体(PD-L1 和 PD-L2)的结合,而 PD-L1 抗体只会抑制PD-1 与 PD-L1 的结合,因此,效果较差。
一项对涉及 11,379 例癌症患者的 19 项 RCT 的荟萃分析显示,与接受抗 PD-L1 治疗的患者相比,接受抗 PD1 治疗的患者的总生存期在统计学上显著更高,但该研究不包括 HCC患者。免疫检查点抑制剂在辅助治疗和新辅助治疗中均进行了测试,以解决不同的问题。
免疫检查点抑制剂对肿瘤负荷低的患者是否更有效?
辅助免疫检查点抑制剂能否改善 RFA 治疗后患者的预后?
与血管靶向剂(如贝伐珠单抗、索拉非尼或乐伐替尼)联合使用是否更好?
消融前新辅助治疗的效果是什么?
最后,是否有可能使用免疫检查点抑制剂和不太常用的消融技术来治疗直径大于 3 cm 的肿瘤患者?
乍一看,这些概念中的大多数可能与目前正在接受手术切除的患者中研究的概念非常相似,但在接受消融的患者中观察到的许多免疫学效应在接受切除的患者中是看不到的。
尽管迄今为止,免疫检查点抑制剂主要用于晚期疾病患者,但也有充分的理由将它们用于可根治性患者。根据多项研究结果,免疫检查点抑制剂的临床疗效似乎与肿瘤负荷相关。
其他类型癌症的回顾性研究,如黑色素瘤和肾细胞癌。免疫检查点抑制剂可能对微转移残留病灶更有效,这种情况也见于消融后具有小肿瘤的HCC 患者。迄今为止,在辅助治疗中接受检查点抑制剂治疗的早期 HCC(BCLC-0 或 BCLC-A 期)患者的数据非常有限,因为这些试验中的大多数是在过去 2~3 年开始招募的。
然而,一项在手术前使用纳武利尤单抗+伊匹木单抗的新辅助研究提供了初步数据。研究人员描述了 9 例患者的病理完全缓解(pCR)率为 33.3%,并显示与治疗前相比,治疗后T细胞浸润增加,组织中细胞毒性和效应记忆细胞标志物上调。
几项研究表明,消融疗法本身可能有助于在 HCC患者中引发抗原特异性CD4+和CD8+ T细胞(图 3)。这种效应不仅限于T细胞,RFA 也显示了激活自然杀伤 (NK) 细胞反应。
有趣的是,那些具有更好NK细胞反应的患者也表现出更好的临床结果。所有这些研究都是在免疫检查点抑制剂尚未获得批准和商业化的时候进行的,研究免疫检查点抑制剂联合RFA的新辅助或辅助治疗患者的免疫反应和肿瘤特异性免疫将会很有趣。热消融诱导各种与肿瘤抗原释放无关的生物效应,包括诱导促炎细胞因子(IL-1β、IL-6、IL-8 和 TNF)。
经证实,RFA 后人肝活检材料和肝癌患者血清中 HSP70(一种应激诱导蛋白)的水平显著高于基线值。虽然升高的 HSP70 血清水平与接受 RFA治疗的患者更好的生存相关,但来自大鼠临床前研究的数据表明,周围消融的HSP70 可以刺激远处肿瘤生长。
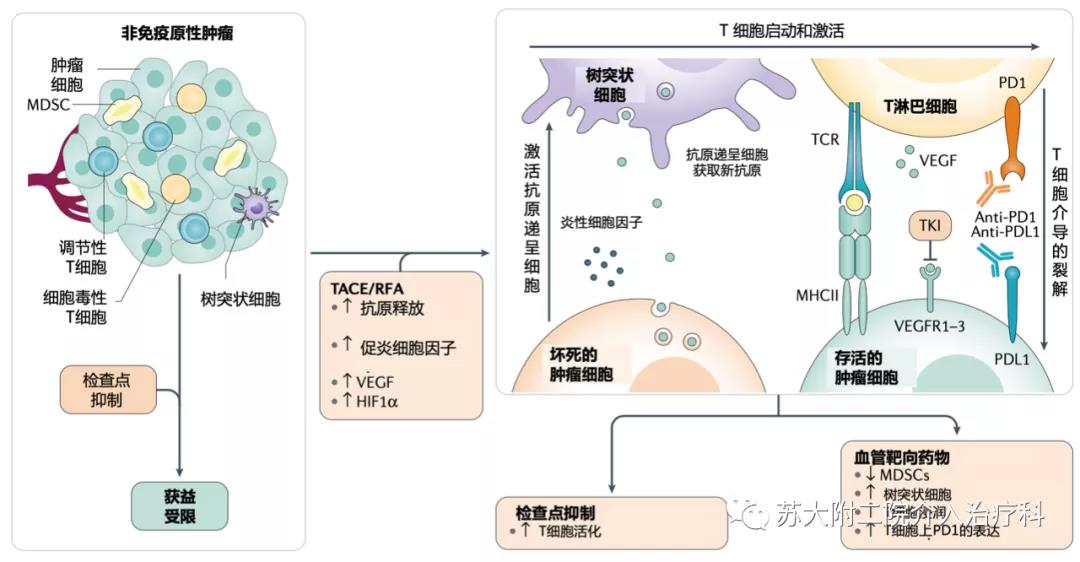
图3 将局部治疗与免疫治疗相结合的基本原理。 肝细胞癌 (HCC) 的局部治疗可以通过改变肿瘤微环境的组成来塑造抗肿瘤免疫。通过经皮热消融技术或局部治疗,肿瘤细胞坏死导致肿瘤新抗原释放,促进树突状细胞募集和激活到微环境中。这种效应可用于将不利于检查点抑制剂治疗的免疫抑制微环境转变为免疫活化环境,在这种环境中全身治疗可能更有效。MDSC,骨髓源性抑制细胞; MHCII,主要组织相容性复合体 II 类; RFA,射频消融; TACE,经动脉化疗栓塞;TKI,酪氨酸激酶抑制剂。
编译者述评:
对于中期肝癌,已经将TACE作为标准治疗,但没有一项试验显示出联合疗法或其他替代方法具有更优的生存获益。
传统的 TACE 和 DEB-TACE 显示类似的结果,可以互换使用。
大多数指南建议,一旦出现 TACE 难治性(定义为两次手术后未能达到客观反映),就开始全身治疗。
APASL 指南将 TACE 失败或难治性定义为:两次或多次 TACE 手术后 >50% 的存活肿瘤;连续两次或多次 TACE 手术后出现新肿瘤;或晚期 HCC的TACE后肿瘤标志物持续升高。尽管如此,在临床实践中,转向全身治疗的模式非常多样化。
免疫检查点抑制剂可能对微转移残留病灶更有效,这种情况也见于消融后具有小肿瘤的HCC 患者。
编译作者简介:
靳勇
苏州大学附属第二医院介入科主任、主任医师、医学博士、博士生导师、中国医师协会介入医师分会全国委员、中国抗癌协会肿瘤消融治疗委员会常委、中国抗癌协会肿瘤介入治疗委员会委员、中国抗癌协会肺癌微创综合治疗委员会副主任委员、科技部创新产业联盟肺癌消融委员会候任主任委员
苏大附二院介入治疗科 平台
查看更多