查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者信息:
福州 福建省肿瘤医院 福建医科大学附属肿瘤医院胸部肿瘤内科
吴 标,庄 武,黄 诚,郑晓彬,尹 一,张 晶,蒋 侃,苗 茜
【摘 要】 目的 探讨间变性淋巴瘤激酶(ALK)融合基因阳性晚期肺腺癌经克唑替尼治疗失败后不同治疗方案的效果和不良反应。方法 收集本院 2014 年 1 月至 2017 年 10 月诊治的 ALK 融合基因阳性经克唑替尼治疗耐药的晚期肺腺癌患者 65 例,其中接受 ALK 抑制剂治疗 13 例,全身化疗 52 例(培美曲塞联合铂类 23 例、紫杉醇联合铂类 10 例、长春瑞滨联合铂类 3 例、吉西他滨联合铂类 5 例、培美曲塞单药 5 例和多西他赛单药 6 例),2 个周期后分别采用 RECIST 1. 1 版与 NCI-CTC4. 0 版标准评价疗效和不良反应,根据随访数据分析不同治疗方案的预后情况。结果 全组均可评价疗效,客观有效率(RR)为 46. 2%,疾病控制率(DCR)为 73. 8%。使用 2 代 ALK 抑制剂者的 RR 优于全身化疗者(76. 9% vs. 38. 5%,P = 0. 013);全身化疗者中,含培美曲塞方案的 RR 优于不含培美曲塞方案(53. 6% vs.20. 8%,P = 0. 016),含铂方案的 DCR 优于不含铂单药治疗(80. 5% vs.36. 4%,P= 0.013)。全组中位无进展生存期(PFS)为 4. 0 个月(95%CI:3. 2 ~ 4. 8 个月),使用 2 代 ALK 抑制剂者的中位PFS 为 10. 0 个月,优于全身化疗者的 4. 0 个月(P= 0. 003)。全组中位总生存期(OS)为 19. 0 个月(95%CI:17. 4 ~ 20. 6个月),使用 2 代 ALK 抑制剂者的中位 OS 为 25. 0 个月,优于全身化疗者的 18. 5 个月(P = 0. 012);EGOG 评分 0 ~ 1 分的中位OS 为 19. 5 个月,优于 2 分的 17. 0 个月(P = 0. 004);临床分期为ⅢB 期的中位 OS 为 26. 5 个月,优于Ⅳ期的 18. 5 个月(P =0. 046)。结论 ALK 融合基因阳性晚期肺腺癌患者克唑替尼耐药后,给予 2 代 ALK 抑制剂的治疗效果较好,EGOG 评分 0 ~ 1分和临床分期ⅢB 期患者的生存期更长。
【关键词】 肺腺癌; 间变性淋巴瘤激酶(ALK); 化学治疗; 药物耐药
Clinical efficacy of regimens in patients with anaplastic lymphoma kinase fusion gene-positive pulmonary adenocarcinoma of acquired crizotinib resistance
WU Biao,ZHUANG Wu,HUANG Cheng,ZHENG Xiaobin,YIN Yi,ZHANG Jing,JIANG Kan,MIAO Qian.
Department of Thoracic Oncology,Fujian Cancer Hospital,Cancer Hospital Affiliated to Fujian Medical University,Fuzhou 350014,China
Corresponding author: ZHUANG Wu,E-mail: zhuangwu2008@ 126.com
【Abstract】 Objective To investigate the efficacy of different regimens in patients with anaplasticlymphoma kinase (ALK) fusion gene-positive pulmonary adenocarcinoma of a cquired crizotinib resistance. Methods From January 2014 to October 2017,65 patients with advanced ALK fusion gene-positive pulmonary adenocarcinoma of acquired crizotinib resistance in our hospital were enrolled.According to the treatment regimes,13 cases received ALK inhibitors and remaining 52 cases received systemic chemotherapy,including 23 cases of pemetrexed plus platinum,10 cases of paclitaxel plus platinum,3 cases of vinorelbine and platinum,5 cases of gemcitabine and platinum,5 cases of pemetrexed alone and 6 cases of docetaxel alone. After 2 cycles,the efficacy and adverse reactions were evaluated by RECIST 1. 1 and NCI-CTC 4. 0,and the prognosis of different treatment schemes was analyzed according to the follow-up data. Results All patients were evaluable for efficacy with the objective response rate (ORR) of 46. 2% and the disease control rate (DCR) of 73. 8%. Patints receiving the second generation of ALK inhibitor showed better RR than cytotoxic drugs (76. 9% vs.38. 5%,P= 0. 013). For chemotherapy group pemetrexed-contained regimens had better RR than non-pemetrexed regimens (53. 6% vs. 20. 8%,P= 0. 016),and platinum-contained regimens were better than monotherapy in DCR (80. 5% vs.36. 4%,P= 0. 013). The progression free survival(PFS)and overall survival (OS) of all patients were 4. 0 months(95%CI: 3. 2-4. 8) and 19. 0 months(95%CI: 17. 4-20. 6),respectively. The second generation of ALK inhibitor was better than cytotoxic drugs for PFS (10. 0 months vs. 4. 0months,P= 0. 003) and OS (25. 0 months vs.18. 5 months,P = 0. 012). ECOG 0-1 (19. 5 months vs.17. 0 months,P = 0. 004) and clinical stage ⅢB were favorite factors for OS (26. 5 months vs. 18. 5 months,P= 0. 046) comparing with ECOG 2 and stage Ⅳ,respectively. Conclusion The second generation of ALK inhibitor presented stronger efficacy in ALK-fusiongene positve pulmonary adenocarcinoma patients after the failure of crizotinib. ECOG 0-1 and phase ⅢB patients had longer OS.
【Key Words】 Pulmonary adenocarcinoma; Anaplastic lymphoma kinase(ALK); Chemotherapy; Drug resistance
非 小 细 胞 肺 癌 ( non-small cell lung cancer,NSCLC)是我国常见的恶性肿瘤,多数患者确诊时已属于晚期。近年来,随着分子医学进展及靶向治疗药物的研发,针对特定靶点的个体化治疗成为肿瘤治疗的热点[1]。间变性淋巴瘤激酶( anaplasticlymphoma kinase,ALK)融合基因是 NSCLC 的驱动基因。克唑替尼(Crizotinib)是针对 ALK 融合基因阳性的小分子酪氨酸激酶受体抑制剂,用于晚期ALK 阳性 NSCLC 的一线治疗[2-3]。接受克唑替尼治疗进展后,化疗是这部分患者经常采用的后续治疗方法。近年来,2 代 ALK 抑制剂在克唑替尼耐药后的应用,取得良好效果。关于克唑替尼耐药后治疗方案选择、化疗的最适方案以及治疗效果的影响因素,尚缺乏大规模的前瞻性数据。本研究旨在通过回顾性分析,探讨克唑替尼治疗失败后不同治疗方案的疗效和毒副反应,现将结果报告如下。
1 资料与方法
1. 1 一般资料 收集 2014 年 1 月至 2017 年 10 月福建省肿瘤医院诊治的 ALK 融合基因阳性经克唑替尼治疗耐药的晚期肺腺癌患者 65 例,其中男性36 例,女性 29 例;中位年龄 54 岁(41 ~ 65 岁);有吸烟史 23 例,无吸烟史 42 例;ECOG 评分 0 ~ 1 分 49例,2 分 16 例;ⅢB 期 6 例,Ⅳ期 59 例。
1. 2 入组标准 均经组织学或细胞学证实为肺腺癌;采用荧光原位杂交技术、免疫组化或逆转录聚合酶链反应证实 ALK 融合基因阳性;国际抗癌联盟恶性肿瘤 TNM 分期(第 7 版)NSCLC 分期标准为ⅢB 期或Ⅳ期;经克唑替尼治疗后肿瘤进展;至少有一个可测量的肿瘤病灶;预期生存期大于 3 个 月;ECOG 体力状态评分 0 ~ 2 分;治疗前检查无严重的心血管疾病,血象和肝肾功能检查基本正常。
1. 3 治疗方法 一线克唑替尼治疗进展后治疗情况:2 代 ALK 抑制剂 13 例,全身化疗 52 例(培美曲塞联合铂类 23 例、紫杉醇联合铂类 10 例、长春瑞滨联合铂类 3 例、吉西他滨联合铂类 5 例、培美曲塞单药 5 例和多西他赛单药 6 例)。药物使用剂量:培美曲塞 500 mg /m2 静滴,d1 ;紫杉醇 150 mg/m2 静滴,d1 ;长春瑞滨 25 mg /m2 静滴,d1、d8 ;吉西他滨 1000mg /m2 静滴,d1、d8 ;卡铂 AUC = 5 静滴,d1 ;顺铂 25mg /m2 静滴,d1 ~ d3。2 代 ALK 抑制剂包括色瑞替尼(Ceritinib,瑞士诺华制药公司产品)750 mg 口服,每日 1 次或布格替尼(Brigatinb,武田药品工业株式会社)最初 7 天 90 mg 每日 1 次口服,若能耐受再加量至 180 mg 每日 1 次口服,持续应用至疾病进展或不可耐受的不良反应。以上方案均为 21 天1个周期,每2个周期进行胸部 CT 等影像学检查评价疗效,治疗期间定期检查血常规、肝肾功能和心电图。
1. 4 疗效评价标准 根据实体瘤疗效评价标准(RECIST) 1. 1 版评价近期疗效,分 为 完 全 缓 解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。以CR+PR 计算客观有效率(RR),以 CR+PR+SD 计算疾病控制率(DCR)。不良反应按美国国立癌症研究所制定的通用药物毒性反应标准(NCI-CTC 4. 0)进行评价,分为 0~4 级。
1. 5 随访 采用电话和门诊的方式进行随访,随访截止时间为 2017 年 11 月。无进展生存期(PFS)是指从克唑替尼耐药后第一次化疗或 2 代 ALK 抑制剂治疗开始到疾病进展或任何原因死亡的时间。总生存期(OS)是指从克唑替尼耐药后第一次化疗或 2 代 ALK 抑制剂治疗开始到到任何原因死亡的时间。
1. 6 统计学分析 采用 SPSS 23. 0 版软件进行统计处理。计数资料的比较采用 χ2 检验,生存分析采用 Kaplan-Meier 法并行 Log-rank 检验。以 P<0. 05为差异有统计学意义。
2 结 果
2. 1 近期疗效 65 例患者均可评价疗效,无 CR 病例,PR 30 例,SD 18 例,PD 17 例,RR 为 46. 2%,DCR 为 73. 8%。单因素分析显示患者的性别、年龄、ECOG 评分、吸烟史与疗效无关(P>0.05);使用2 代 ALK 抑制剂的 RR 为 76. 9%,优于全身化疗的38. 5%,差异有统计学意义(P = 0. 013);全身化疗的52 例患者中,含培美曲塞方案的 RR 优于不含培美曲塞方案(53. 6% vs.20. 8%,P = 0. 016),含铂方案的 DCR 优 于 不 含 铂 方 案 ( 80. 5% vs. 36. 4%,P =0. 013)。52 例全身化疗者中,既往克唑替尼治疗获PR+SD 的 47 例患者的 RR 为 38. 3%,5 例获 PD 患者的 RR 为40.0%,差异无统计学意义(P = 0. 682)。13 例使用 ALK 抑制剂的患者中,既往克唑替尼治疗获 PR+SD 的 11 例患者的 RR 为 81. 8%,2 例获PD 患者的 RR 为 50. 0%,差异无统计学意义(P =0. 423)。见表 1。

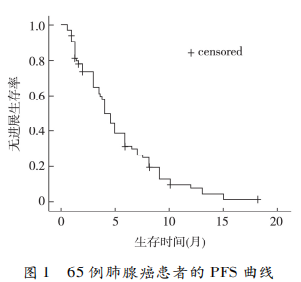
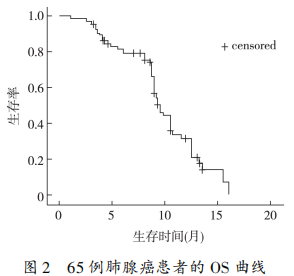
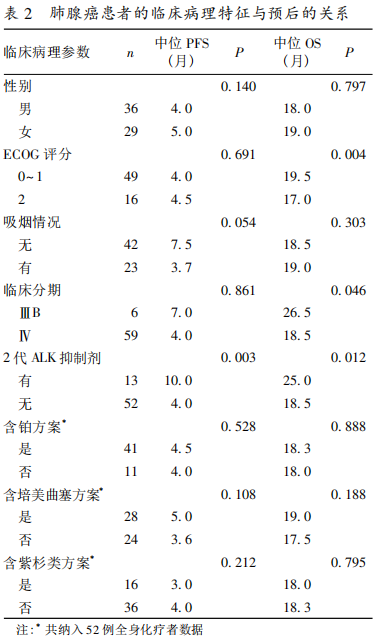
2. 2 症状改善情况 65 例克唑替尼耐药患者,经治疗后有 35 例临床症状得到改善(53. 8%),表现为刺激性咳嗽、乏力好转,胸痛减轻,一般体力状态评分改善和体重增加,症状改善中位时间为 3 周。30例获 PR 者中 25 例症状改善(83. 3%),18 例获 SD者中 8 例症状改善(44. 4%),48 例获 PR+SD 者中33 例症状改善(68. 8%),17 例获 PD 者中 3 例症状改善(17. 6%)。获 PR+SD 者与获 PD 患者相比,症状改善率的差异有统计学意义(P<0. 01)。2. 3 生存情况 截止 2017 年 11 月,全组的中位PFS 为 4. 0 个月(95%CI:3. 2~4. 8 个月),单因素分析显示给予 2 代 ALK 抑制剂治疗者的中位 PFS 为10. 0 个月,优于全身化疗者的 4. 0 个月,差异有统计学意义(P = 0. 003)。患者的性别、ECOG 评分、吸烟史、临床分期和化疗方案对 PFS 无影响。全组的中位 OS 为 19. 0 个月(95% CI:17. 4 ~ 20. 6 个月),EGOG 评分 0 ~ 1 分者的中位 OS 长于 2 分者(19. 5个月 vs. 17. 0 个月,P = 0. 004);临床分期为ⅢB 期的中位 OS 长于Ⅳ期(26. 5 个月 vs.18. 5 个月,P =0. 046);使用 2 代 ALK 抑制剂者的中位 OS 长于全身化疗者(25. 0 个月 vs.18. 5 个月,P = 0. 012)。见图 1、图 2 和表 2。
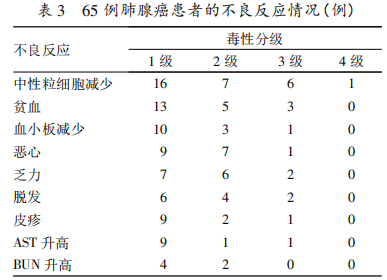
2. 4 不良反应 全身化疗患者最常见的不良反应是骨髓抑制,以 1、2 级中性粒细胞减少最为常见,部分患者表现为 1、2 级贫血和血小板减少。非血液学毒副反应常见的是恶心、乏力、脱发、皮疹、AST 升高和 BUN 升高。2 代抑制剂治疗患者常见的不良反应为腹泻、皮疹、乏力、食欲下降、AST 升高等。全组患者对治疗耐受良好,未发生因不良反应而停药的患者。见表 3。
3 讨 论
ALK 融合基因是肺癌的驱动基因之一,ALK 融合基因阳性的患者约占 NSCLC 的 2% ~ 6%,多为年轻、不吸烟或轻度吸烟的肺腺癌患者,与 EGFR 基因突变、ROS1 基 因 重 排 或 K-Ras 突 变 等 相 互 排斥[4-5]。一项比较克唑替尼与化疗一线治疗 ALK 融合基因阳性晚期 NSCLC 的临床研究显示克唑替尼的疗效显著优于全身化疗,两组的中位 PFS 分别为10. 9 个月和 7. 0 个月,RR 分别为74%和 45%,1 年生存率分别为 84%和 79%[6]。尽管克唑替尼一线治疗晚期 NSCLC 的疗效好,但几乎所有的患者在治疗后均会出现耐药及肿瘤的复发或转移[7]。色瑞替尼、布格替尼和阿雷替尼属于第 2 代 ALK 抑制剂,其结构与克唑替尼不同,不仅对 ALK 融合基因阳性的肺癌细胞具有抑制作用,而且对多种 ALK 激酶区耐药突变也具有活性,能够克服继发性耐药突变。多项 研 究 表 明 ALK 融合基因阳性的晚期NSCLC 患者,克唑替尼治疗进展后给予 2 代 ALK 抑制剂均有良好的抗肿瘤效果,患者耐受性良好,为ALK 融合基因阳性晚期 NSCLC 克唑替尼耐药后的治疗提供一种很好的选择[8-11]。本研究中,13 例接受 2 代 ALK 抑制剂治疗的 RR 为 76. 0%,明显优于52 例全身化疗者。接受 2 代 ALK 抑制剂的中位 OS为 25. 0 个月,优于全身化疗者的 18. 5 个月,差异有统计学意义,提示 1 代 ALK 抑制剂耐药后给予 2 代ALK 抑制剂治疗,可能延长患者的 OS。Ito 等[12]报道了一项回顾性多中心研究提示:克唑替尼治疗后进展的晚期 NSCLC 患者,后续治疗中接受 2 代 ALK抑制剂患者的 OS 优于未使用 2 代 ALK 抑剂者。
培美曲塞是一种多靶点的叶酸拮抗剂,通过抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酸核糖核苷甲酰基转移酶,阻断肿瘤细胞嘧啶和嘌呤的合成,导致肿瘤细胞停止在分裂 S 期,抑制了肿瘤细胞的生长[13]。Shaw 等[14]在一项比较克唑替尼与标准化疗在晚期 ALK 阳性 NSCLC 二线治疗中的Ⅲ期临床研究中发现,培美曲塞二线单药治疗的 RR 为29%,高于多西他赛治疗组的 7%,培美曲塞治疗组的中位 PFS 为 4. 2 个月,优于多西他赛治疗组的2. 6 个月。以上提示 ALK 阳性晚期 NSCLC 接受培美曲塞治疗的效果可能优于多西他赛。本研究中含培美曲塞方案的 RR 优于其他方案(P = 0. 016),但未发现含培美曲塞方案的 DCR、中位 PFS 和 OS优于其他化疗方案。今后需开展临床研究进一步观察。
ECOG 评分和肿瘤临床分期是影响 NSCLC 预后的重要因素。在多个 NSCLC 临床研究中均显示ECOG 评分对 OS 有显著影响,ECOG 评分是 NSCLC的重要预后因素[15]。在本研究中,单因素分析提示EGOG 评分 0 ~ 1 分的中位 OS 为 19. 5 个月,优于EGOG 评分 2 分的 17. 0 个月,差异有统计学意义(P= 0. 004)。ECOG 评分反映患者病情的严重程度、全身状态情况、是否有其他合并症和身体各脏器功能,并且可能影响患者治疗方案选择。ECOG 评分 0~1 分 患 者 的 体 力 状 况 好,可以接受联合化疗。NSCLC 的临床分期是由原发肺癌病变、局部转移淋巴结和远处转移情况决定,因此肺癌临床分期情况可以判定病情早晚,成为影响预后的重要因素[16]。本研究结果显示,ⅢB 期患者的中位 OS 为 26. 5 个月,优于Ⅳ期的 18. 5 个月(P = 0. 046),同样证实了对 ALK 融合基因阳性的 NSCLC 患者,临床分期也是一个重要的预后因素。
综上所述,ALK 阳性晚期肺腺癌克唑替尼耐药后,给予 2 代 ALK 抑制剂的疗效较好,EGOG 评分 0~1 分和临床分期ⅢB 期的 OS 更长。
参考文献
[1] Saito M,Suzuki H,Kono K,et al. Treatment of lung adenocarcinoma by molecular-targeted therapy and immunotherapy[J]. Surg Today,2018,48(12):1-8.
[2] Kris MG,Johnson BE,Berry LD,et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J].JAMA,2014,311(19):1998-2006.
[3] 孙 霞,魏 嘉,刘宝瑞. EML4-ALK 阳性表达非小细胞肺癌患者的临床特征及治疗现状[J]. 临床肿瘤学杂志,2013,18(1):78-81.
[4] Gridelli C,Peters S,Sgambato A,et al. ALK inhibitors in the treatment of advanced NSCLC[J]. Cancer Treat Rev,2014,40(2):300-306.
[5] Peters S,Taron M,Bubendorf L,et al. Treatment and detection of ALK-rearranged NSCLC[J]. Lung Cancer,2013,81(2):145-154.
[6] Solomon BJ,Mok T,Kim DW,et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J]. N Engl J Med,2014,371(23):2167-2177.
[7] Choi YL,Soda M,Yamashita Y,et al. EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors[J]. N Engl J Med,2010,363(18):1734-1739.
[8] Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer[J]. N Engl J Med,2014,370(13):1189-1197.
[9] Muller IB,De Langen AJ,Honeywell RJ,et al. Overcoming crizotinib resistance in ALK-rearranged NSCLC with the second-generation ALK-inhibitor ceritinib[J]. Expert Rev Anticancer Ther,2016,16(2):147-157.
[10] Shaw AT,Gandhi L,Gadgeel S,et al. Alectinib in ALK-positive,crizotinib-resistant,non-small-cell lung cancer: a single-group,multicentre,phase 2 trial[J]. Lancet Oncol,2016,17(2):234-242.
[11] Kim DW,Tiseo M,Ahn MJ,et al. Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer: A randomized,multicenter phase Ⅱ trial[J]. J Clin Oncol,2017,35(22):2490-2498.
[12] Ito K,Hataji O,Kobayashi H,et al. Sequential therapy with crizotinib and alectinib in ALK-rearranged non-small cell lung cancer-A multicenter retrospective study[J]. J Thorac Oncol,2017,12(2):390-396.
[13] Lu Y,Cheng J,Lin Z,et al. Pharmacoeconomic analysis for pemetrexed as a maintenance therapy for NSCLC patients with patient assistance program in China[J]. J Med Econ,2018,21(1):60-65.
[14] Shaw AT,Kim DW,Nakagawa K,et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med,2013,368(25):2385-2394.
[15] Finkelstein DM,Ettinger DS,Ruckdeschel JC. Long-term survivors in metastatic non-small-cell lung cancer: an Eastern Cooperative Oncology Group Study[J]. J Clin Oncol,1986,4(5):702-709.
[16] Jin GL,Chang YL,Kim DJ,et al. Non-small cell lung cancer with ipsilateral pulmonary metastases: prognosis analysis and staging assessment[J]. Eur J Cardio-thorac Surg,2008,33(3):480-484.
查看更多