查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






非酒精性脂肪性肝病(NAFLD)是一种慢性疾病,在组织学上可分为非酒精性脂肪肝和非酒精性脂肪性肝炎(NASH),最终可能导致肝硬化和肝癌的发生[1]。NAFLD目前影响全球约25%的成年人口,被认为是肝脏相关发病率和死亡率最突出的原因之一[2-3]。最近对NAFLD的研究认为代谢功能障碍与该病的复杂机制密切相关,并且国际专家们达成共识,提议将NAFLD改为代谢相关脂肪性肝病[4]。由于代谢紊乱是NAFLD发生发展的重要危险因素,脂质和糖代谢在NAFLD中的作用也越发受到重视。近年来发现,胆汁酸可作为信号分子激活相应受体,发挥调节代谢和炎症反应的作用,参与NAFLD的发展,并指出了胆汁酸水平和胆汁酸信号传导失调与NASH的相关性[5-6]。武田G蛋白偶联受体5(Takeda G protein-coupled receptor 5,TGR5)作为主要的胆汁酸受体之一,可通过调节代谢和炎症过程等多方面参与NAFLD的发展,本文针对TGR5介导的糖脂代谢在NAFLD中的研究进展进行综述。


NAFLD的发病机制复杂,对发病机制的认知逐渐从“二次打击”学说进展到“多次打击”学说,其中以胰岛素抵抗(IR)为核心的糖脂代谢紊乱与NAFLD的关系不可忽视。IR不仅造成葡萄糖的利用和摄取下降,而且还引起了血清游离脂肪酸(free fatty acid,FFA)的增加,导致肝脏对FFA的摄取增加,过量摄取的脂质促使肝脏内脂质代谢失衡,持续积累的脂质促进肝脂肪变。而FFA可通过激活NF-κB通路和诱导胰岛β细胞凋亡引发IR,两者的恶性循环加剧NAFLD的进展[7]。


TGR5又称M-BAR或Gpbar1,于2002年经Maruyama等[8]发现,属于跨膜G蛋白偶联受体家族中的一员,可与细胞外配体结合后将细胞外信号转导至胞内下游级联,通过多种信号传导途径在机体的物质能量代谢、炎症反应、癌症干预和治疗中发挥重要作用[9]。TGR5在体内广泛存在,在胆囊、回肠、结肠、棕色脂肪组织、脾脏、肺、骨骼肌、胰岛中均有表达[10-11]。TGR5也在肝脏表达,既往认为仅在肝间质细胞,即肝窦内皮细胞和Kupffer细胞中表达,最新研究[9, 12]表明TGR5可在小鼠肝细胞中低表达。胆汁酸是TGR5的内源性激动剂,其中牛磺酸的作用效力最强,其次是甘氨酸、石胆酸、脱氧胆酸、鹅脱氧胆酸和胆酸[13-14]。各部位TGR5被激活后通过不同的分子机制参与糖脂代谢的过程,可在防止肝脂肪变性和抑制NAFLD的进展方面发挥重要作用。


TGR5在维持葡萄糖稳态和胰岛素敏感性方面上的效果已得到广泛证明。例如,使用TGR5激动剂6α-乙基-23(S)-甲基-胆酸(6α-ethyl-23(S)-methyl-cholic acid,INT-777)可以提高肥胖小鼠的胰岛素敏感性[15],7-硫酸胆酸以TGR5依赖性方式增加胰岛素抵抗小鼠的葡萄糖耐量等[16]。机体各组织的TGR5可通过不同的分子机制参与血糖代谢的调节。
TGR5对于血糖代谢的作用,主要与肠促胰岛素释放相关,通过刺激肠内分泌L细胞分泌GLP-1来实现(图 1)。既往研究[17]已经发现,GLP-1可促进胰岛素分泌,促进胰岛β细胞存活和增殖,抑制细胞凋亡,并且可有效刺激2型糖尿病患者的胰岛素分泌并降低血糖。早期观点认为TGR5被激活后刺激肠内分泌L细胞内cAMP水平增加,线粒体氧化磷酸化增加,ATP/ADP比例增加,导致ATP依赖性钾离子通道(KATP)关闭,开放钙离子通道,促进钙离子内流,释放GLP-1[15]。但后续有研究[18]验证了GLP-1的分泌确实与cAMP升高,胞内钙离子升高有关,但与ATP依赖性钾离子通道无关。Brighton等[19]的实验进一步验证了GLP-1分泌与L细胞内的cAMP和Ca2+浓度变化有关,并且说明了该作用主要由位于基底外侧L细胞膜上的TGR5介导。最近,Goldspink等[20]发现肠L细胞上的TGR5被激活后,通过cAMP/PKA途径,开放了L型Ca2+通道,促进Ca2+内流,引发GLP-1分泌。
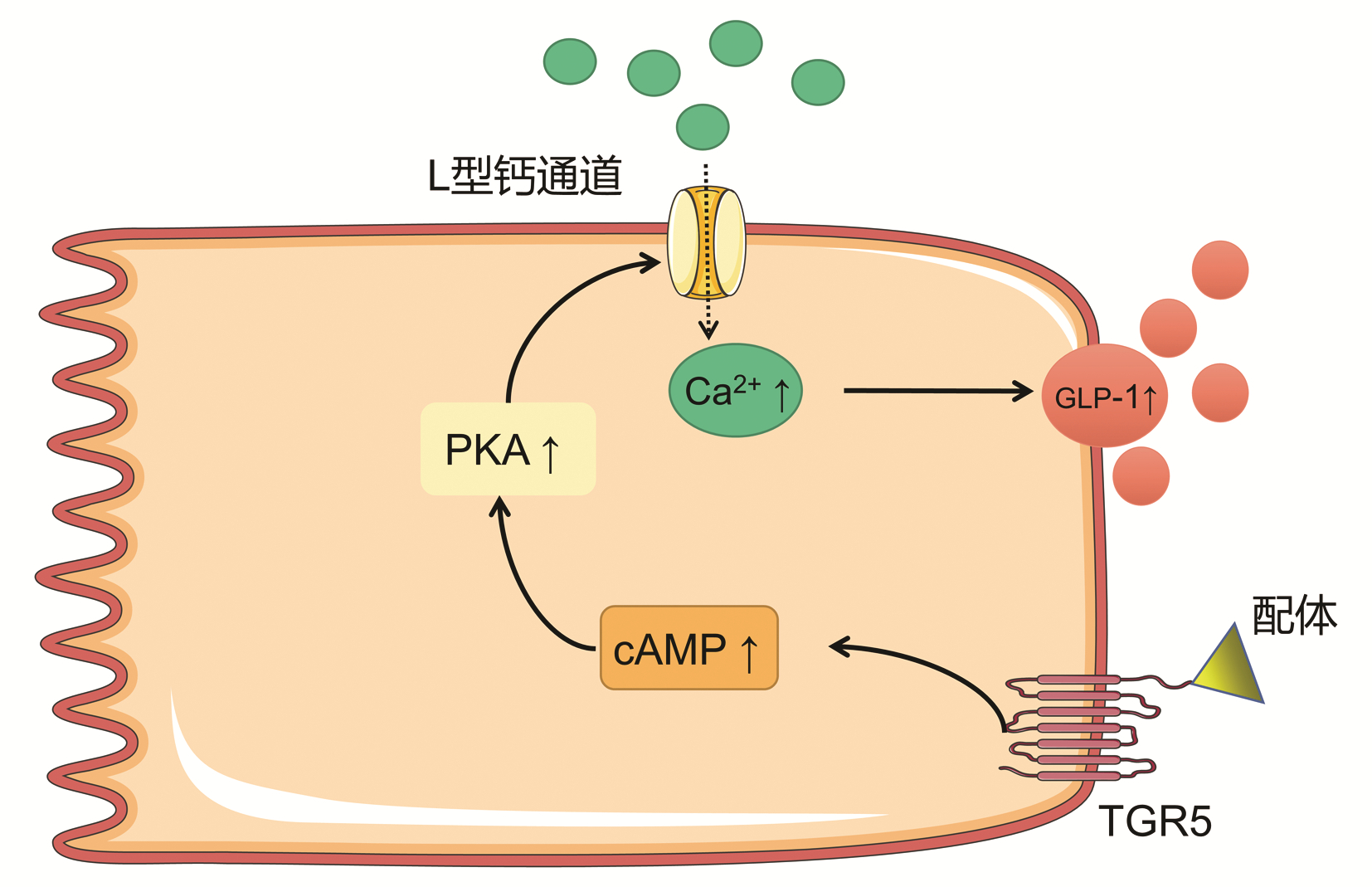
图 1 TGR5调节肠道L细胞分泌GLP-1的机制
除通过TGR5介导的肠道释放GLP-1间接刺激胰岛素分泌外,胰岛细胞上存在的TGR5被激活后可直接引起胰岛素分泌的增加,参与血糖代谢的过程(图 2)。早期有研究[11]认为胰岛素释放依赖于Gαs/cAMP/Epac/Ca2+途径,即胆汁酸激动胰腺β细胞上的TGR5,激活与其偶联的Gαs,刺激腺苷酸环化酶活性并导致细胞内cAMP增加,进一步激活cAMP依赖性Epac/PLC-ε通路,胞内Ca2+增加,引起胰岛素分泌增加。但另有研究则阐述了不同的传导机制,Vettorazzi等[21]发现胆汁酸牛磺熊去氧胆酸通过cAMP/PKA途径增加胰岛素分泌,并且此途径不涉及Ca2+信号或KATP通道活性。Maczewsky等[22]的研究则进一步验证了cAMP/PKA途径,但与之前的研究不同,其结果表明KATP通道关闭和电压依赖性钙通道激活共同导致Ca2+增加,胰岛素分泌增加。
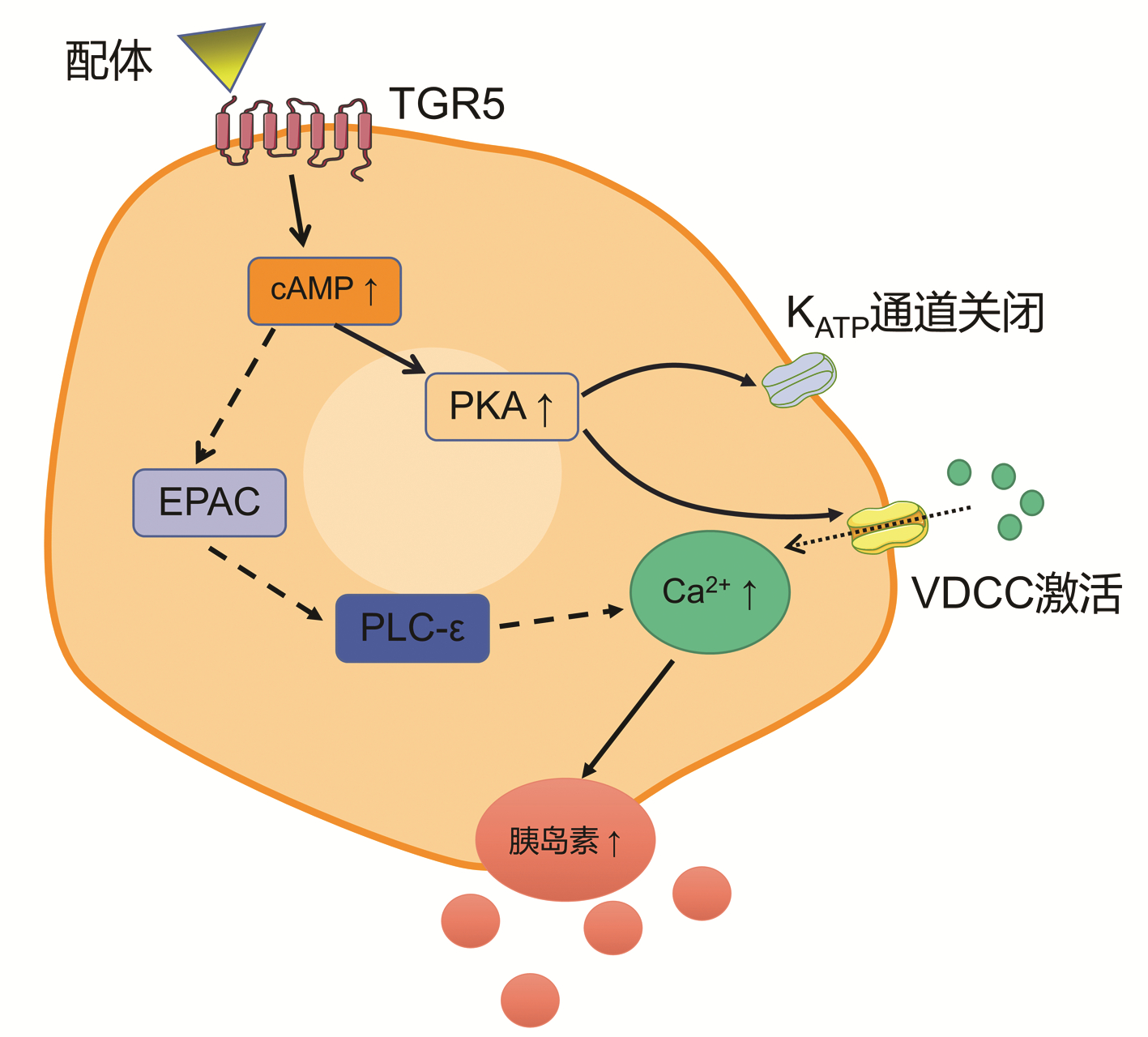
图 2 TGR5调节胰腺β细胞分泌胰岛素的机制
骨骼肌作为最大的葡萄糖代谢器官,在体内葡萄糖稳态中发挥重要作用,较低的肌肉质量与胰岛素抵抗和2型糖尿病的发生密切相关[23-24]。TGR5可在骨骼肌表达,并且可诱导肌肉细胞分化、小鼠肌肉肥大、增加肌肉力量,因此骨骼肌内TGR5表达对于血糖调节具有重要意义[25]。Huang等[26]研究验证了激活TGR5可通过cAMP/PKA途径改善骨骼肌的胰岛素抵抗。Sasaki等[27]实验表明了骨骼肌过表达的TGR5可以增加呼吸交换率和糖酵解通量,并且在高脂饮食(high fat diet,HFD)情况下可改善葡萄糖清除率,这提示骨骼肌中的TGR5通过促进葡萄糖的利用来改善葡萄糖清除率,具体机制可能是激活TGR5,通过cAMPA/PKA途径改变了糖酵解限速酶磷酸果糖激酶(PFK)的活性,促进了糖酵解(图 3)。
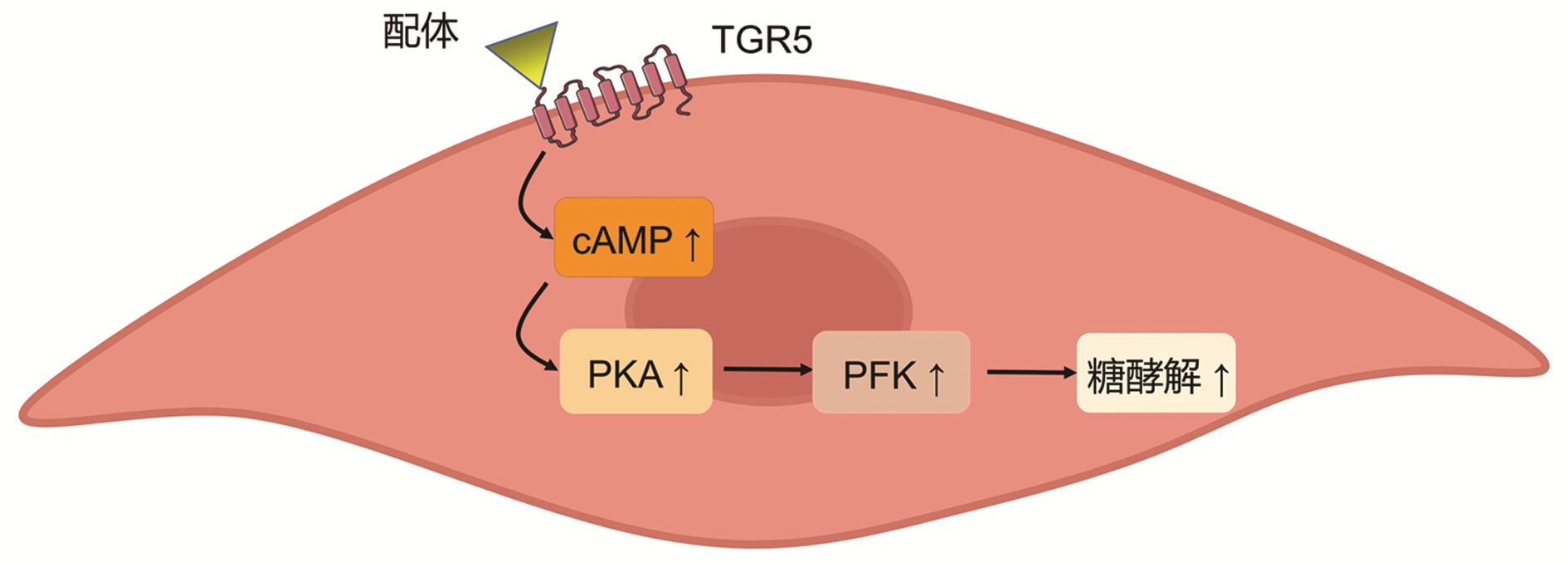
图 3 骨骼肌内TGR5参与调节血糖代谢的机制
肝脏是参与全身葡萄糖调节的关键器官,对于肝脏内TGR5信号传导与血糖代谢的关系也越来越引起重视。Holter等[12]发现了肝细胞内TGR5的信号传导对葡萄糖调节的作用,在该实验中使用TGR5激动剂化合物18改善了HFD Tgr5Hep+/+小鼠的葡萄糖耐量,并且该效应的发生与体质量变化和GLP-1分泌无关,其改善葡萄糖稳态的机制可能是通过提高胰岛素敏感性来实现。该实验证明了肝细胞TGR5信号传导也参与全身的葡萄糖稳态,然而此途径的具体机制仍未被确定,肝脏TGR5发挥调节血糖的功能和具体机制仍需进一步探究。


TGR5在机体的脂质代谢中发挥重要作用,与NAFLD患者病情发展密切相关。许多研究均证实了TGR5在促进脂质代谢,预防HFD导致的肝细胞损伤方面发挥的重要作用。例如,与雄性野生型小鼠相比,喂食HFD的雄性全身Tgr5-/-小鼠肝脏脂质沉积增加[28]。HFD小鼠使用INT-777治疗可以增加能量消耗并减少肝脂肪变性和肥胖[15]。使用肠道TGR5激动剂RDX8940降低了NAFLD模型小鼠的肝脏重量、肝脏甘油三酯和胆固醇水平[29]。
TGR5的脂质调节和肝脏保护作用,与脂肪组织密切相关。研究表明TGR5可以重置肝脏和脂肪组织之间的脂质分配来有效的保护肝脏免受损伤。Carino等[30]发现使用特异性TGR5激动剂BAR501减轻了雄性NASH模型小鼠的肝损伤,激活TGR5可以通过增加小鼠能量消耗和棕色脂肪组织(BAT)的功能以及促进附睾白色脂肪组织(ep WAT)的褐变来保护肝脏。具体机制为脂肪组织上的TGR5被激活后,促使细胞内cAMP浓度变化,驱使cAMP反应元件结合蛋白(CREB)聚集到位于Pgc-1α基因启动子的cAMP反应元件(CRE)上,通过TGR5-cAMP-CREB级联调节Pgc-1α基因的表达[30-31](图 4)。该基因可结合并激活多种核受体和转录因子,通过协调参与葡萄糖、脂肪酸和胆固醇稳态基因的表达,促进BAT功能和ep WAT褐化,进一步发挥减轻肝损伤的作用[32]。
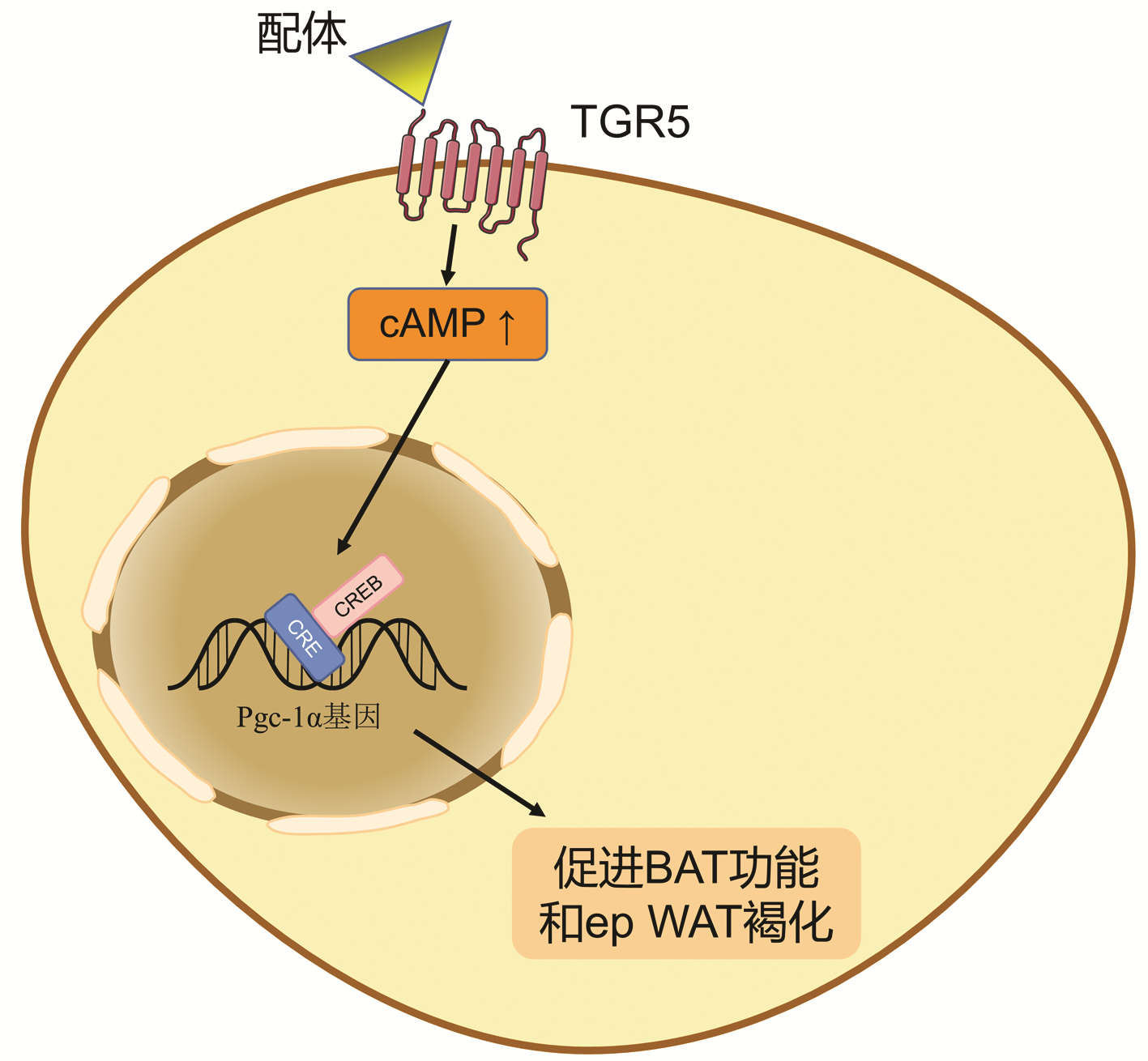
图 4 脂肪组织内TGR5参与调节脂质调节的机制
4.2 TGR5调节脂质代谢的双重作用
尽管多数研究均证实了TGR5在防止肝脏脂肪损伤的有利作用,但也有研究证明了TGR5在肝脏脂质代谢显示出的双重作用。Donepudi等[33]采用禁食诱导小鼠肝脂肪变性,发现与野生型小鼠相比,Tgr5-/-小鼠对禁食诱导的肝脂肪变性有抵抗力。Tgr5-/-小鼠的肝脏脂肪酸摄取可能受损,但脂肪酸氧化和极低密度脂蛋白分泌增加,骨骼肌对脂肪酸的摄取增加,从而在禁食期间减少肝脏内甘油三酯和脂肪酸含量,该过程可能是通过GH-Stat5机制来实现的。综合以往的研究结果,这表明TGR5在禁食和进食情况下可能对肝脏脂肪代谢分别产生消极和积极的影响。故针对TGR5参与脂质代谢的机制仍需进一步研究,以发挥TGR5在治疗肝脂肪变性领域的潜力。


由于TGR5的激活在防治NAFLD方面发挥重要作用,目前基于TGR5治疗NAFLD的方案均以寻找合适的TGR5激动剂为主,包括内源性胆汁酸及其衍生物,如INT-777[34]等;天然存在的三萜类化合物如桦木酸、齐墩果酸和熊果酸及其衍生物等[35]。此外,在食品和中药的研究中也发现了有效的激动TGR5的成分,并且在改善糖脂代谢,防治NAFLD方面的作用得到了验证。柑橘中的纯总黄酮可以改善NASH小鼠的TGR5缺乏症状,改善肝损伤[36];使用黄芩和黄连联合治疗的NAFLD模型小鼠的TGR5 mRNA表达量更高,且肝脏炎症、血脂异常情况减轻[37];采用青砖茶水提取物干预的NAFLD模型小鼠的TGR5表达量更高,肝组织出现的脂肪堆积和炎症情况减轻[38];三七中的活性化合物三七皂苷可激活TGR5并减轻高脂饮食诱导的小鼠肥胖和胰岛素抵抗[39];小檗碱化合物可通过结肠TGR5-GLP路径改善小鼠高血糖[40]等,为基于TGR5治疗NAFLD提供了新方案。


鉴于TGR5在糖脂代谢中的重要作用,其在防治NAFLD方面具有很好的前景。目前的实验研究均表明基于TGR5治疗NAFLD的有效性,但同时也暴露出一些需要解决的问题。关于TGR5调节代谢性疾病的研究发现,TGR5功能具有性别依赖性[27],因此在针对TGR5的研究中性别因素也需考虑在内,并且造成这种差异的机制需要进一步探索。由于TGR5在机体内广泛表达并且涉及的下游信号传导复杂,有关激活TGR5的副作用报道也逐步增多,包括抑制胆囊排空,促进胆结石形成[41]、促进肝囊肿形成等[42],因此对于TGR5激动剂的安全使用范围和特异性激动剂的开发仍需探索。有关TGR5调节糖脂代谢的具体分子机制的研究还存有争议,造成这种差异的原因或许与激动剂和建模方法的不同有关,因此验证既往实验的研究结果,分析造成差异的原因,有助于进一步了解TGR5调节糖脂代谢的机制。此外,目前的研究多为仅针对葡萄糖或脂质代谢的单一研究,需进一步开展两者结合的研究,有助于明确在TGR5介导下两者之间的关系,为研发治疗药物提供线索。
综上所述,TGR5介导的糖脂代谢与NAFLD发展关系密切,激活TGR5在防治NAFLD方面具有积极作用,深入研究TGR5介导糖脂代谢的具体机制,研发有效、安全的TGR5激动剂,探索合适的使用范围,对于防治NAFLD具有重要意义。
查看更多