查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:吉林市人民医院 王宏光 刘志宏 刘俊鹏 刘时助 王立波



现病史
患者女性,70岁,间断上腹不适3个月,加重1周入院。1周前我院胃镜:“胃角黏膜隆起,活检病理:低级别上皮内瘤变”。
既往史
既往体健,否认手术外伤史,未接受抗幽门螺杆菌治疗。
查体
患者一般状态良好,浅表淋巴结未触及,腹平软,无压痛、反跳痛、肌紧张,未触及肿物。肝脾肋下未触及。肠鸣音正常。
实验室检查
全腹平扫+增强CT、血常规、凝血、肿瘤标志物未见明显异常。13C呼气试验查幽门螺杆菌:阳性。
点击学习内镜操作视频
↓↓↓
内镜检查
内镜主机及图像处理系统:奥林巴斯290系统
内镜型号:GIF-H290EC
染色方法:1%亚甲蓝染色
普通白光内镜所见
胃角偏前壁侧可见一处大小约1.0cm×0.6cm黏膜浅表隆起,略呈发白色调,中央可见一处活检痕(黄色箭头);病变形态规则、表面光滑,在色彩及表面结构上与周围黏膜呈逐渐过渡,无明显分界线(图1和图2)。
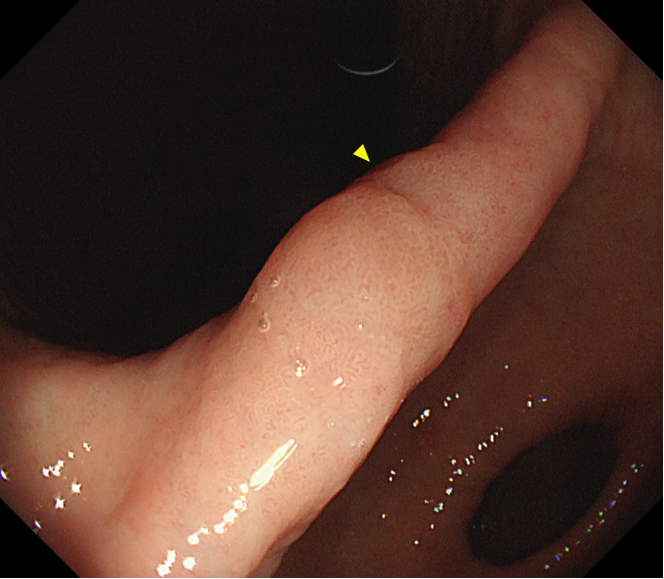
图1 胃角前壁侧普通白光内镜中景观察
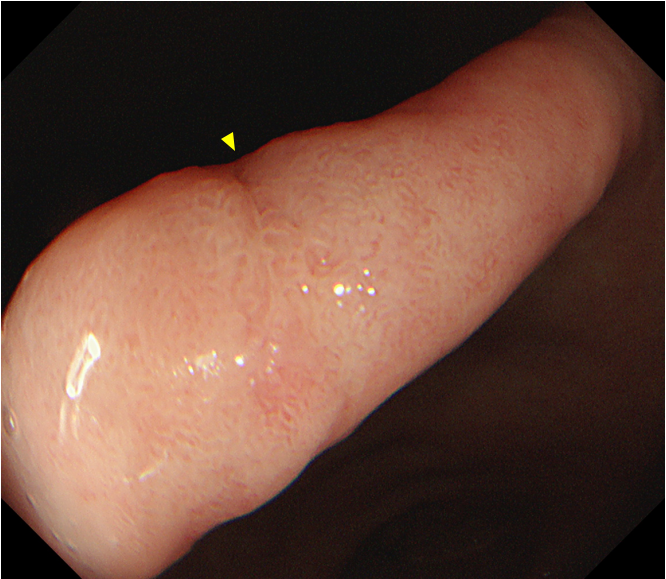
图2 胃角前壁侧普通白光内镜近景观察
NBI染色+放大观察
窄带成像(NBI)染色观察:病变周围黏膜可见亮蓝嵴提示病变发生在肠化的背景黏膜下。中、近景正面观察病变,其色泽与周围黏膜大致相同(图3、4),只有在从口侧正镜切线位抵近观察时,可以看到病变区域呈淡茶褐色,与淡绿色的周围黏膜似可见分界线(图5)。
放大观察,病变区域窝间部(IP)是明显增宽、上皮下毛细血管网(SEC)不规则。但这些表面微结构与微血管的变化,与周围黏膜并没有清晰的分界线,甚至看起来是呈一种逐渐过渡的表现(图6、7)。这样,按照早期胃癌放大内镜诊断流程(magnifying endoscopy simple diagnostic algorithm for gastric cancer:MESDA-G),这个病变诊断为癌/肿瘤的自信度是非常低的。
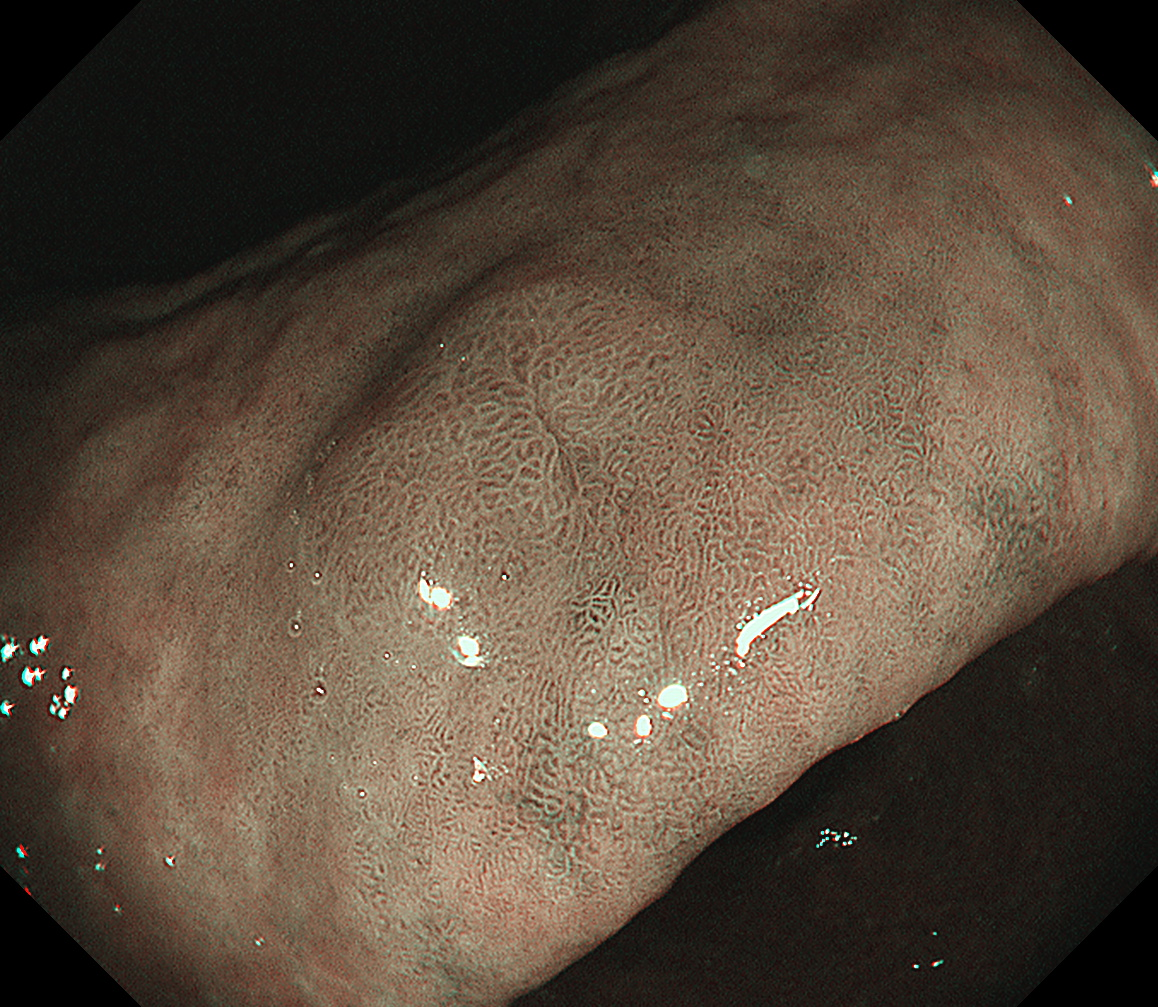
图3 NBI染色内镜非放大正面中景观察病变
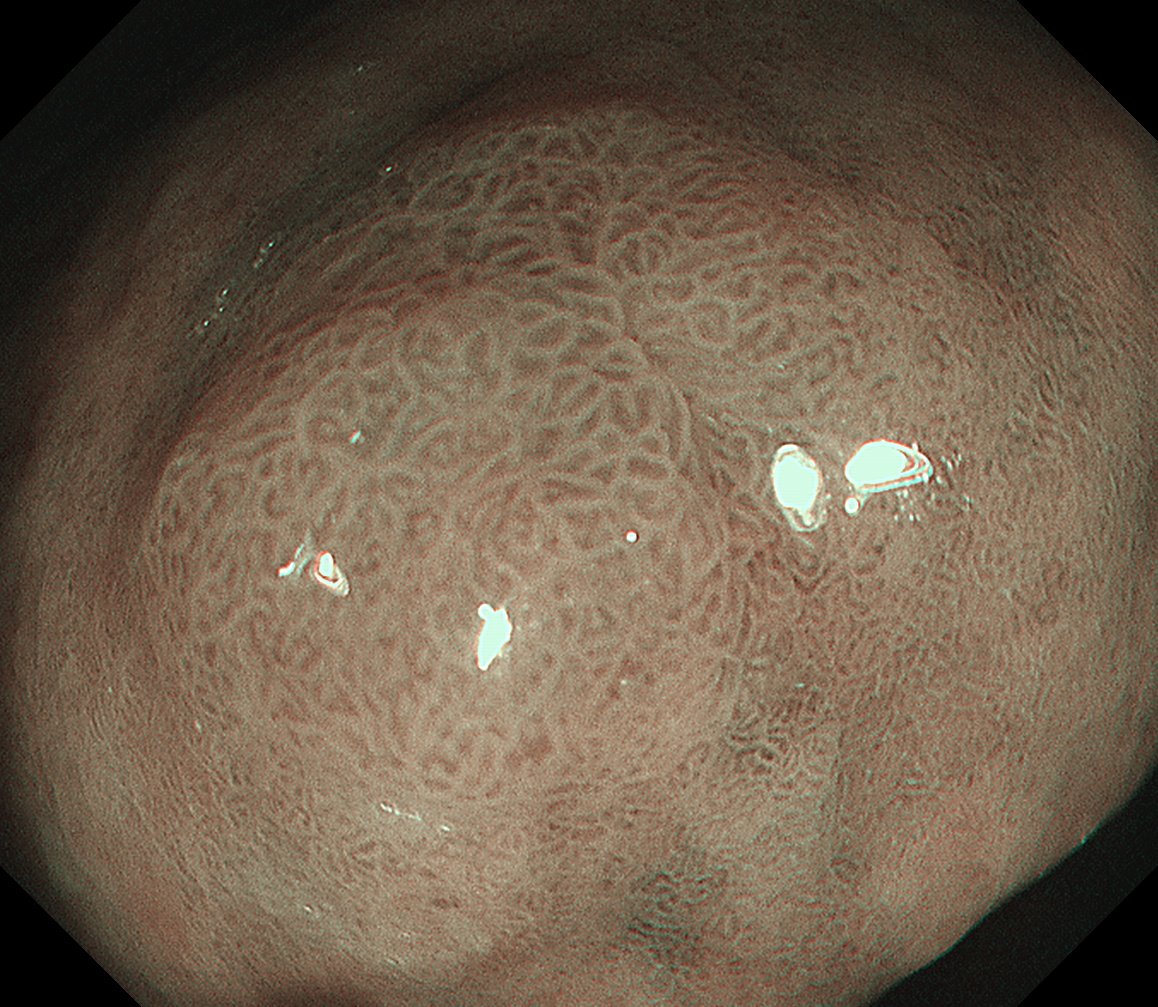
图4 NBI染色内镜非放大正面近景观察病变
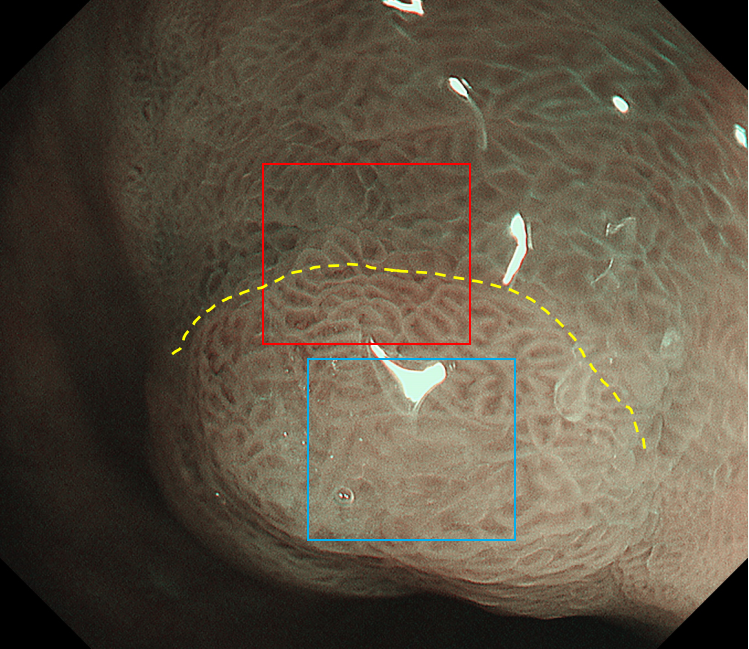
图5 NBI染色内镜非放大切线位观察病变口侧
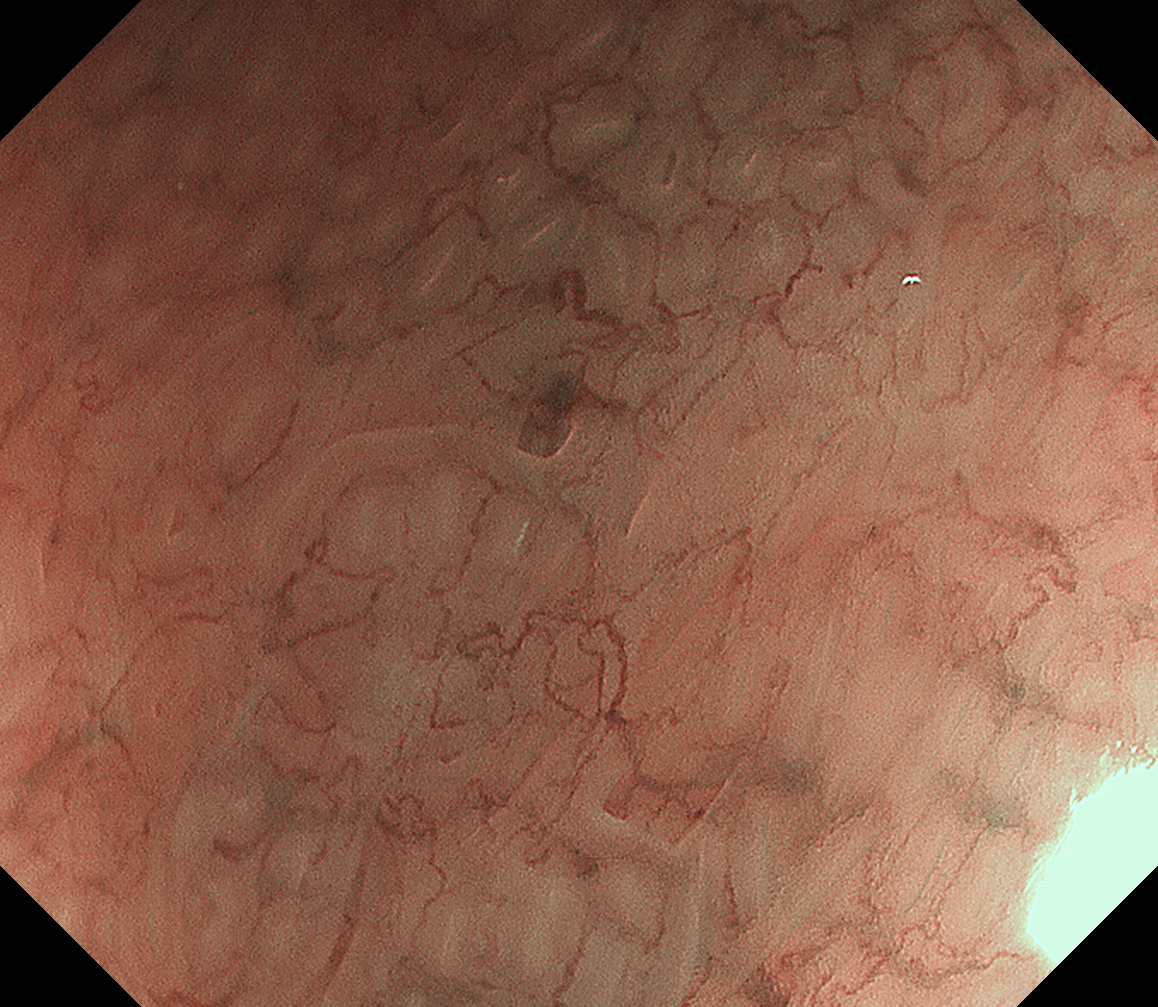
图6 NBI染色内镜放大观察病变口侧边界
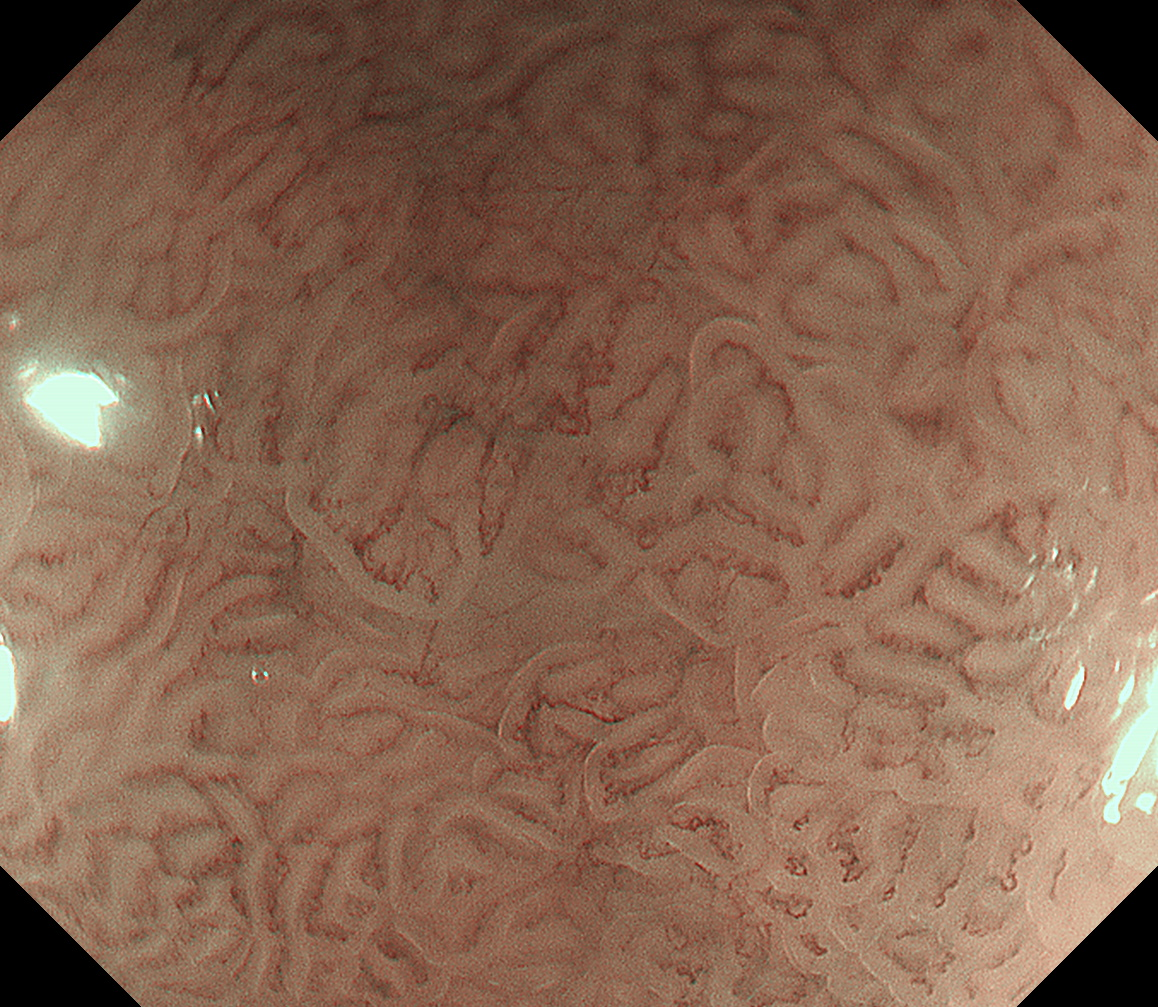
图7 NBI染色内镜放大观察病变中央区域
超扩大细胞内镜(EC,Endocyto)所见
用1%亚甲蓝注射液对病变及其周边黏膜染色3分钟后,细胞核被染成蓝紫色,而细胞质不染色。根据细胞核的排列情况,可反映染色区域的腺体结构的异形度;根据细胞核的大小、形状及分布密度反映细胞的异形度。将背景黏膜与病变区域对比观察,两者的腺腔都是狭缝状、光滑。差异体现在细胞的异形度上,病变区域细胞核排列密集、深染、大小不一,呈假复层排列(图8、9)。
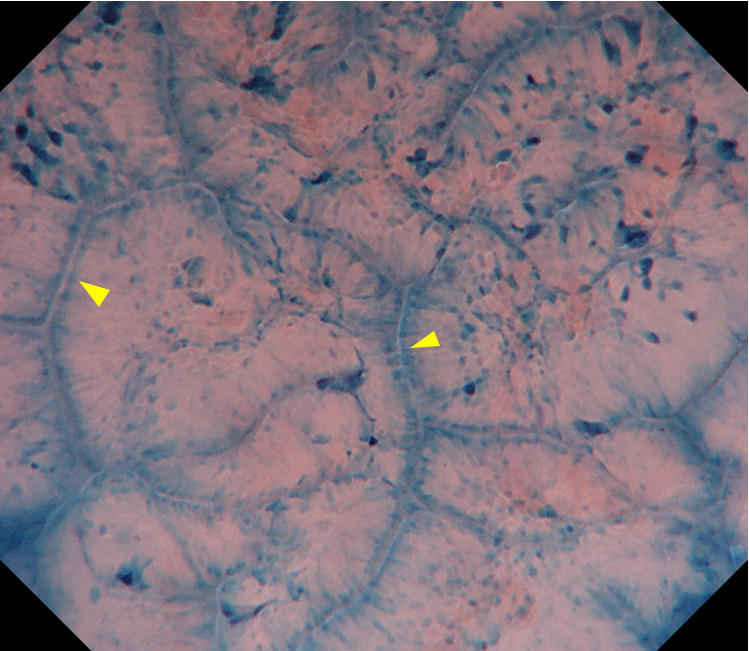
图8 EC细胞内镜520放大观察背景黏膜
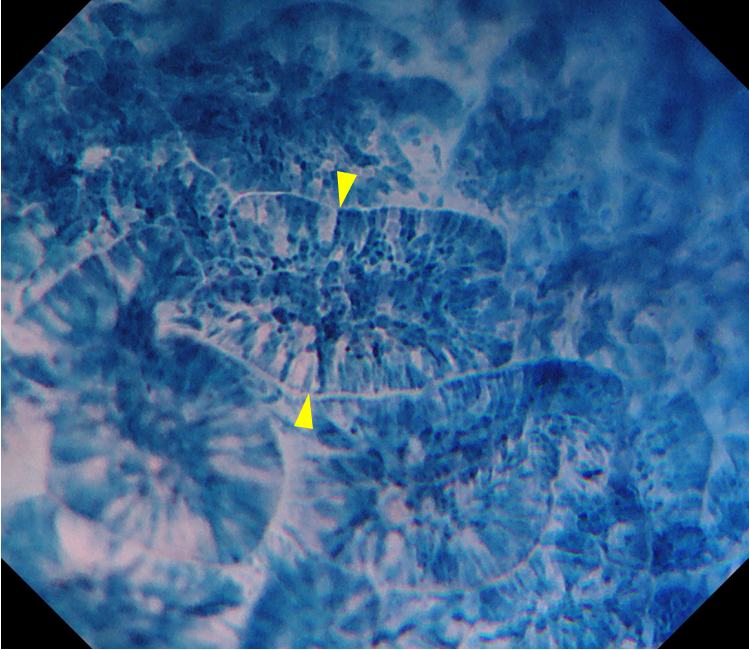
图9 EC细胞内镜520放大观察病变区域
ESD术后标本显微镜观察
内镜黏膜下剥离术(ESD)后标本结晶紫染色后实体显微镜观察,病变区域形态规则,呈长椭圆形,较背景黏膜染色深,表面微结构欠规则,边界更加清晰(图10)。
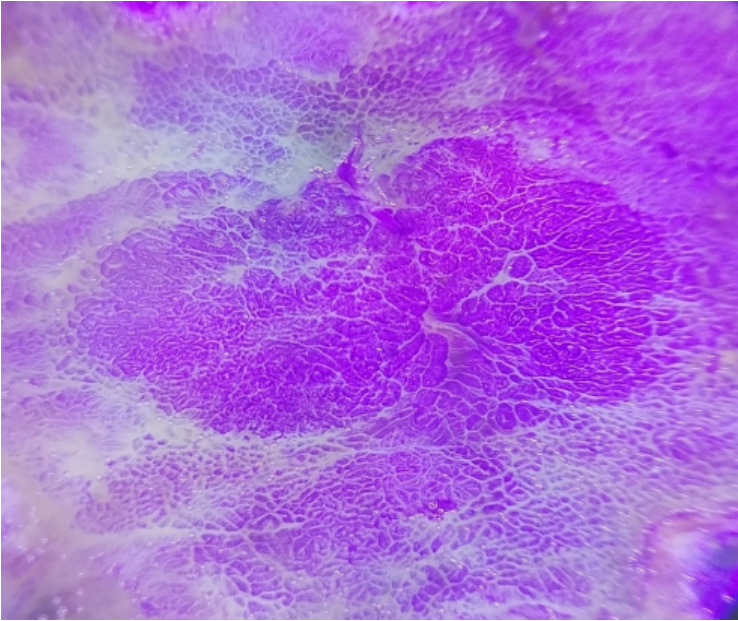
图10 ESD术后标本结晶紫染色观察病变区域表面微结构
ESD术后标本病理复原
病理:日本标准,高-中分化腺癌,大小约1.0cm×0.5cm,大体形态0-Ⅱa型,组织学亚型-管状型(tub1>tub2),癌组织局限于黏膜层,水平切缘及垂直切缘阴性,肿瘤距切缘最近距离为4mm,未见溃疡,淋巴及血管未见累及,P53(野生型,图15),Ki-67(+约60%,图16)。病变周围黏膜组织符合慢性萎缩性胃炎(图11)。
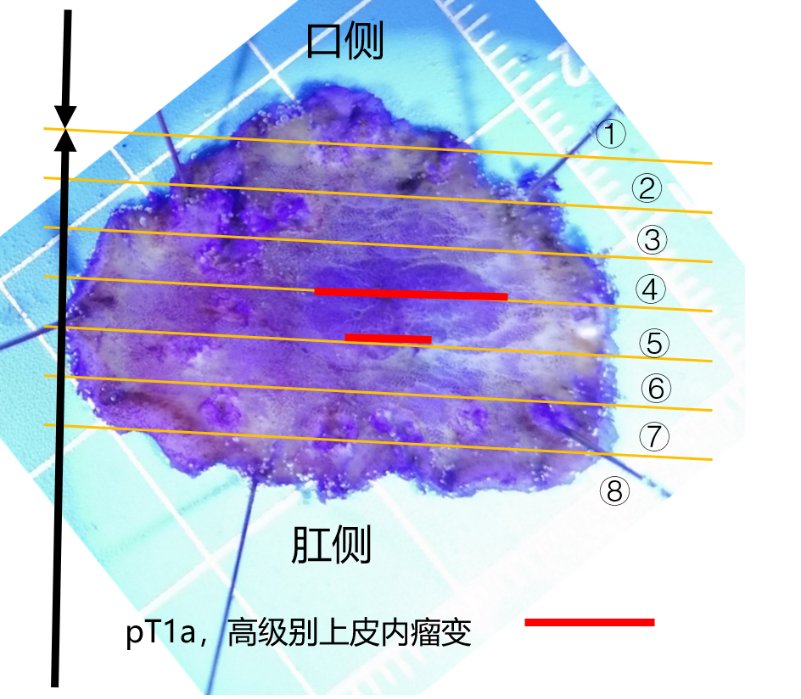
图11 ESD术后病理复原图

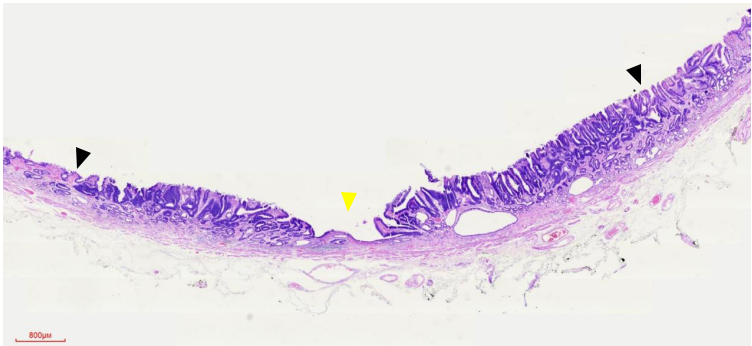
图12 4号组织条HE染色低倍镜观察
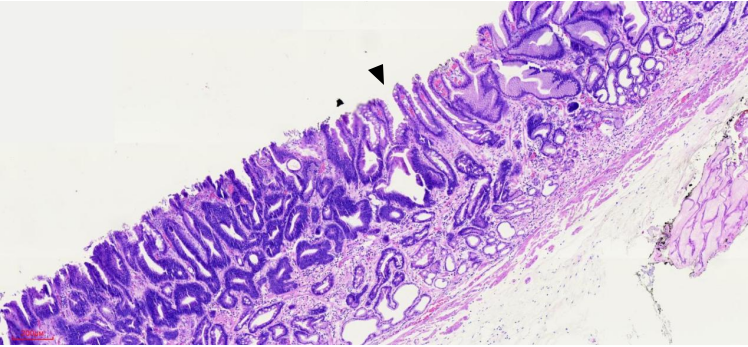
图13 4号组织条HE染色中倍镜观察
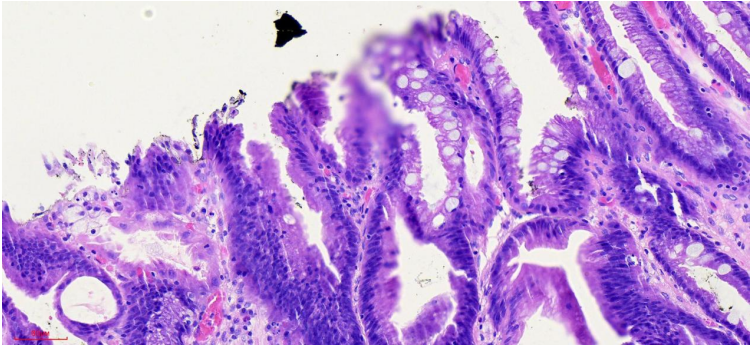
图14 4号组织条HE染色高倍镜观察
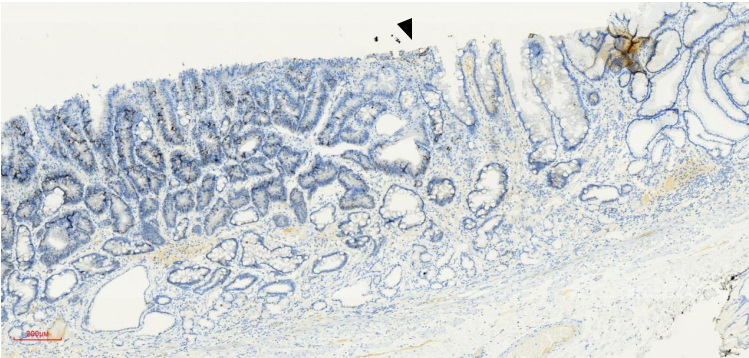
图15 4号组织条P53染色
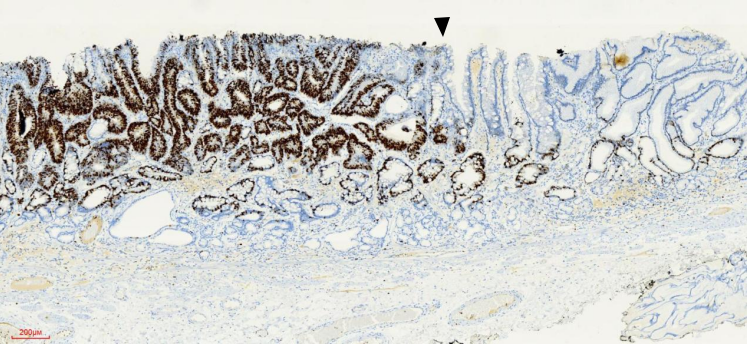
图16 4号组织条Ki67染色



随着窄带成像技术(NBI)及放大内镜的发展,我们习惯也得益于基于VS理论的早期胃癌放大内镜诊断流程(magnifying endoscopy simple diagnostic algorithm for gastric cancer:MESDA-G)来对病变是癌/非癌进行判断。即同时具有边界和不规则的表面微结构或表面微血管,可判断为癌,反之则为非癌。但在实际应用中,有两点是需要注意。
首先,常规NBI(包括BLI、OE、VIST等其他染色技术)放大下不论是对表面微结构还是微血管的判断,都是基于组织学的结构异型性来判断。即癌细胞增殖形成扩张、共背、融合等异型的腺管结构,出现不规则的微结构;同时癌组织异常增殖挤压、破坏表面微血管的正常走形、粗细以及分布,刺激表面微血管增生,从而出现不规则的表面微血管。而这些不规则的表面微结构和(或)表面微血管,又共同在形态和色调上,形成了边界。这时,问题就出现了。当癌的结构上的异形度小,或者体积较小、异型性尚未完全展示出来时,按照早期胃癌放大内镜诊断流程进行性质判断就容易发生误判。一方面容易将癌判断为非癌,另外容易将腺瘤等低异形度的非癌病变漏掉。
其次,需要认识到内镜诊断与病理切片诊断存在差异的根本原因。病理切片诊断,无论是WHO标准还是日本标准,都是从腺管结构异型性与细胞异型性两方面进行综合判断来诊断病变性质。以日本标准为例,对切片组织首先是在结构上寻找存在区域性、密集性、有前锋线形成的异常腺管,然后在从腺管底部到开口看细胞的极性和分化倾向,进行肿瘤或非肿瘤的判断。在判断为肿瘤性后,继续看腺管的异形度(结构异型、扭曲、出芽和融合)等。异形度高的,可以直接判断为分化型癌,而异型度低的需要结合细胞的异型性(核增大、极性紊乱、杆状核/类圆形核、分裂项等)来判断是否为癌。
基于上面两方面的认识,我们再回头看本病例。从病变的组织切片上看,腺管的结构异形度很低,也没有形成明显的高低差(图12、13,黑色箭头肿瘤与周边黏膜交界、黄色箭头为活检痕)。这就解释了常规白光内镜和NBI放大染色内镜下诊断肿瘤/非肿瘤、癌/非癌的自信度不高。最终确立肿瘤性病变诊断自信的,是EC细胞内镜下,看到病变区域相对于周边黏膜,细胞核排列密集、深染,大小不一,呈假复层排列。腺腔之间的细胞核考虑为癌/高级别上皮内瘤变。这些内镜图像与病理切片下高倍视野所观察到的组织图像是一致的(图9、14)。从这个角度来说,EC细胞内镜一定程度上弥补了常规白光内镜和NBI放大染色内镜只能观察结构异型,而不能观察细胞异型的缺陷。为了更方便、规范和普及EC细胞内镜的使用,我们中心在日本八尾建史教授提出的早期胃癌放大内镜诊断流程(MESDA-G)基础上,结合病理诊断思路,从细胞异型性和结构异型性两个维度,在科内初步制定了《EC细胞内镜早期胃癌经验性诊断流程》。该诊断流程思路是,以病变附近区域的正常/相对正常非肿瘤黏膜,确立非肿瘤的细胞异型性和结构异型性标准。将病变区域EC细胞内镜下观察图像与之对比,以是否存在细胞核染色明显加深、密度增高,判断是否为肿瘤性病变,相当于MESDA-G诊断流程中边界有无的判定。进而对判定为肿瘤的病变,依据细胞核的异型性,及其反映的腺管情况(结构异型性)来进行癌/上皮内瘤变或腺瘤的判定。
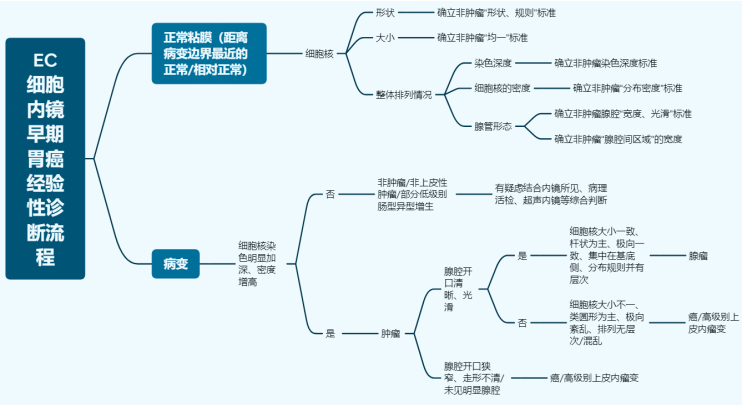
图17 EC细胞内镜早期胃癌经验性诊断流程思维导图(点击可查看大图)
目前,该诊断流程在我中心的日常工作中,显示了一定的实用价值。但在内镜-病理的符合情况、细胞分化梯度判断、人工智能(AI)判读等方面,仍需进一步深入研究和临床验证。
☆本栏目与吉林市人民医院消化中心合作,特约主任编委王宏光教授
☆每两月一期,敬请关注!
查看更多