查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





引用来源:袁富文, 童坦君. 细胞衰老与肿瘤治疗[J]. 生物化学与生物物理进展, 2018, 45(5): 494-500.
肿瘤是一项与衰老密切相关的疾病,流行病学调查研究结果显示,约2/3的肿瘤患者均为65岁以上的老年人,且占比仍在不断攀升。
而人类表观的衰老源于机体的细胞衰老(细胞衰老是指在 DNA 损伤或癌基
因失调等一系列条件下引起的稳定的细胞周期阻滞,并伴有形态、生化及表观遗传的改变)。
细胞衰老与肿瘤之间到底存在哪些关联呢?

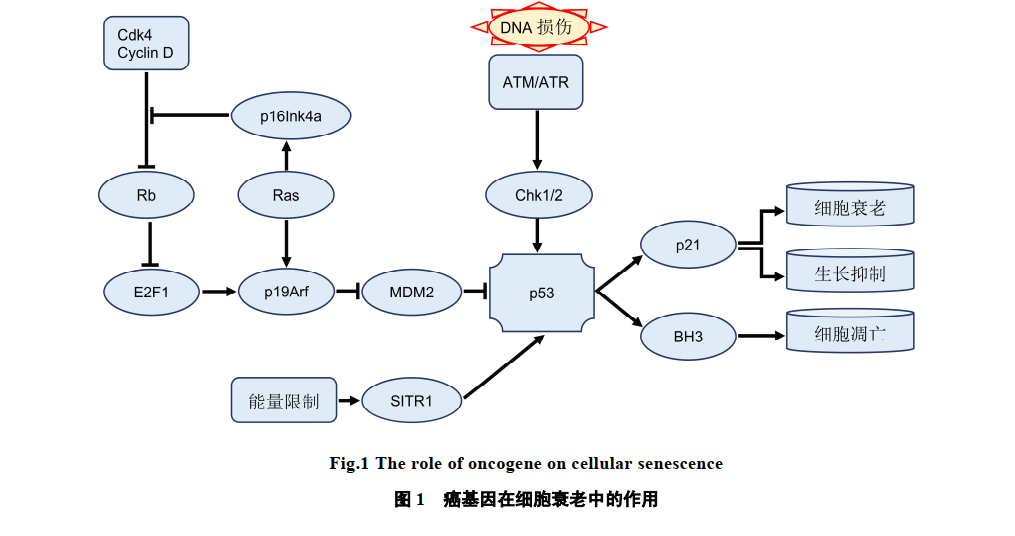
大量的研究证明,细胞衰老在很大程度上抑制了肿瘤的发生发展。在细胞衰老过程,肿瘤抑制基因 RB和 p53 发挥着关键作用。
一方面,RB及其家族成p107、p130的活性通过周期素依赖性蛋白激酶(CDK)使其发生磷酸化等蛋白修饰来调控。当RB在CDKs等作用下发生磷酸化时,失去抑制E2F1转录活性的功能,从而转录激活DNA复制及细胞周期进程。
另一方面,INK4家族蛋白可以特异与 CDK4、CDK6 结合,调控其活性。
在正常增殖细胞中,CDK抑制剂(CDKIs) 表达较低,而在一些原癌基因刺激下,p21、p16 表达可通过 p53依赖和p53非依赖途径迅速增强,进而调控下游 CDKs 以及 RB 家族蛋白质活性,引起衰老相关周期阻滞。
在 p16ink4a 和 p21cip1 基因敲除鼠研究中,H-ras 基因突变鼠成瘤能力高于对照组,在鼠胚胎成纤维细胞(MEFs)培养中,p16ink4a 和 p21cip1 基因敲除绕过了细胞衰老的周期阻滞,促进了肿瘤的发生发展。由此可见,多种癌基因及抑癌基因参与了衰老的发生过程(图)。

人口统计学资料显示,随着个体年龄的增加,许多肿瘤的发病率和恶性程度随之升高。约有2/3的新增肿瘤患者为超过65岁的老年人。在多发性骨髓瘤首诊患者中,约有1/3患者年龄超过75岁。而在前列腺癌患者中,老年男性的比例更高。
那么,是否是衰老诱发了肿瘤?抑或是细胞衰老作为抑制肿瘤的监管机制出现疏漏所致?
对人体组织以及鼠类研究表明,细胞衰老对肿瘤有抑制作用。
研究发现,在某些早期肿瘤组织中可检测到衰老相关标志物,在痣及结肠腺瘤组织中可检测到衰老相关的 β 半乳糖苷酶的表达以及 DDR 信号,而当肿瘤逐渐转化为恶性时,这些生物标志物逐渐消失。在 PTEN 缺失的小鼠模型中,衰老细胞在病变早期较为丰富,而随着肿瘤进程的发展而逐渐减少。在原癌基因 K-Ras 激活肺癌和胰腺癌的小鼠模型也得到了证实。

衰老细胞与年轻细胞相比,特征之一是衰老细胞能够分泌十分广泛的细胞因子,趋化因子及其他蛋白因子,此种现象被称为衰老相关的分泌表型(SASP)。SASP在肿瘤抑制中亦发挥着重要作用,其激活的免疫清除作用可清除恶变前肿瘤细胞,从而抑制肿瘤的恶化。北京大学医学部衰老研究中心曾发现,蛋白激酶D1(PKD1)可作为 ROS 信号一个新的效应因子,促进癌基因 Ras诱导的细胞衰老及SASP。敲除 PKD1 可使人类成纤维细胞绕过 Ras 诱导的细胞衰老,并使细胞在 Ras 表达情况下发生恶性转化,在裸鼠体内形成肿瘤。
研究者还发现 hnRNP A1 可在转录后提高 SIRT1 表达水平,降低 NF-κB 乙酰化水平及其转录活性,进而抑制其下游 SASP 关键因子 IL6/IL8 的表达与分泌,缓解癌基因Ras 诱导的细胞衰老。
有不少学者认为, SASP 具有明显的双重作用。一方面促进细胞衰老进程,抑制肿瘤的发生;在另一背景下 SASP 也可通过刺激炎症相关反应,促进肿瘤发生发展。
总之,细胞衰老在肿瘤发生早期有抑制作用,随着肿瘤细胞不断增殖,它们可逃离细胞衰老的抑制作用,发展为恶性肿瘤。然而,肿瘤细胞如何逃离衰老反应的封锁,逐步恶化机制仍未搞清。
虽然相关研究认为,衰老相关的关键基因如 Ink4a/Arf 的缺失或突变可能是导致癌前病变逃离衰老的原因。
但这些恶性化的肿瘤细胞是由衰老细胞发生基因突变、表观遗传学改变而来的,还是源于逃脱衰老和凋亡命运的非衰老细胞尚待进一步研究。
中国医学论坛报 王淳 整理
查看更多