查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





吉兰-巴雷综合征(GBS)作为急性周围神经炎症性疾病,长期以来被视为以抗体介导为主的自身免疫病,但近年来大量基础与临床研究不断加深我们对其免疫发病机制的理解,强调了“免疫稳控+再生促进”双轨并进的重要性,并逐步指向个体化、亚型化和靶向化治疗的新方向。这一思想转变不仅源于对GBS免疫路径异质性的新认知,也基于对传统免疫治疗瓶颈的反思,以及对神经修复与功能重建需求的不断提升。
GBS作为全球最常见的急性弛缓性瘫痪病因,其临床高度异质,涵盖AIDP、AMAN/AMSAN和MFS等不同亚型,各自涉及的病理损伤类型、免疫机制、触发因素均差异极大。AIDP多见于欧美地区,以脱髓鞘损伤为主,AMAN/AMSAN则以轴索损伤为特征,MFS具有共济失调、反射消失和眼肌麻痹三联征。多数亚型呈急性单相病程,极少数可发展为复发缓解或慢性过程,与CIDP存在一定重叠。尽管大多数患者起病前4周内有呼吸道或消化道感染史,但发病机制远非直接感染后果,而是复杂自身免疫“误伤”周围神经的结果。
传统对GBS的治疗主要依赖于两大免疫治疗手段--静脉免疫球蛋白(IVIg)和血浆置换(PEX)。IVIg通过调节免疫细胞、清除有害抗体与补体,干预炎症级联反应,而PEX则直接清除体液致病因子。两者虽可明显改善中重度患者预后,但对不同亚型、病程以及部分轻症患者疗效有限,且无法阻断部分患者进展为严重呼吸衰竭和长残疾。此外,糖皮质激素单独或联用并无确切获益。免疫治疗的有限性,首先源于GBS患者体内免疫病理机制的高度异质性:约60%的患者可检出针对神经节苷脂的自身抗体(以AMAN/AMSAN为主),而AIDP型抗体阳性率仅12%左右;相当比例患者几乎未监测到任何相关抗体,提示有其他免疫环节主导。
近年来,免疫学和神经生物学领域的研究深入推进了我们对GBS机制的认知,尤其在T细胞介导的细胞免疫和B细胞-抗体-补体系统之外,进一步揭示了免疫稳控的多元化与再生调控的潜力。动物实验性自身免疫性神经炎(EAN)模型显示,P0、P2、PMP22等外周髓鞘蛋白可诱发T细胞介导的脱髓鞘病变,移植自身反应性CD4+T细胞可复制GBS样损伤,T细胞删除则可逆转动物模型的病情。人类GBS外周神经病理活检结果也证实,急性期存在大量T细胞,尤其是记忆/激活型CD4+、CD8+T细胞浸润,并与局部髓鞘蛋白特异性免疫反应和细胞因子分泌相关。这种对髓鞘表位的特异性应答具有高度亚型特异性,TCR谱系分析显示,在AIDP患者间存在明显“公共”的病变相关TCR序列,是疾病特征分子的潜在分子标记。此类T细胞与髓鞘抗原的高度亲和反应,提示调控和干预自身T细胞亚群将可能为精准免疫稳控带来全新思路。
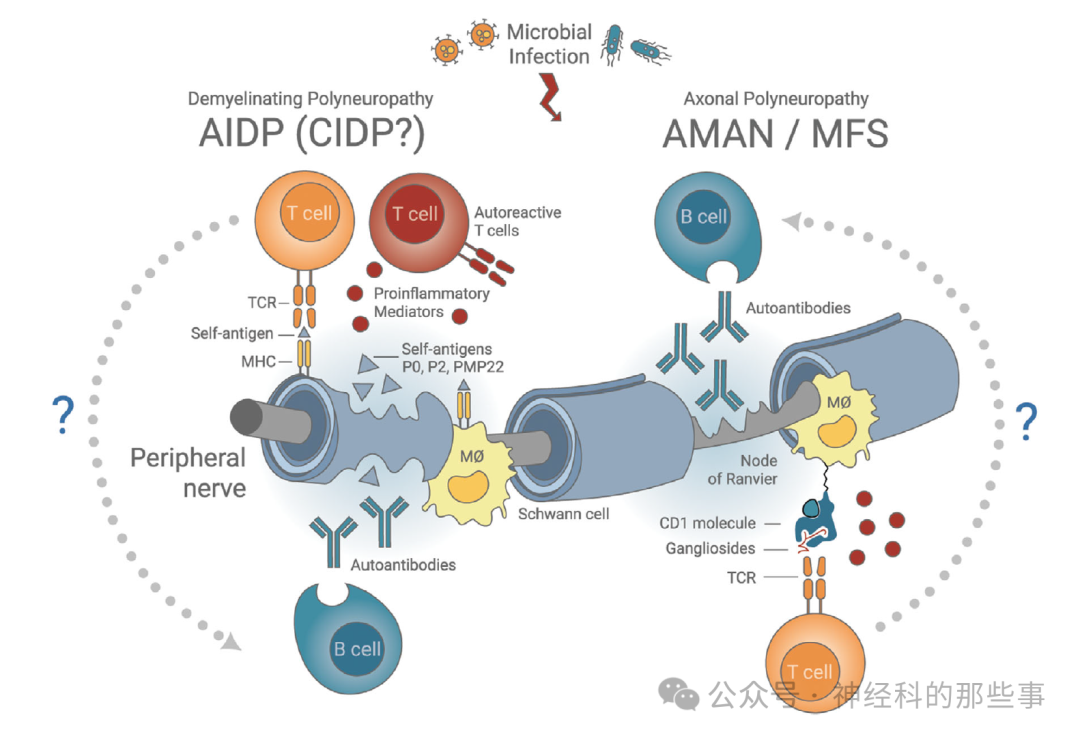
图:脱髓鞘型和轴索型格林–巴利综合征(GBS)亚型的免疫病理学模型。虚线箭头表示免疫过程中的不明确环节。MØ,巨噬细胞;P0,外周髓鞘蛋白0;P2,外周髓鞘蛋白2;PMP22,外周髓鞘蛋白22;TCR,T细胞受体。
在AMAN、AMSAN、MFS等变异型GBS中,抗体介导的病理损伤占主导地位。分子模拟理论认为病原体(常见为空肠弯曲杆菌、CMV、支原体等)感染诱导产生的抗体经结构“误认”而攻击神经膜糖脂分子(如GM1、GQ1b等),导致郎飞氏结区和轴索破坏。部分新证据还揭示了CD1分子介导的糖脂类抗原呈递可被自身反应性T细胞识别,两者在B细胞抗体产生、神经损伤中的协同作用目前正成为研究的焦点。
免疫稳控的核心,既是阻断免疫致病环节,又要恢复免疫耐受和组织稳态。在新的免疫学证据驱动下,未来治疗有望走向更高阶、精细的“亚型分子靶向治疗”。例如:采用单细胞测序和TCR克隆分析识别AIDP亚型中病变相关T细胞与其外周髓鞘蛋白表位的结合模式,序列聚合性强的“公共TCR”可能为疾病进展、分型及治疗监测提供精准工具。更进一步,理论上可研发CAR-T等细胞疗法或靶向治疗,在消除致病T/B细胞亚群同时,保留具有保护作用的细胞亚群,避免广谱免疫抑制的副作用。
目前已有灵感来源于多发性硬化、风湿病等自身免疫病中抗TCR、特异表位削弱剂、耐受性诱导细胞疗法的有效经验,并在EAN动物模型中初步见效。针对轴索型GBS,靶向抗体产生和补体激活的分子药物,例如FcRn抑制剂(如efgartigimod)、补体C1q抑制剂(如ANX005)、特异性免疫吸附及新型抗体切割酶(imlifidase)等,已进入多项Ⅱ/Ⅲ期国际临床试验。这一类创新药物能特异调节病理性IgG在体内的浓度与活性,作用更快、靶点更准,与促进再生手段联合使用时可能大幅提升预期疗效。
免疫稳控过程不仅限于发病早期的免疫病理控制,也应涵盖对慢性炎症、组织纤维化和神经免疫记忆的长期管理。部分患者(特别是早期诊断为AIDP,但后续进展为CIDP或反复波动者)提示局部慢性炎症、免疫耐受重置与再生动力缺陷是预后差的重要因素。因而,进一步加强免疫稳控的治疗措施,如诱导型调节性T细胞(iTreg)、配体修饰树突状细胞疫苗、纳米递送型免疫调节剂等也可能成为未来应用热点。
但是,单一的免疫稳控尚难以满足大批重症患者的神经功能恢复需求。在GBS发病演进过程中,部分患者已经发生不可逆的髓鞘、轴索损失,此时即便阻断免疫损伤,也不可能很快恢复周围神经功能,其重建尚需依赖高效、序贯、精准的神经再生促进手段。因此,在基础研究领域,科学家们正积极探索以干细胞、外泌体、生长因子、组织工程及纳米递送为主的再生医学策略。间充质干细胞及多能干细胞不仅具有分化为施旺细胞的潜能,还能分泌多种生长因子,支持轴索再生和减轻炎症反应,同时具有调控神经微环境和增强局部修复的作用。外泌体则因其低免疫原性和递送生物活性分子、miRNA和蛋白能力,被认为是“细胞源性再生药物”的创新形态。实验和初步临床资料显示,这些干细胞/外泌体方案可促进脱髓鞘再生、提升轴索修复速度,在功能恢复、残疾率降低方面显著优于传统无再生干预。
生长因子(如NGF、FGF、BDNF)、小分子修饰剂(如调控mTOR、Rho/ROCK等通路)、胶原支架、组织工程化微环境均被证实可在动物和部分初步人群研究中提升髓鞘再生、诱导施旺细胞增殖及功能重建。除此之外,精准局部的纳米递送平台可将生长因子、免疫调控分子直接作用于损伤区域,减少系统副反应,强化局部修复信号。施旺细胞生物学的深入揭示,尤其其在炎症微环境下的抗原呈递能力与免疫调节通路,也为修复与稳控连续进行提供新的靶点。当然,这些在基础研究中取得的成果如何转化为切实有效的临床应用仍有很长的路要走。
“免疫稳控+再生促进”双轨并进,需在实际医疗过程中实现机制上的协同与策略上的衔接。最新的治疗理念主张在疾病的急性早期,优先应用靶向性强的免疫调控(如efgartigimod、ANX005、专一化抗原耐受细胞疗法等),迅速控制炎症、切断损伤进展,为神经自身修复营造免疫稳态和微环境基础;在康复期,则有序切换以促进髓鞘再生/轴索重建为核心的再生手段,并辅以功能评估、个体化康复方案,提升再生速度与质量,最终实现最大程度的神经功能恢复。伴随神经免疫生物标志物、单细胞组学、分层诊断与AI辅助决策的融合应用,各亚型GBS患者将得到越来越精准的分子分型和疗效预测,助力临床端实现“精准诊断-早期免疫-及时修复-持久再生”的闭环。
未来,GBS的研究与治疗势必以分子机制为主线,充分融合靶向免疫稳控与神经再生促进,个体化、亚型化、分期化诊疗将成为主流。新一代免疫药物、细胞疗法、再生技术将持续推动疾病管理范式转型,最大程度改善患者远期生存质量和社会功能。

来源:神经科的那些事
查看更多