查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





一、侵袭性霉菌感染的流行病学
1. 侵袭性霉菌病的流行病学
随着免疫抑制人群、老年人的增加和既往致命性疾病患者生存率的提高,全球侵袭性真菌病(IFD)发病率逐渐上升。我国数据显示,门诊及住院患者中IFD发病率均呈显著升高趋势。全球每年重症真菌感染患者超过3亿,每年IFD死亡患者超过150万,美国2017年IFD相关医疗费用约72亿美元,亚洲国家IFD发病率是西方国家的3~15倍。医疗技术的进步使更多新的IFD危险因素出现,从而导致患者数量不断增加,而严重的疾病负担及巨大的诊疗挑战使临床日益重视IFD的流行病学。
霉菌是IFD患者的主要致病真菌之一。国外数据显示,霉菌是常见致病真菌。在血液恶性肿瘤患者中,侵袭性曲霉病(IA)是最常见的IFD类型,其次为念珠菌、毛霉菌。在重症患者中,霉菌(曲霉+毛霉)是第二位常见真菌。我国数据显示,霉菌是常见致病真菌,在老年患者中,念珠菌检出率最高,其次为曲霉菌、毛霉菌、隐球菌等。
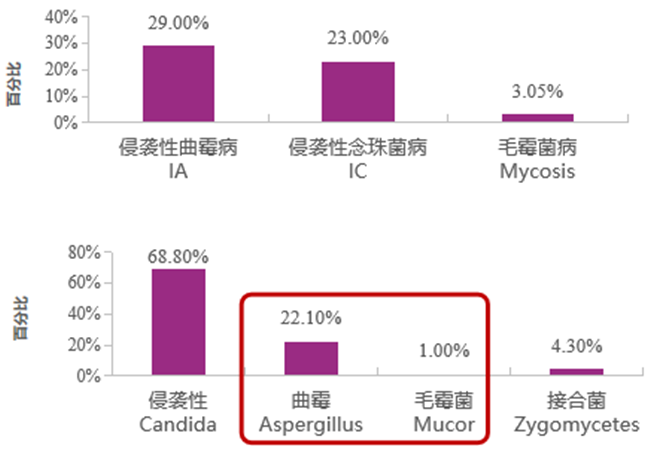
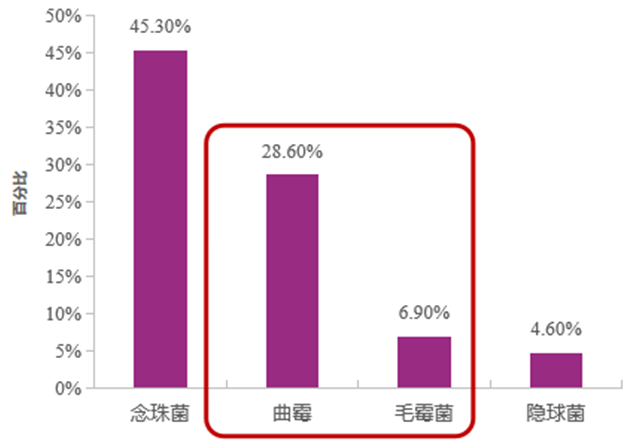
霉菌感染发病率呈升高趋势,且患者病死率高。在ICU患者中,IFD病因中,曲霉与其他霉菌感染比例呈增高趋势。与其他IFD患者相比,毛霉病及IA患者病死率相对较高。
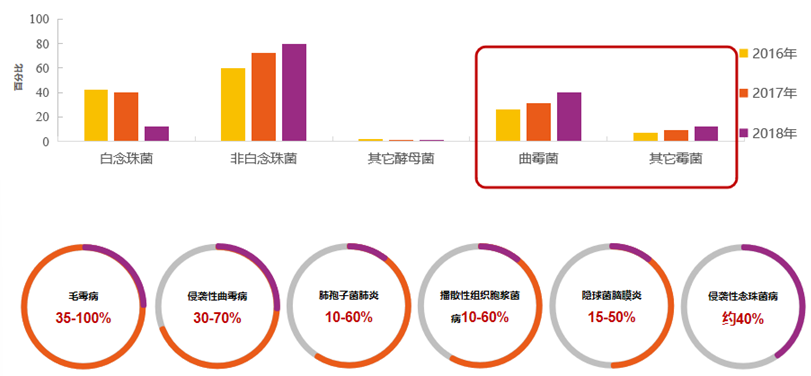
免疫功能与曲霉病密切相关,随着免疫功能的降低,患者更易进展为IA。近年来,IA发病率不断增加,恶性血液病、造血干细胞移植(HSCT)、实体器官移植(SOT)、慢阻肺、使用激素或免疫抑制剂、病毒感染、接受靶向药物治疗是IA的重要危险因素。肺部是IA患者最主要的感染部位,其次为鼻窦、中枢神经系统,IA能够显著增加患者的病死率,延长住院时间,加重了经济负担。
2. 毛霉病的流行病学及高危人群
我们对毛霉病的认识相对较少。毛霉病是由毛霉目病原体引起的罕见的侵袭性真菌病。
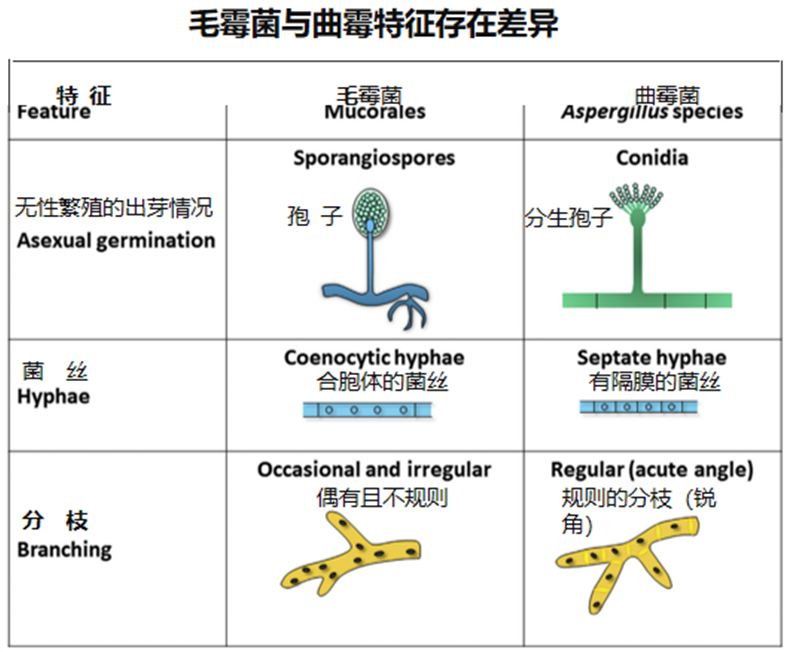
毛霉病的发病机制:通过孢子吸入鼻孔或肺部或接触到皮损或伤口而发生感染;高血糖和酸中毒损伤吞噬细胞的趋化性和杀伤能力,易发生毛霉病;脱铁胺作为毛霉载体增加真菌的生长,因此铁超载时易发生毛霉病。
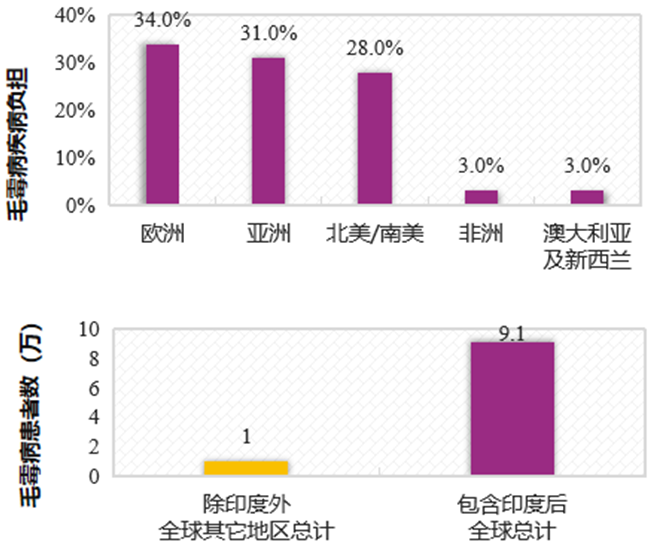
全球范围内,毛霉病疾病负担重,且发病率不断增加。预估全球毛霉病的发病率为0.005~1.7/100万人;在印度,毛霉病患病率为14/10万人,约为发达国家的80倍,且印度毛霉病发病率不断增加。欧洲地区毛霉病疾病负担最高,印度地区毛霉病患者数量最多。
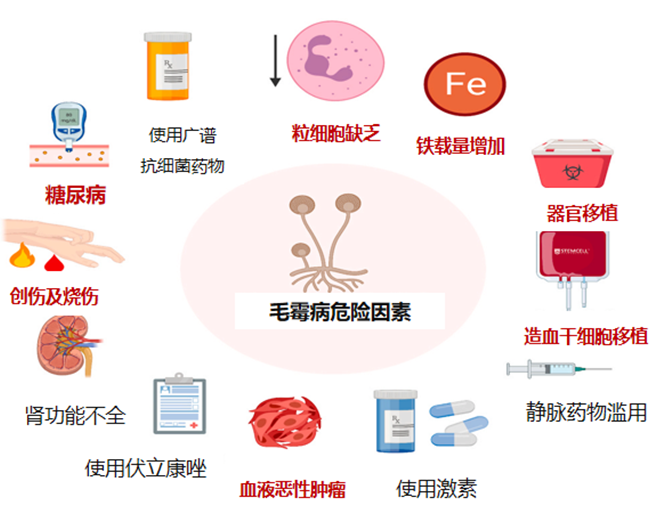
糖尿病、激素治疗、血液恶性肿瘤、器官移植、肾功能不全、使用广谱抗细菌药物等多种因素与毛霉病的发生密切相关。
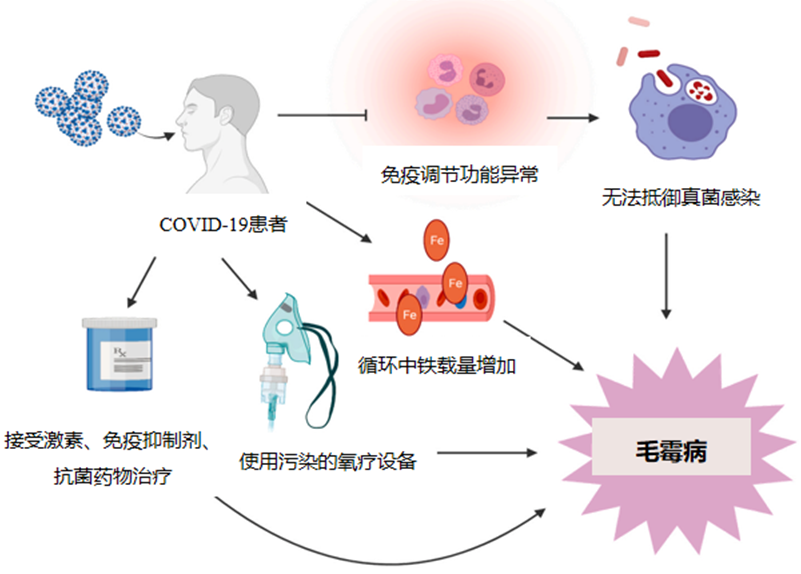
近期流行的COVID-19亦是毛霉病的重要危险因素。免疫功能抑制、铁载量增加、使用激素治疗、氧疗设备的污染等导致COVID-19患者易发生毛霉病。
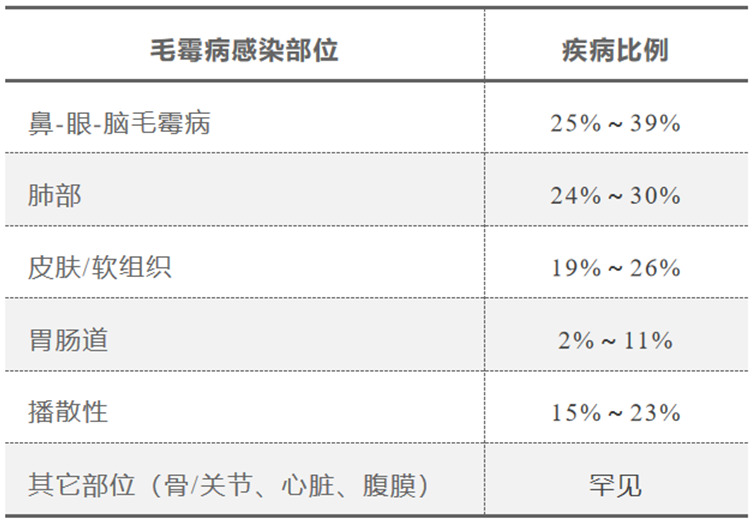
数据显示:鼻-眼-脑毛霉病、肺毛霉病是常见的毛霉病类型,其次包括皮肤软组织毛霉病、胃肠道毛霉病、播散性毛霉病。
不同基础疾病患者毛霉病感染的部位不同。
(1)肺毛霉病:好发于糖尿病伴或不伴高血酮症患者、SOT受者、粒细胞缺乏(以下简称粒缺)患者、血液恶性肿瘤患者。
(2)鼻-眼眶-中枢毛霉病:好发于糖尿病伴或不伴高血酮症患者。
(3)皮肤/软组织毛霉病:好发于滥用静脉药物、烧伤/创伤患者。
(4)播散性毛霉病:好发于SOT受者、粒缺患者、血液恶性肿瘤患者。
(5)胃肠道毛霉病:好发于SOT受者。
毛霉病进展迅速,若未及时治疗患者病死率高。大多数情况下,除非及时进行手术和抗真菌治疗,否则毛霉病患者病情会迅速恶化,并最终死亡;这种情况下,毛霉病患者病死率达54%,且很大程度上取决于感染部位、潜在的基础疾病和真菌类型。
全球范围内,毛霉病疾病负担重,且发病率不断增加。糖尿病、激素治疗、血液恶性肿瘤、COVID-19等多种因素与毛霉病的发生密切相关。不同基础疾病患者毛霉病发病率存在一定差异,鼻眶、脑、肺是毛霉病的高发部位;不同基础疾病患者,毛霉病感染的部位同样存在一定差异。毛霉病进展迅速,若未及时治疗,患者的病死率较高。
二、侵袭性霉菌感染的诊断
IFD的诊断分为确诊、临床诊断、拟诊和未确定四个级别。
国内外IFD相关指南均明确指出:临床诊断和确诊的依据必须包括病原微生物的实验室检查,其中实验室检查是诊断标准极为重要的组成部分。目前多种方法可用于IFD的诊断。
(1)传统的基础方法:直接涂片镜检、真菌培养、X线/CT。
(2)非培养的实验室检测方法,① 真菌抗原检测:G试验、GM试验、隐球菌荚膜多糖抗原(CRAG)检测、念珠菌甘露聚糖(Mn)抗原检测;② 真菌抗体检测:曲霉特异性抗体检测、念珠菌特异性抗体检测;③ 分子生物学及其他新型检测:PCR、NGS、MALDI-TOF MS、T2Candida panel等。mNGS在真菌感染、真菌和细菌混合感染中发挥了重要作用。
1. IA的诊断
1.1 IA的确诊标准
IA的确诊标准是无菌部位培养、组织核酸检测。
(1)无菌标本微生物分析:针吸或活检获得标本,进行组织病理学、细胞病理学或直接显微镜检示菌丝或黑酵母样形态,同时伴随组织损伤证据。
(2)无菌标本培养:从临床或影像学显示的病灶部位(正常无菌部位),通过无菌操作获取标本,培养后可见透明或着色的霉菌。
(3)血:同时存在感染的过程中,血培养示霉菌(血培养发现曲霉,多提示污染,此处霉菌不代表曲霉)。
(4)组织核酸诊断:福尔马林固定石蜡包埋组织中发现霉菌时,PCR和DNA测序检测到真菌DNA。
1.2 IA的临床诊断:宿主因素及临床标准
临床诊断IA时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
(1)宿主因素:①近期发生中性粒细胞缺乏(中性粒细胞计数<0.5×109/L)并持续超过10天;② 接受异基因造血干细胞移植;③ 既往60天内,长时间使用皮质类固醇(除外变应性支气管肺曲霉病):超过3周的平均最低剂量为0.3 mg/(kg·d)的泼尼松当量;④既往90天内接受T细胞免疫抑制剂治疗,如环孢素、TNF-α阻滞剂、阿仑单抗,或核苷类似物;⑤ 遗传性严重免疫缺陷(如慢性肉芽肿、STAT3缺陷或严重联合免疫缺陷);⑥ 血液恶性肿瘤患者;⑦ 实体器官移植受者;⑧ 接受B细胞免疫抑制剂治疗;⑨ 累及肠、肺或肝的Ⅲ级或 Ⅳ级GVHD,且对一线皮质类固醇治疗无效。
(2)临床标准:① 肺曲霉病:存在以下4种CT特征中的一种,a. 致密、边界清楚的病变,伴或不伴晕征;b. 空气新月征;c. 空洞;d. 楔形和节段性或大叶性实变。② 气管支气管炎:镜下可见气管支气管溃疡,结节,伪膜,斑块,或焦痂;③ 鼻窦感染:a. 急性局部疼痛(包括放射至眼部的疼痛);b. 鼻溃疡伴黑痂;c. 从鼻窦延伸至穿过骨屏障,包括进入眼眶;④ 中枢神经系统感染:存在以下2种症状中的1种,a. 影像学局灶性病变;b. MRI或CT提示脑膜强化。
侵袭性肺曲霉病的影像学有多种表现,是从非特征性的气道病变逐渐演变为特征性的血管侵袭为主。曲霉菌侵袭累及肺泡和细支气管壁,影像学可呈现非特征性改变,如支气管周围实变影、支气管扩张征、小叶中心型微小结节影、树芽征和磨玻璃样改变等表现,为曲霉菌气道侵袭特征性表现;侵袭性肺曲霉病的特征性CT影像学包括:致密、边界清楚的病变(伴或不伴晕征)、空气新月征、空洞、楔形/节段性或大叶性病灶。
侵袭性曲霉病患者可出现特征性或非特征性CT改变,且疾病不同阶段CT表现存在一定差异。侵袭性肺曲霉病CT表现与免疫缺陷类型或程度及潜在宿主疾病相关,严重免疫抑制时免疫反应极为有限;而免疫恢复/重建时,反应将增加、病变可能会扩大,边界清晰的病变(结节)是侵袭性肺曲霉病的主要影像学表现;不同影像学表现可能代表疾病的不同阶段。针对免疫缺陷患者,侵袭性肺曲霉病的CT特征随疾病进展而有不同表现:疾病早期以晕轮征为主,随后以空气新月征、空洞常见;此外,患者初期病变数量及大小增加,随后进入减少的平稳阶段。IA患者还可表现为非特异性和不常见的CT改变,如实变、空洞性病变、胸腔积液、磨玻璃样混浊、树状浸润性病变和肺不张等,但非特异性CT可能会进展为特异性表现。
1.3 G试验和GM试验在IA患者中具有较高的诊断价值
一项针对252例血液病患者的研究结果显示:G试验和GM试验诊断IA的敏感性、特异性、阳性预测值和阴性预测值均较高,BALF GM试验诊断IA的准确性较高,且与血GM检测结果相当。与血液病患者不同,G试验和GM试验在诊断非血液病患者IA时的敏感性和阳性预测值相对较低,但其特异性及阴性预测值仍较高。针对呼吸科等非血液病患者,BALF G试验和GM试验诊断IA时表现出较高的敏感性、特异性、阳性预测值和阴性预测值。因此,BALF G试验和GM试验则在诊断非血液病患者侵袭性曲霉病时表现出较高的诊断价值。
1.4 PCR检测IA具有较高的敏感性和特异性
近年来,PCR检测血液和BALF已被指南推荐为临床诊断侵袭性曲霉病的真菌学标准;目前,临床中曲霉PCR检测主要被用于疑似IA患者的确诊或筛查IA高风险人群,以促进早期诊断。25项研究的荟萃分析发现,血清PCR检测的敏感性和特异性分别为84%和76%;此外,至少有两次PCR检测结果阳性时的特异性高达95%,敏感性为64%,高似然比为12.8。17项研究的荟萃分析及系统汇总:BALF-PCR检测诊断确诊及临床诊断IA的敏感性及特异性分别达91%和92%;阳性似然比为11.90,阴性似然比为0.10。
1.5 NGS诊断IA仍存在一定的局限性
近年来,NGS被逐渐用于IA等感染性疾病的诊断,但其仍存在一定的局限性。最新指南明确指出,二代测序对真菌的检出率显著高于培养;以临床诊断为金标准,二代测序比培养显著提高了灵敏度(50.7% vs 35.2%),而特异度无显著区别。对于新发、罕见、疑难感染性疾病,以及免疫缺陷患者,二代测序能显著提高病原体的检出率,可作为上述疾病的一线检测方法。
NGS检测IA时存在一定的局限性:① 敏感度与人源背景微生物水平相关;② 临床标本来源复杂多样,可能存在病原体信息太少而导致数据丢失或数据混杂;③ 缺乏标准数据;缺乏统一的数据分析流程;④ 数据库的完整性及准确性参差不齐,且检测人员及技术水平对mNGS的结果亦存在影响;⑤ NGS检测技术的局限性;⑥ 多数mNGS检测需在第三方实验室集中检测,样本寄送耗时较长;⑦ 价格昂贵、基因量少等。
1.6 联合检测诊断IA的应用价值
多次生物标志物检测或联合检测在高危患者中筛查侵袭性曲霉病具有较高的诊断阳性率。一项荟萃分析结果显示:使用至少1个GM试验或PCR阳性结果确定阳性的敏感性高达99%,且结果显著高于任何单一试验(与GM试验相比,P=0.0018;与PCR相比,P<0.0001)。此外,当同一患者的GM试验和PCR均为阳性时,其诊断特异性增高至98%。该研究证实:单次GM试验或PCR检测阳性对筛查高危患者的侵袭性曲霉病性能欠佳,但具有较高的阴性预测值;当至少2次阳性结果时阳性预测值可达88%。
但临床中多种因素影响G试验、GM试验结果的准确性。因此,影像学联合微生物学有助于侵袭性肺曲霉病的早期诊断。一项针对141例侵袭性肺曲霉病患儿的回顾性分析:GM试验联合CT诊断的敏感性、特异性、阳性预测值及阴性预测值分别为79.3%、85.2%、76.4%和87.2%;且与血清GM试验、CT检查相比,GM试验联合CT检查的AUC值最高。另一项针对113例成人IPA患者的研究结果显示:GM试验联合CT诊断的敏感性与单纯GM试验检测相当,而特异性则明显提升。
2. 侵袭性毛霉病的诊断
2.1 毛霉病的诊断标准
与IA的确诊标准相同,无菌部位培养、组织核酸检测是确诊毛霉病的标准。临床诊断侵袭性毛霉病(IM)时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
2.2 毛霉病的临床表现
不同毛霉病患者出现不同的临床表现,主要取决于宿主的免疫状态、感染程度和受累器官。
毛霉病最常表现为鼻眶脑感染,通常发生于真菌孢子吸入鼻窦;这种情况下,感染可能停留在局部,症状与急性鼻窦炎类似:伴发热、头痛、鼻窦疼痛和鼻塞。毛霉病也可表现为吸入孢子后肺部感染;常见发热,胸痛,呼吸困难和咯血(可能是大量和致命的),咯血主要是由于菌丝侵犯血管和随后出血。免疫功能低下患者中,毛霉菌感染可能侵犯眼眶和上颚,并进一步延伸到大脑;局部组织侵犯可导致显著的临床异常,包括视力丧失、颅神经麻痹和精神状态改变。皮肤毛霉病患者多数无明显的免疫抑制,但既往有严重创伤;感染可局限于局部或扩展到更深的组织,包括周围的骨骼、肌肉和肌腱;病变开始时出现疼痛的红斑和硬化,并逐渐发展为坏死,通常进展为坏死性筋膜炎。在COVID-19患者中,毛霉病主要影响眼睛、口腔和大脑;常表现为眼部干性坏疽;眶鼻区、上颚或口腔底的压疮等。
2.3 毛霉病的临床诊断标准:特征性的影像学表现
反晕轮征是毛霉病的一种特异性征象。既往多项研究及病例报道提示,针对免疫功能不全患者中,反晕轮征内的网状结构和较厚的外缘强烈提示患者可能为毛霉病。既往研究报道称,19%~94%的肺毛霉病患者的影像学表现为反晕轮征,且反晕轮征在粒缺患者中更为常见;此外,毛霉病的连续胸部X线片检查显示出快速的进展。
2.4 毛霉病的临床诊断标准:非特征性的影像学表现
肺毛霉病的影像学表现多种多样,且常为非特征性表现。
(1)胸部X线片中,肺叶和节段性实变是最常见的影像学表现,部分患者的影像学表现为多叶分布。
(2)单个或多个结节和肿块也是常见特征。
(3)病变早期CT可能仅显示血管周围的磨玻璃样病变,随后出现更广泛的影像学表现,磨玻璃样病变通常进展为实变、结节或肿块,结节和肿块可能有晕轮征。
(4)由于真菌容易侵入血管系统,坏死是一个常见的特征。
2.5 NGS诊断侵袭性毛霉病等真菌感染时存在诸多局限性
《宏基因组高通量测序技术应用于感染性疾病病原检测中国专家共识》指出:mNGS通过对临床样本的DNA或RNA进行鸟枪法测序,可以无偏倚地检测毛霉菌等多种病原微生物。针对毛霉菌等细胞壁比较厚的病原体,常规核酸提取方法难以保证核酸提取的质量,因此需要使用一些特殊的破壁方法,并标准化。对于在核酸提取过程中破壁困难的微生物,如毛霉菌等,应注意mNGS提供的线索,进一步确认与排除;即使在检测报告中读长数较低,也要考虑其为致病微生物的可能,并采用其他方法验证,如特异引物的PCR或一代测序等分子生物学检测。
2.6 小结
无菌部位培养、组织核酸检测是确诊霉菌病的标准。临床诊断霉菌病时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
侵袭性曲霉病的临床诊断:
(1)宿主因素:粒细胞缺乏、HSCT、血液恶性肿瘤、SOT等。
(2)临床标准:①致密、边界清楚的病变、晕征、空气新月征、空洞等是特异性改变;②患者还可出现非特征性CT改变,且疾病不同阶段CT表现存在一定差异。
(3)微生物学标准:①G试验、GM试验诊断侵袭性曲霉病具有较高的价值;②影像学联合微生物学有助于侵袭性肺曲霉病的早期诊断。
毛霉病的临床诊断:
(1)宿主因素:粒缺、血液恶性肿瘤、糖尿病、创伤/烧伤等。
(2)临床标准:① 不同患者出现不同的临床表现,主要取决于宿主的免疫状态、感染程度和受累器官;② 肺毛霉病的影像学表现多种多样,且常为非特征性表现。
(3)微生物学标准:① G试验、GM试验阳性可排除毛霉病;② PCR是目前检测毛霉病的主要手段;且多种不同标配的PCR检测均具有较高的敏感性和特异性。
作者:雷伟
单位:苏州大学附属第一医院呼吸与危重症医学科
本文转发自重症肺言


查看更多