查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





陈功 中山大学肿瘤防治中心
美国芝加哥当地时间2019年6月1日,是第55届美国临床肿瘤学会(ASCO)年会的第二天,下午15:00-18:00,结直肠癌领域迎来了最重要的内容——口头报告专场,本文现将mCRC一线强烈治疗部分的重要研究数据及个人观点整理如下,以飨读者,欢迎大家共同讨论。

陈功教授
第三部分mCRC一线强烈治疗对比标准治疗
研究1 摘要3507: VISNU 1: CTC≥3 个的mCRC一线FOLFOX+Bev对比FOLFOXIRI+Bev

VISNU-1研究旨在探索基线时血液CTC≧3个的mCRC,在标准一线治疗FOLFOX + Bev中加入伊立替康,能否进一步带来生存获益。主要研究终点是PFS,假说是从8.0个月延长到11.2个月,HR=0.71。次要终点包括ORR和OS。其他的入组标准还有年龄<70岁以及PS 0-1。
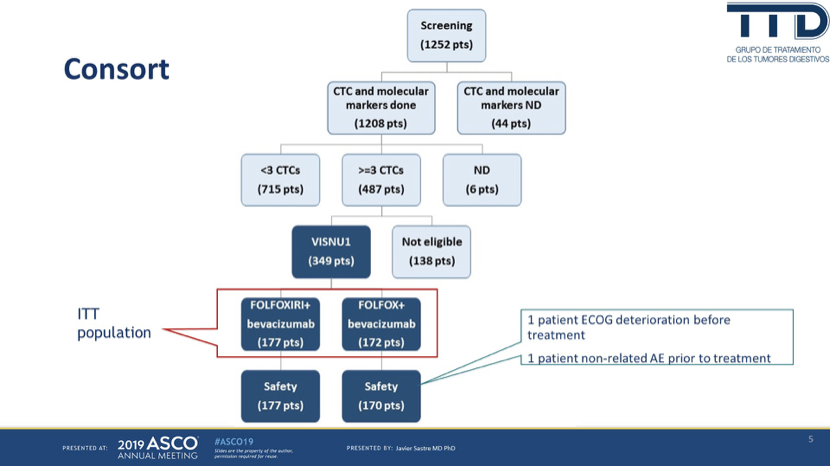
研究对1208例mCRC进行了基线CTC检测,其中487例的CTC≧3个,最终有349例符合入组标准并进入试验,构成研究的ITT人群。
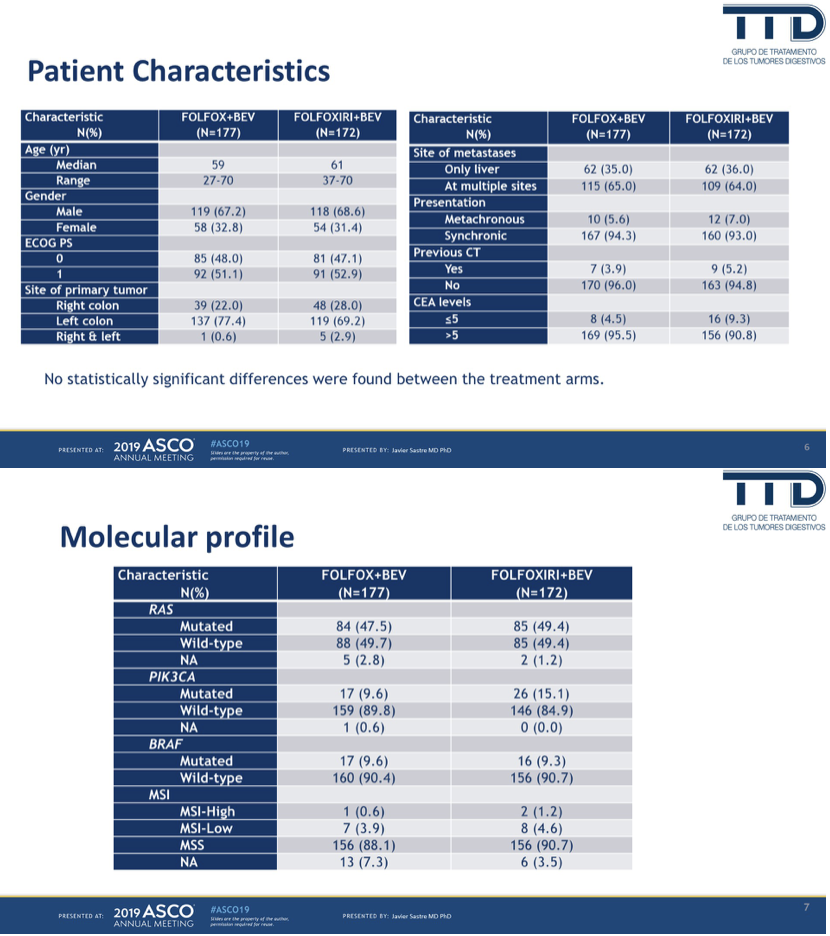
组间人群的基线特征总体较均衡。中位年龄59-61岁,25%为右半,35%为仅有肝转移,93%均为同时性mCRC。大约48%为RAS突变,9%为BRAF突变。
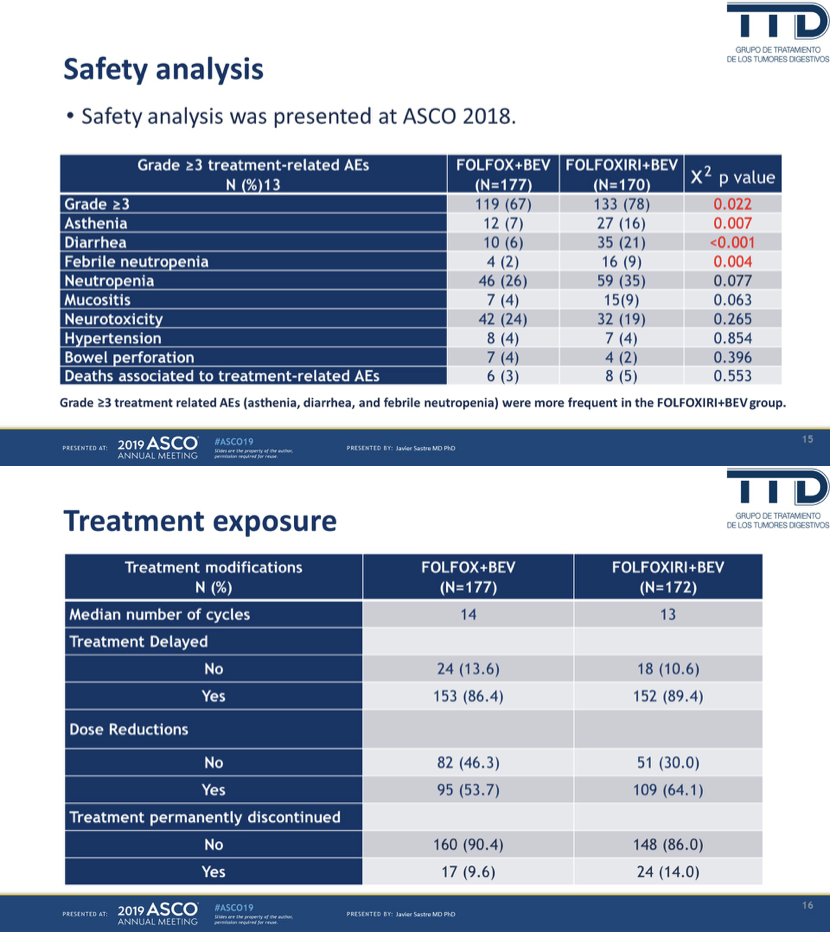
总体安全性可以接受,但三药显著增加了3度以上治疗毒性,主要包括虚弱、腹泻和发热性中性粒细胞减少;三药方案也导致更多的治疗延迟、减量和终止。
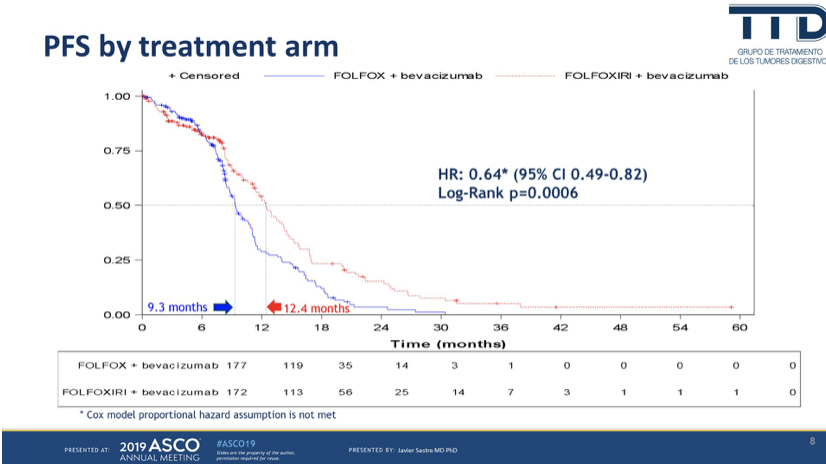
主要研究终点PFS从9.3个月延长到12.4月,HR=0.64,95%CI 0.49-0.82,P=0.0006,研究终点达成。
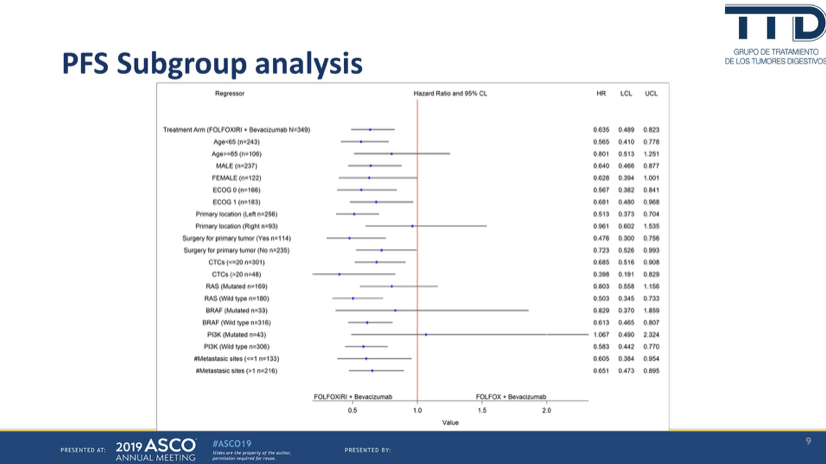
亚组分析显示PFS获益最大的人群特征包括:65岁以下、PS0、男性;原发瘤左半、RAS/BRAF野生,原发瘤手术切除等。
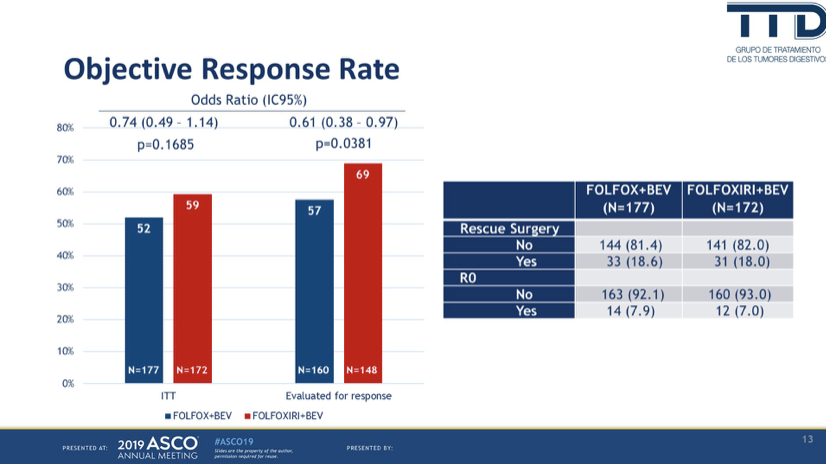 ITT人群的ORR分别为52%和59%,OR=0.74(0.49-1.14),P=0.1685;可评价人群ORR则为57%和69%,OR=0.61(0.38-0.97),P=0.0381。大约18%的患者接受了挽救性手术,其中大约7%为R0手术。
ITT人群的ORR分别为52%和59%,OR=0.74(0.49-1.14),P=0.1685;可评价人群ORR则为57%和69%,OR=0.61(0.38-0.97),P=0.0381。大约18%的患者接受了挽救性手术,其中大约7%为R0手术。
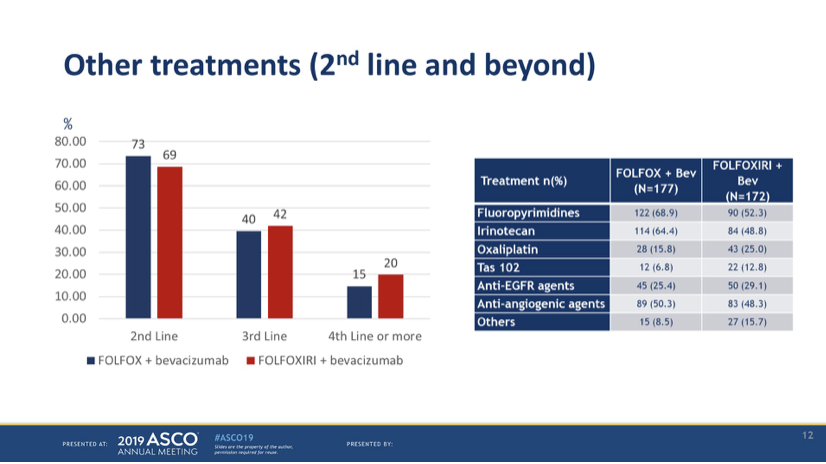
二线及以后的后续治疗分布图显示,整体的后线治疗比较充分,组间均衡。
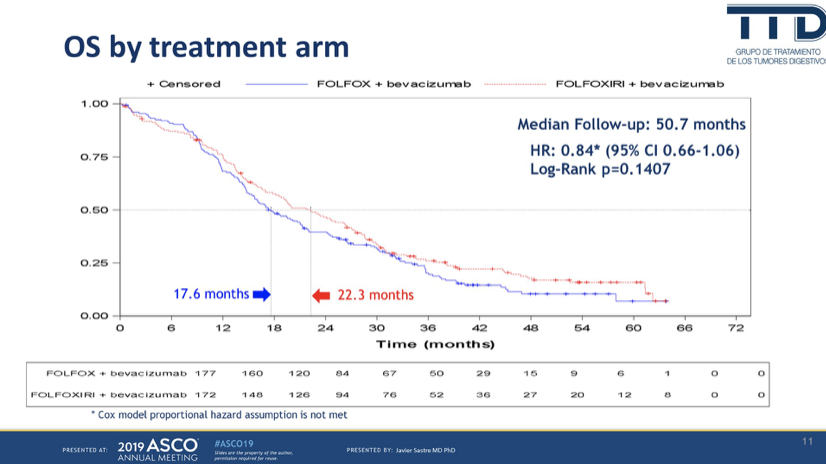
中位随访50.7月后,OS分别是17.6月和22.3月,HR=0.84,95%CI 0.66-1.06,P=0.1407。

研究结论认为:在这组预后很差的患者中,接受FOLFOXIRI+Bev 方案治疗患者的PFS改善有统计学意义,OS和ORR的改善表现出获益趋势,提示FOLFOXIRI+Bev 可考虑作为≥3 bCTCs 的转移性结直肠癌患者的适当治疗选择。
研究2 摘要3508: TRIBE2结果更新-不可切除mCRC一二线治疗策略对比研究
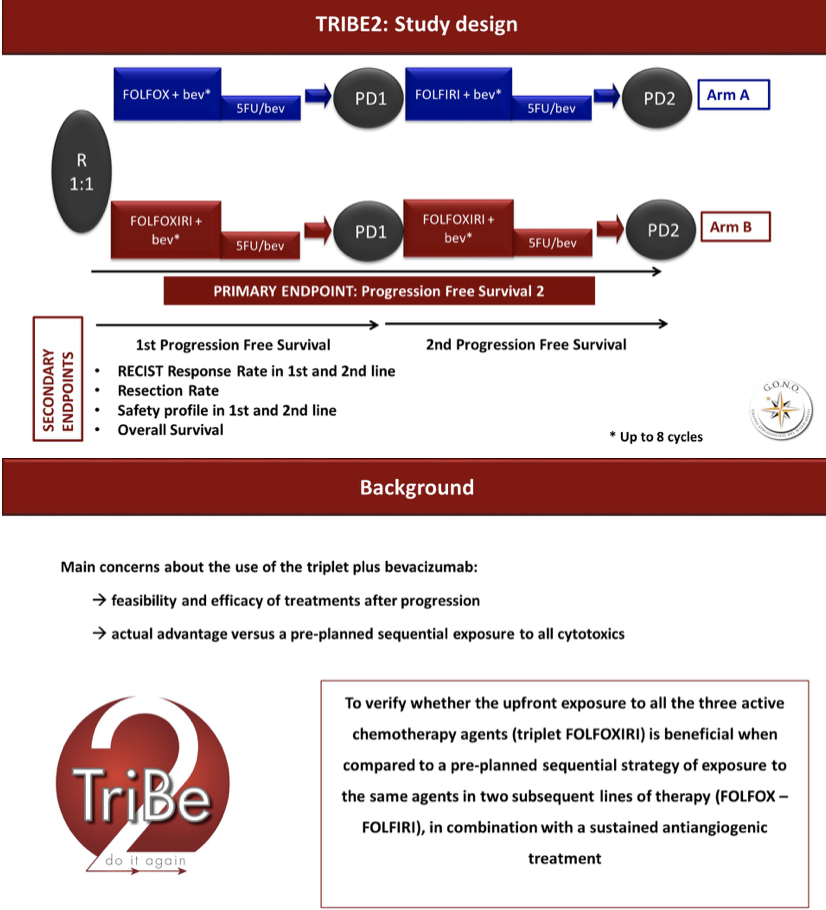
意大利TRIBE研究已经证明一线FOLFOXIRI+Bev较FOLFIRI+Bev能明显延长PFS和OS,但鉴于对三药方案耐受性的担心,以及后续治疗选择的顾虑,临床上对该策略尚有争议;而且,在目前标准临床一二线治疗策略(也即计划的一二线双药序贯策略)下,二线治疗结束,也能够接受所有三个细胞毒药物的治疗,三药方案的优势和必要性受到质疑。设计上独树一帜的TRIBE2研究就是为了解决上述问题,对照组为目前标准的临床实践策略,研究组则新颖大胆的设计为一线三药+Bev,进展后二线再次引入三药+Bev。

主要研究终点是PFS2(定义为自随机到第二次PD发生的时间),15个月的PFS2从50%提高到60%,HR=0.77。

入组标准主要是不可切除mCRC,年领18-75岁,PS≤2(70岁以上者要求PS=0)。最终入组人群中位年龄60-61岁,85%为PS=0,90%为同时性mCRC;原发瘤右半或RAS/BRAF突变的群体占79%,而原发瘤左半且RAS/BRAF野生群体为16%。
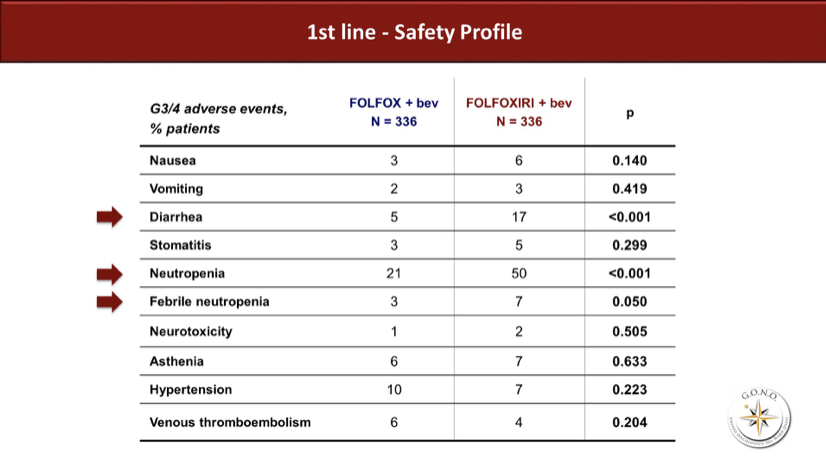
一线治疗的安全性资料显示三药方案显著增加了3/4度的腹泻、粒细胞减少及相关发热。
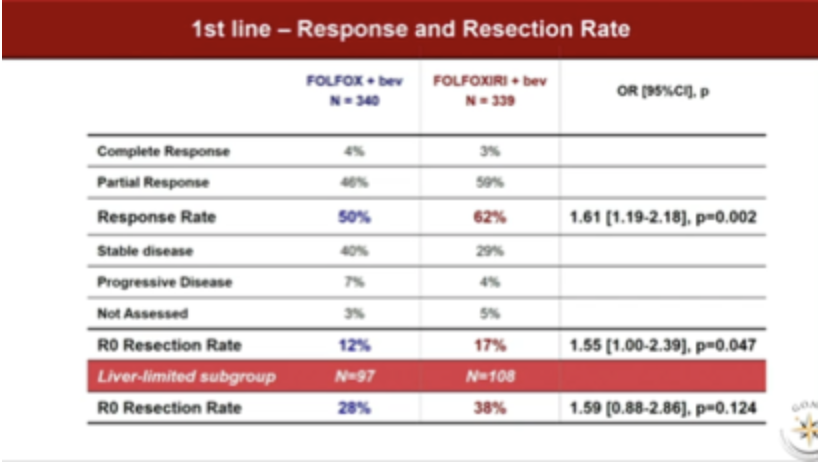
一线治疗的ORR分别是50%和62%,50%,OR 1.61,95%CI 1.19~2.18,P=0.002;分别有12%和17%的患者获得R0手术切除,OR 1.55,95%CI 1.00~2.39,P=0.047,其中仅有肝转移的患者R0切除率分别为28%和38%(OR=1.59, P=0.124)。
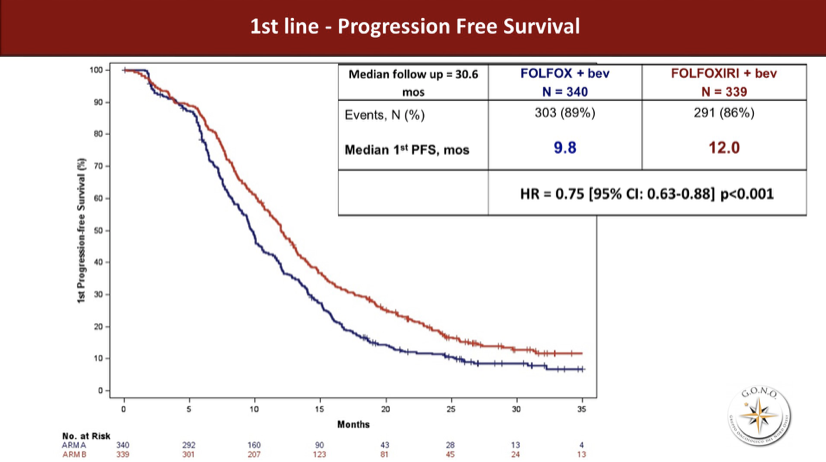
一线PFS分别达到9.8月和12.0月,HR 0.75,95%CI 0.63~0.88,P<0.001。
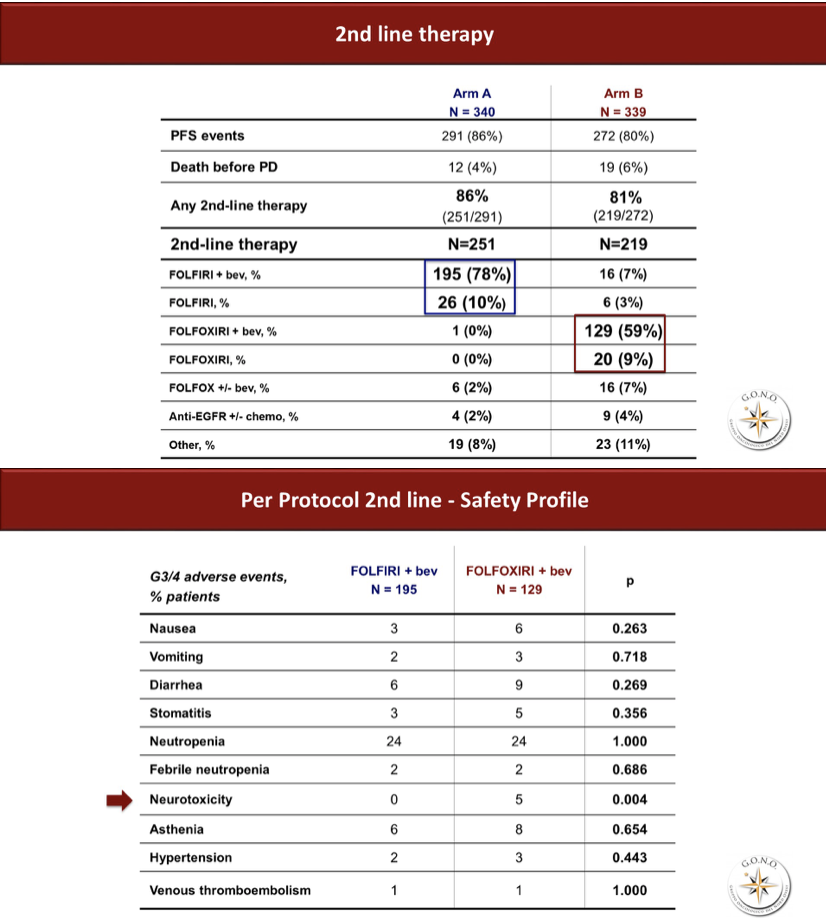
二线及后续治疗的比例分别为86%和81%,其中标准临床实践的序贯治疗组二线使用含伊立替康方案的比例高达88%,提示此模式下至二线治疗结束时三个细胞毒药物的暴露确实是很充分的。而研究组二线的FOLFOXIRI重引入率也可达68%。二线治疗的安全性总体没有差异,除了三药组神经毒性显著增加以外。一线中观察到的腹泻、粒细胞减少等毒性反而未见差异。
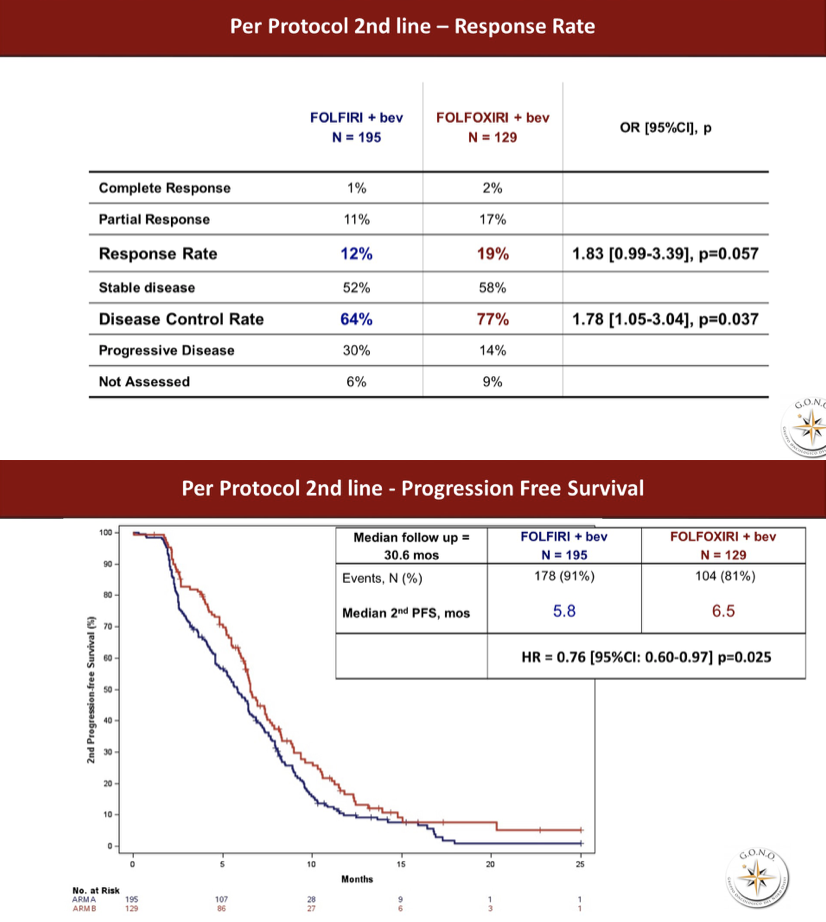
二线治疗的ORR分别是12%和19%,延长为边界显著性意义(P=0.057);PFS分别是5.8月和6.5月,但达到了统计学显著性差异,HR 0.76,95%CI 0.60~0.97,P=0.025。
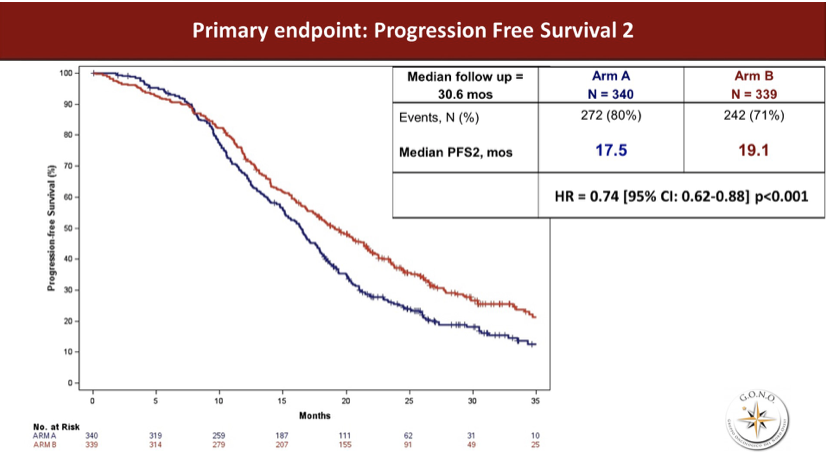
最后,主要研究终点PFS2事件分别是80%和71%,中位PFS2分别为17.5和19.1月,HR 0.74,95%CI 0.62~0.88,P<0.001。
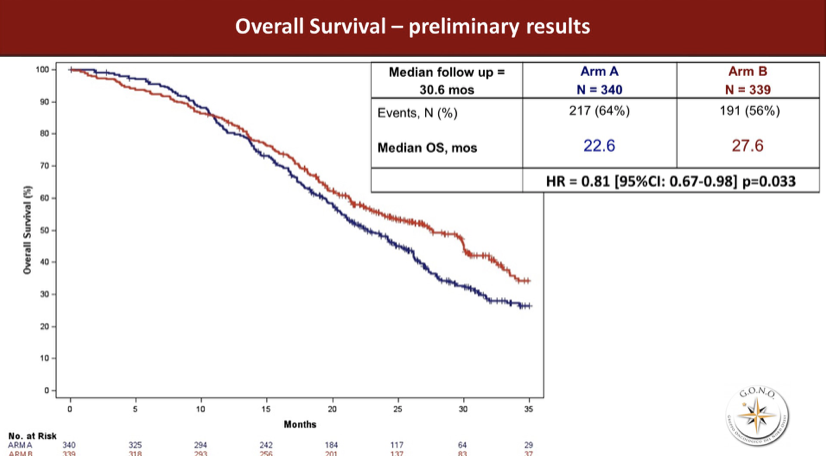
在中位随访30.6月后,发生的OS终点事件分别是64%和56%,两组的OS分别达到22.6和27.6月,HR 0.81,95%CI 0.67~0.98,P=0.033。

研究结论认为和经典的两药方案+bev一二线序贯治疗策略对比,TRIBE2研究提出的一线FOLFOXIRI+Bev进展后二线再次引入的模式,能显著延长PFS和OS,尽管整组患者群体的预后不良特征较多,但总生存仍然达到27.6个月,因此,研究认为对于右半、RAS/BRAF突变的患者,如果身体适合,FOLFOXIRI+Bev应该是最好的一线治疗方案。
研究解读
这是本次ASCO年会唯一入选口头报告的两个mCRC相关研究,我印象中也是近5年来首次在口头报告中mCRC相关研究占比最少的一次(仅为25%),说明目前结直肠癌的总体基础研究、临床研究及诊疗进展均进入一个瓶颈区,亟需突破。
巧合的是,这两个研究均关注了同一个话题:mCRC中预后更差群体的初始强烈治疗,也就是三药FOLFOXIRI为基础的方案。鉴于贝伐珠单抗(Bev)临床使用的良好安全性、耐受性,以及与普通化疗毒副反应没有明显叠加,Bev被用来与越来越强烈的化疗方案联合,治疗那些肿瘤负荷较重、预后不良且身体状况良好的mCRC患者,目前的最强烈组合当属FOLFOXIRI+Bev。意大利TRIBE研究首次在大规模III期随机对照试验里证实了FOLFOXIRI+Bev的疗效显著优于目前临床标准方案FOLFIRI+Bev,成为治疗的新选择。目前三药联合Bev的方案已经被多个指南(NCCN、ESMO、CSCO等)推荐为临床实践中的一个标准治疗选择。
尽管目前临床上对三药方案的使用开始增多,但仍备受争议,很多肿瘤内科医生仍在观望,在我国尤甚。除了对耐受性/毒性的担忧之外,还面临其他问题:一线治疗里一次性就将几乎所有能用的药物全部用完,疾病进展后如何选择后续治疗?mCRC如果一线治疗选择两药化疗+Bev,按目前标准策略,二线更换化疗并跨线继续使用Bev,那么患者也就会在二线结束后使用到了所有的三个细胞毒化疗药,这样还有必要使用如此强烈的FOLFOXIRI方案吗?
针对这些疑虑及问题,我们试图从现有研究中寻找答案,仔细分析两个研究后,得出的启示包括如下几个方面:
1.和标准两药方案(FOLFOX或FOLFIRI)比较,一线三药方案均能获益
从疗效来讲,现有的数据应该很夯实了,和标准治疗相比,不管是FOLFOX还是FOLFIRI为基础,更加强烈的三药方案为基础的治疗带来了更多的生存获益。本次的西班牙研究VISNU-1虽然说并没有带来更多额外的启示,但个人认为其最大的价值是补充了FOLFOX为基础方案的数据。因为TRIBE研究证实了FOLFOXIRI+Bev优于FOLFIRI+Bev,但一直没有大型研究去证实该三药方案是否也优于FOLFOX+Bev,事实上,后者是临床上更为常用的一线治疗方案,尤其在我国,以及北美等国家。VISNU-1研究现在补上了这一缺憾。
2.预后越差的群体,越需要强烈治疗:
简单来说,本次的VISNU-1和TRIBE2两个研究,最后结果及结论均证明了一个非常合理的想法:预后越差的患者,越需要更强烈的治疗,更能从更强烈的治疗中获益。
那么,这两个试验是如何界定预后差的群体的呢?
VISNU-1使用了液体活检技术,将CTC>3定义为预后差的群体,正如点评嘉宾在讨论中提到的一样,已经有很多研究证实CTC超过3个的mCRC的确是预后不良,PFS和OS均显著缩短。VISNU-1研究亚组分析也显示CTC越多,三药组获益越大,CTC为3-20组与CTC>20个组比较,PFS的HR分别为0.685(95%CI 0.516-0.908)和0.398(95%CI 0.191-0.829)。

而TRIBE2研究则是使用了常用的临床病理参数来定义预后不良群体:原发瘤位于右半,RAS或BRAF突变。这些都是目前公认的预后不良因素,在TRIBE2研究里,符合上述三个因素的群体比例高达79%。而这样一个群体,中位PFS1高达12个月,在终点事件仅有56%的时候,中位OS已经达到27.6个月,和总体预后较好的FIRE-3和CALGB 80405群体(KRAS野生,多数为左半)已经超越或相当。待TRIBE2的OS数据成熟后,最终结果会是什么呢?这是很值得期待的。我还记得2018年ESMO结束后,当时TRIBE2尚未公布OS数据,我曾经预测最终OS差异会在6-7个月(详见《肿瘤综合治疗电子杂志》2019,5[1]:5-14),这次ASCO公布的OS初步数据,差异是5个月,看来我还是很有信心自己的预言能变为事实。

本次TRIBE2研究更新的数据还提示FOLFOXIRI+Bev是一个有效的转化治疗方案。在这样一群初始不可切除的总体预后不良患者中,带来了17%的R0切除率,对于仅有肝转移的群体,R0切除率更是高达38%。在我印象中,这是迄今为止看到的mCRC并未以转化为目标设计的临床试验中最高的转化切除率了。
3.一线使用三药FOLFOXIRI进展后的治疗选择:TRIBE2的启示
关于这个临床困惑,TRIBE系列研究给了很好的启示,
首先,要合理布局“诱导”与“维持”。TRIBE研究是诱导治疗6个月才进入维持,而TRIBE2研究则设计为诱导4个月后就进入维持治疗,为后续的三药再引入增加了可能性。同时,对于这群晚期的患者来说,能更好的保证生活质量。但也要注意另外一个潜在的风险,那就是更快进入维持可能会导致疾病更快进展,虽然在TRIBE2研究里,PFS1长达12.0个月,并不比TRIBE研究里的12.1的短,但个人感觉对于那些有转化需求及可能的患者,如果能耐受,还是应该尽量延长诱导治疗的时间。
其次,维持后进展的患者,后线具有多重选择,TRIBE2这个独树一帜的研究最大的贡献即在于告诉我们,一线的FOLFOXIRI+靶向(Bev)可以再来一次,而这种策略在68%的患者中均实现了。TRIBE2的设计不可谓不大胆、不新颖,完全出乎意料,超越了常规的临床思路,如此强烈的治疗方案也走“重引入”的策略,这种临床研究的思路确实好好给我们上了一课。除此以外,还有经典的“减法策略”,比如减为两药+靶向、单药+靶向,甚至于直接进入三线治疗。事实上,鉴于TRIBE2二线重引入FOLFOXIRI+Bev后带来的PFS获益甚微(尽管统计学有意义),很多临床医生会倾向于二线就做减法策略,比如本次ASCO的点评嘉宾的观点就如此。但这样重引入FOLFOXIRI+Bev的策略对最终OS的影响到底如何,目前还是没最终答案。TRIBE研究里,一线使用一次为期6个月的FOLFOXIRI+Bev最终带来了5.2个月的额外OS获益,目前TRIBE(使用两次,每次4个月,共8个月。二线PFS 6.5个月,按照方案设计,二线使用FOLFOXIRI的中位时间应该为4个月)在随访30.6个月、OS终点事件仅发生56%(对照组发生了64%)时已经获得了5个月的OS差异,我猜测TRIBE2最终的OS差异要超过TRIBE研究。也许这反应了一个目前尚无法解释的现象:更强烈的治疗可能通过改变了肿瘤生物学行为而对长期生存起到潜在的影响,这种现象在既往的FIRE-3、CALGB80405研究中均出现过,尤其是左半,尽管PFS未延长,但最后的OS均显著延长,其中一个解释除了后续治疗带来一些影响以外,更大的影响可能就是来自于一线的强烈治疗。

最后,假如一线FOLFOXIRI+靶向诱导治疗后无法进入维持治疗,提示这些患者为快速进展群体,预后极差,应该进入新药临床试验或停止治疗,转而保证生活质量。事实上,这些患者在如此强烈的方案治疗下也无法控制疾病,那么假如一线接受传统的两药+靶向治疗,只会更加迅速的进展,或者说,会有更多的患者进展。因此,从这个角度看,那些进展风险更高的患者,更应该在身体情况允许的前提下接受最强烈的治疗。
4.临床如何筛选FOLFOXIRI+/-靶向的合适群体:安全性启示
首先要考虑的当然是身体状况,务必要筛选适当患者避免治疗毒性带来的伤害。从两个研究的入组标准来看,年龄和PS都是重要的条件,VISNU-1限定年龄<70岁、PS0-1,TRIBE虽然年龄放宽到75岁,但要求71-75岁患者必须PS=0;而国内临床实践中使用三药经验最丰富的中山6院邓艳红教授的300多例资料(非随机研究)显示,中位年龄为52岁。因此,临床实践中挑选合适患者时,最重要的是年龄和整体PS状态。
在经过适当筛选后,尽管整体治疗毒性增加,但这两个研究结果提示毒性均是可控的。尤其是TRIBE2结果显示二线再次引入后,一线常见的粒细胞减少及相关发热、腹泻等重要毒性在二线治疗中并没有差异,提示在一线治疗中耐受的患者,二线再引入的耐受性也许更好。临床实践中使用FOLFOXIRI+Bev时,可以很好的参照这些研究数据,当然,如果是计划使用FOLFOXIRI+EGFR单抗,可能对身体状况的要求要更高。
5. 临床如何筛选FOLFOXIRI+/-靶向的合适群体及未来可能的研究
肿瘤特征启示VISNU-1和TRIBE2研究均主要针对了所谓“预后不良群体”,表明预后不良者需要更强烈治疗,这是一个非常能被广为接受的合理观点,但在具体的治疗方案选择上,何为“强烈治疗”,是有不同选择的,对于仅适合使用含bev方案的患者(右半或RAS/BRAF突变)来说,FOLFOXIRI是目前最强烈的治疗方案,但对于适合使用含EGFR单抗的患者(例如RAS/BRAF野生的左半mCRC)来说,目前我们并没有数据表明两药+EGFR单抗与FOLFOXIRI+Bev 疗效上孰优孰劣。鉴于目前三药FOLFOXIRI+EGFR的数据较少,实际临床实践中耐受性也更差一些,但相信随着三药+Bev这些研究带来的理念改变以及经验分享,会有越来越多的相关研究出现,比如来自德国的小型II期研究VOLFI就是一个例子。国内相关试验也会增多,中山大学肿瘤医院李宇红教授就牵头了TRICE研究来探索FOLFOXIRI+西妥昔单抗对比FOLFOX+西妥昔单抗用于仅有肝转移RAS/BRAF野生型患者的转化治疗。
不管临床实践还是临床试验,需要强调的是要基于现有的数据、科学观点并充分考虑伦理。关于这一点,尝试从本次ASCO的两个研究中寻找答案。遗憾的是VISNU-1研究中无法确切得知这种EGFR优势群体(左半且RAS/BRAF野生)比例为多少,仅知道RAS或BRAF突变群体大约60%,右半28%,不重叠的比例估计70%以上。但TRIBE2研究已经充分考虑到了这个问题,入组的原发瘤左半RAS/BRAF野生群体仅为16%。有这个人群特征构成也充分说明TRIBE2研究者在筛选患者入组时是充分考虑了现有科学证据和伦理的,对于那些目前认为一线治疗属于EGFR单抗优势人群的患者,尽量不纳入研究,充分保障了患者的权益,这一点值得我们国内的同行思考和借鉴,那就是临床研究始终要把患者权益摆在第一位,尤其是很多IIR(研究者发起的试验),有时会为了追求入组率而忽略了患者权益保护。
综上所述,个人认为目前FOLFOXIRI+bev这种强烈的一线治疗模式原则上应该限于不适合使用EGFR单抗的临床情形,比如右半、RAS/BRAF突变,对于适合使用EGFR单抗的患者,我们仍然需要更多的研究来对比不同的治疗策略,未来会不会有人去设计左半RAS/BRAF野生型mCRC,一线治疗FOLFOXIRI+bev对比两药化疗+西妥昔单抗的临床研究呢?假如我来设计,伦理角度出发,对照组应该设计为两药+EGFR单抗序贯两药+Bev,而不是TRIBE2研究里的两药+Bev序贯模式。
查看更多