查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





杨 柳 综述 张 炯 审校
[基金项目] 东部战区总医院临床研究专项课题(22LCYY-XH7)
[作者单位] 东部战区总医院 国家肾脏疾病临床医学研究中心(南京,210016)
DOI:10.3969/j.issn.1006-298X.2024.02.013
摘 要
糖尿病肾脏疾病(DKD)可经多重机制损伤肾小球足细胞,足细胞病变进一步促进DKD进展。盐皮质激素通过作用于盐皮质激素受体(MR)调节人体水盐平衡、体液容量和血压。MR表达于足细胞、内皮细胞、系膜细胞等肾小球固有细胞,其活化将影响足细胞的结构和功能,损坏滤过屏障,导致蛋白尿。糖尿病状态下MR过度活化提高足细胞内氧化应激水平,损伤细胞超微结构,抑制足细胞自噬、促进凋亡,导致蛋白尿和肾脏局部炎症,阻断MR可避免足细胞结构受损、功能障碍和数量减少,有助于修复滤过屏障。本文将综述糖尿病导致足细胞损伤的病理生理机制,MR拮抗剂(MRA)保护足细胞的基础和临床研究,为MRA治疗DKD足细胞病变、减少蛋白尿、改善肾脏预后提供理论依据。
关键词 糖尿病 足细胞 盐皮质激素受体
Advances of mineralocorticoid receptor antagonists treating diabetic podocyte injury
YANG Liu, ZHANG Jiong
National Clinical Research Center for Kidney Diseases, Jinling Hospital, Nanjing 210016, China
ABSTRACT
Diabetic kidney disease (DKD) induces glomerular podocytes damages in multiple pathways, and podocyte lesions promote the progression of DKD. Mineralocorticoid regulates the salt and water concentration, fluid volume, and blood pressure by acting on mineralocorticoid receptor (MR). MR expresses on intrinsic glomerular cells, such as podocytes, endothelial cells and mesangial cells. Its activation could change the structure and function of podocytes, damage the filtration barrier, and cause proteinuria. In the condition of diabetics, over-activation of MR will produce proteinuria and inflammation within kidney locally by upreglating oxidative stress, impairing ultrastructure, inhibiting autophagy and promoting apoptosis of podocytes. Blocking MR will prevent structural impairment, dysfunction and loss of podocytes, and even repair the filtration barrier. Here we review the pathophysiological mechanism of podocyte injury caused by diabetes, and the basic and clinical studies on the protection of podocytes with MR antagonist (MRA), so as to provide a theoretical basis for MRA to ameliorate podocyte injury, reduce proteinuria, and improve kidney prognosis in the population with DKD.
Key words diabetic mellitus podocyte mineralocorticoid receptor
近几十年科学技术的发展延长了人类平均寿命,同时造成2型糖尿病(T2DM)发病率升高,糖尿病肾脏疾病(DKD)在部分亚洲地区终末期肾病(ESKD)中占48%,2011年起我国DKD在慢性肾脏病(CKD)占比超过原发性肾小球肾炎,并已成为老年ESKD的重要病因[1]。研究发现糖尿病引起肾小球基膜(GBM)外侧附着足细胞数量减少,高血糖诱导足细胞凋亡,而足细胞特异性核苷酸寡聚结构域样受体(NLRP3)炎性小体活化、足细胞自噬异常促进DKD发展,表明DKD损伤足细胞,同时足细胞病变加速DKD进展[2]。醛固酮作用于远端肾单位上皮细胞表达的盐皮质激素受体(MR),调控肾小管对水、钠重吸收及钾排泄,对维持容量和血压平衡有重要作用。MR还表达于足细胞、内皮细胞、系膜细胞、成纤维细胞等,糖尿病状态促使MR在上述部位表达上调,MR过度活化可造成肾脏损伤[3-4]。本文将综述糖尿病导致足细胞损伤的机制(图1),尤其关注MR活化对足细胞的影响,综述MR拮抗剂(MRA)治疗足细胞病变的研究,以期为治疗糖尿病足细胞病变、减少蛋白尿、改善DKD预后提供理论依据。
图1 MR过度活化造成肾脏损伤[3-4]
MR:盐皮质激素受体;ROS:活性氧;Rac1:Ras相关C3肉毒杆菌毒素底物1;MR表达于肾小管上皮细胞、肾小球足细胞、内皮细胞、系膜细胞、成纤维细胞等处,ROS、Rac1、醛固酮、皮质醇、葡萄糖等促使MR过度活化,继而导致肾小管损伤、肾小球硬化、肾小管间质纤维化
糖尿病可通过促进脂质聚集、生成活性氧(ROS)、内质网应激等多种途径导致肾小球足细胞受损甚至脱离GBM,足细胞密度减低使滤过屏障功能减弱,产生蛋白尿和肾脏局部炎症,进一步促进DKD发展[5]。
抑制足细胞自噬、促进凋亡 足细胞表面表达MR、整合素β1、微管相关蛋白3(LC3)、p85-磷脂酰肌醇3激酶(PI3K)、p-蛋白激酶B(Akt)、p-哺乳动物雷帕霉素靶蛋白(mTOR)等分子。PI3K/Akt/mTOR信号通路主要调节细胞生长、凋亡及其他重要细胞信号转导,是细胞自噬的主要调控路径。T2DM胰岛素抵抗、高血糖造成炎症、氧化应激,Akt表达和活性下降,抑制PI3K/Akt/mTOR信号通路活化,使足细胞能量代谢紊乱、凋亡加剧、自噬通量下降,导致肾脏损伤[6-8]。体外研究中高糖状态激活足细胞内Janus激酶(JAK)/信号转导及转录激活因子(STAT)信号通路,自噬受抑、凋亡增加,而经JAK抑制剂处理后足细胞自噬相关蛋白表达增加,高糖促使Bcl2相关X蛋白(Bax)和半胱氨酸天冬氨酸蛋白酶3(caspase-3)等凋亡蛋白水平升高、LC3下降,DKD小鼠肾组织JAK1、JAK2、STAT1、STAT3、STAT5、STAT6表达增多,LC3数量减少50%,JAK抑制剂可明显强化足细胞自噬,表明JAK/STAT通路活化使DKD小鼠足细胞自噬受抑、凋亡增加[9]。肾组织转化生长因子β(TGF-β)通过活化半胱氨酸蛋白酶3上调线粒体烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)4表达,升高ROS水平,诱导足细胞凋亡[10]。糖尿病小鼠足细胞和系膜细胞过表达NOX-5,NOX表达失衡可先后活化蛋白激酶C(PKC)、TGF-β,最终实现促凋亡效应[11]。
损伤足细胞功能 高糖促进β连环蛋白靶基因表达,下调podocin和synaptopodin等足细胞特异标志物水平,促进足细胞上皮间质转分化并破坏其结构完整性[12]。糖尿病诱导双特异性磷酸酶(DUSP)4表达减少,提高p38丝裂原活化蛋白激酶(p38 MAPK)和c-Jun氮末端激酶(JNK)活性,加重足细胞功能障碍,而糖尿病患者肾皮质DUSP4 mRNA表达减少与肾小球滤过率下降相关[13]。DKD患者肾组织NLRP3炎性体表达水平升高,其活化可抑制足细胞自噬,沉默NLRP3不仅有效恢复足细胞自噬,同时减轻高糖所致足细胞损伤[14]。由此可见,DKD经PI3K、JAK、TGF-β、MAPK等多条凋亡相关通路发挥作用,同时影响细胞自噬和炎症水平,损伤足细胞。
MR属于核受体家族,通过刺激盐皮质激素靶基因表达参与血管内皮功能障碍、胰岛β细胞功能紊乱、心脏纤维化和肥大、氧化应激等过程,对盐皮质激素和糖皮质激素具有类似亲和性。在血浆醛固酮水平正常甚至偏低的情况下,拮抗MR仍可带来肾脏获益,提示在醛固酮依赖性途径以外,肾固有细胞内MR过度活化还通过醛固酮非依赖途径造成组织损伤,目前相对明确的机制包括MR基因表达增多、敏感度增强、稳定性提高或糖皮质激素刺激MR[15]。MR是远端肾单位主细胞表达的唯一醛固酮结合受体,与醛固酮形成醛固酮-MR复合物,结合糖皮质激素反应元件,活化顶部上皮钠离子通道和基底侧钠-钾ATP酶,通过经典的醛固酮依赖途径介导主细胞离子转运,促进钠重吸收和钾排泄,调节体内钠钾稳态、细胞外液容量和血压水平[16]。在闰细胞内,醛固酮-MR复合物提高Pendrin表达水平,继而促进Cl-重吸收并减少钾分泌,同时增加钠-氯转运体活性,促进远端小管对Na+和Cl-的重吸收。MR同时表达于足细胞、系膜细胞、巨噬细胞和成纤维细胞等,盐皮质激素过度活化MR造成慢性炎症和纤维化,驱动DKD的发生和发展[16]。醛固酮还诱导NOX产生ROS,激活细胞外信号调节激酶(ERK)1/2和JNK1/2,促进钙内流,提高细胞内pH值,活化PKC,继而调节离子转运体和钠泵磷酸化,醛固酮上述非基因组效应能迅速调节细胞钠稳态,造成氧化损伤,介导心室重构[17]。在无醛固酮的情况下,MR主要定位于细胞浆,加入醛固酮能促进MR由细胞质转运至细胞核内。MR拮抗剂(MRA)可快速抑制醛固酮对心脏和血管平滑肌细胞钠-氢转运体的激活,表明细胞内MR参与实现非基因组效应[17]。
体外培养的大鼠足细胞表达MR,加入醛固酮可诱导足细胞产生丝氨酸-苏氨酸激酶(Sgk)1,提高细胞内氧化应激水平,改变细胞功能,促进足细胞凋亡,呈醛固酮剂量和时间依赖性,醛固酮抑制PI3K/AKT活化,并提高p38MAPK活性,PI3K抑制剂能全面抑制该通路活化,而p38MAPK抑制剂则减轻足细胞内p38MAPK磷酸化并抑制细胞凋亡[18-19]。高盐饮食喂养的单侧肾切除大鼠在注射醛固酮2周后尿蛋白及血压进行性升高,足细胞足突裂孔蛋白nephrin和podocin表达明显减少,免疫组化和电镜证实足细胞超微结构受损,肾组织NADPH活性下降,氧化应激加重[19]。以高血压、肥胖、糖耐量减低和高脂血症为表现的代谢综合征模型大鼠,肾病早期出现蛋白尿和足细胞足突融合,同时外周血醛固酮水平和肾小球Sgk1及氧化应激标志物表达水平明显升高,表明醛固酮信号增强[20]。先天性肾病综合征模型RhoGDIα基因缺失鼠的外周血醛固酮水平类似于野生型小鼠,但MRA仍可以明显减轻其足细胞损伤并减少蛋白尿[21]。小分子GTP酶Ras相关C3肉毒杆菌毒素底物1(Rac1)能够调节肌动蛋白细胞骨架、影响超氧化物生成及核转录因子,并促使MR易位和活化,高度活化的Rac1激活MR,加重足细胞损伤和肾小球硬化[21]。后续研究证实抑制Rac1-MR信号可减轻肾脏损伤,足细胞Rac1活性异常升高则导致多种肾脏疾病,而炎症、高血压、高盐饮食、氧化应激等因素均会活化Rac1,加速肾病进展[22]。但特异性敲除抗GBM肾炎小鼠足细胞MR后,蛋白尿和肾脏损伤程度未减轻,拮抗MR同样无法改善其肾脏病变,足细胞MR似乎在肾小球肾炎发病中作用不明显,如敲除抗GBM肾炎小鼠巨噬细胞MR或以MRA处理,肾小球损伤和肾组织炎症均显著减轻[23]。可见在糖尿病、盐敏感性高血压等代谢性疾病MR活化可导致足细胞病变,但其对肾小球及间质损伤的影响仍有待于进一步探讨。
MRA可减轻肾小球足细胞损伤,减少蛋白尿、降低血压、减轻心脏肥大、抗炎、延缓肾小球硬化等作用独立于肾小球血流动力学改变[18-20]。甾体类MRA螺内酯可上调体外培养的人足细胞整合素β1、LC3表达,促进自噬,使足细胞损伤减轻,黏附功能改善[6]。以螺内酯处理体外培养的大鼠足细胞,不仅减轻醛固酮的促凋亡作用,还明显逆转其对PI3K/AKT和p38MAPK信号通路的影响[18]。螺内酯可减少选择性转染足细胞的Nphs1-Hcd25(NEP25)转基因小鼠的肾小球Ⅳ型胶原沉积,降低肾小球硬化指数(GSI),且足细胞数量明显高于对照组[23]。甾体类MRA依普利酮可几乎完全避免足细胞损伤、肾小球硬化,降低血压及减少蛋白尿,肾组织NADPH活性水平降至正常,Sgk1表达减少[19]。依普利酮减少蛋白尿、减轻足细胞损伤,下调Sgk1表达水平和氧化应激程度,提示MR在代谢综合征足细胞病变中具有致病作用[20]。
糖尿病和肾小球硬化动物模型中阻断MR能有效避免足细胞丢失或功能受损[23]。高糖环境培养的足细胞经螺内酯处理后,细胞凋亡和氧化应激受到明显抑制,同时整合素β3表达减少,足细胞足突融合消失程度减轻[24]。DKD大鼠模型在螺内酯处理后,蛋白尿明显减少,肾组织结构损伤明显减轻,足细胞特异性标志物WT1和NPHS2水平升高,自噬标记物Beclin1和LC3B表达增多,表明螺内酯促进足细胞自噬[25]。在db/db单侧肾脏切除小鼠中联合使用依普利酮和依那普利,在减少蛋白尿、减轻足细胞损伤、改善肾组织纤维化和降低炎症及氧化应激水平方面的效果均强于单药干预[26]。相较于甾体类MRA,非甾体类MRA半衰期更短,抗雄激素和促孕激素的副作用更轻,抑制炎症和纤维化的作用更强。在高血压T2DM小鼠使用非甾体类MRA,其降蛋白尿、减轻肾小球损伤和小管间质纤维化、控制炎症和氧化应激的程度均强于螺内酯[27]。非甾体类MRA可减少代谢综合征大鼠蛋白尿和降低中性粒细胞明胶酶相关脂质运载蛋白水平,不影响肾脏血流动力学和肾血管阻力,表明拮抗MR后大鼠肾小球滤过屏障得以修复[28](图2)。
MRA:盐皮质激素受体拮抗剂;NADPH:烟酰胺腺嘌呤二核苷酸磷酸氧化酶;Sgk1:丝氨酸-苏氨酸激酶1
一项荟萃分析纳入31项MRA治疗2 767例CKD的临床研究结果显示,相较于安慰剂,MRA可使尿白蛋白/肌酐比值(UACR)下降24.55%,UPCR下降53.93%,24 h尿蛋白定量减少32.47%,表明MRA对CKD患者有显著减少蛋白尿作用,可将MR作为CKD治疗新靶点[29]。螺内酯治疗DKD的荟萃分析显示,加用螺内酯组24 h尿蛋白定量明显减少(P=0.000 6),组间平均UACR变化不显著,但研究结束时UACR相较于基线明显下降(P=0.04),可能与所纳入研究中治疗组和对照组基线UACR不一致有关[30]。
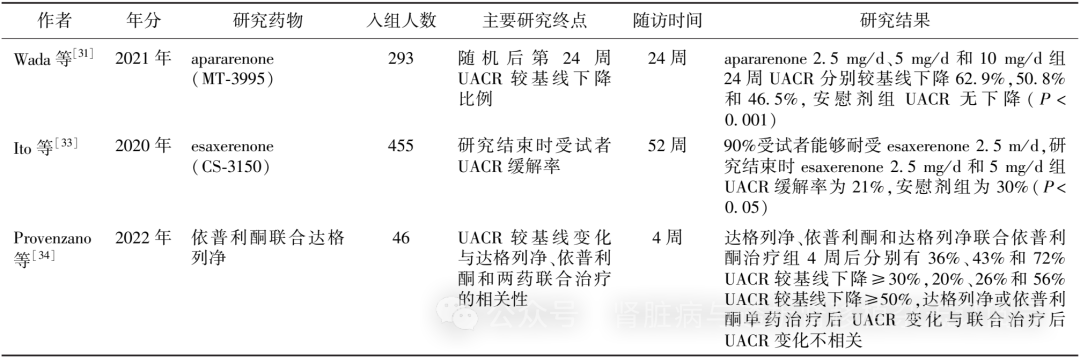
近期又有新的研究发表(表1)。apararenone (MT-3995)治疗DKD的2期临床试验,以24周UACR较基线变化为主要研究终点,apararenone 2.5 mg/d、5 mg/d、10 mg/d治疗24周后UACR分别较基线下降62.9%、50.8%和46.5%(P均<0.001),各剂量组UACR缓解率(UACR较基线下降≥30%)分别为7.8%、29.0%和28.1%[31]。esaxerenone(CS-3150)治疗DKD的2期临床试验观察到药物干预12周后,esaxerenone 1.25 mg/d、2.5 mg/d和5 mg/d组相较于安慰剂组UACR下降38%、50%和56%(P均<0.001), 2.5 mg/d组和5 mg/d组UACR缓解率为21%[32]。esaxerenone治疗DN的3期临床试验显示52周后UACR较基线下降58%,研究药物相较于安慰剂有效减少蛋白尿[33]。Provenzano等[34]报道了以达格列净联合依普利酮对比单药治疗CKD的临床研究,其中30.4%受试者无糖尿病,治疗4周后联合用药组UACR较基线下降53%,达格列净组下降19.6%,依普利酮组下降33.7%,高钾血症发生率在联合用药、达格列净和依普利酮组分别为4.3%、0和17.4%,表明联合治疗降低UACR效果更强。一项纳入17项研究共34 412例受试者的荟萃分析显示,单用MRA或钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)分别使UACR较基线下降32.97%和31.03%,MRA降低UACR作用略强于SGLT2i但无统计学差异(P=0.03),MRA联合SGLT2i治疗后UACR较基线下降65.22%,单用MRA或SGLT2i分别使血压较基线下降5.8%和5.9%,两者降压效果无明显差异(P=0.98),MRA联合SGLT2i治疗后血压较基线下降9.13%[35]。
表1 盐皮质激素受体拮抗剂治疗糖尿病肾脏病的近期临床研究
小结:足细胞损伤是DKD的重要特征之一,也是蛋白尿发生的关键影响因素。抑制MR过度活化可避免足细胞结构和功能受损,促进滤过屏障修复,减少蛋白尿。MRA治疗DKD的大型临床研究显示,拮抗MR可有效减少蛋白尿、改善肾脏预后。新型MRA(非奈利酮)单药、SGLT2i(恩格列净)单药或两者联用治疗DKD的Ⅲ期临床试验CONFIDENCE和非奈利酮治疗非糖尿病CKD的Ⅲ期临床试验FIND-DKD均已启动,研究结果有望为CKD患者带来更佳获益。


来源:肾脏病与透析肾移植杂志订阅号
查看更多