查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者: 中国医科大学附属盛京医院 潘雪
术前情况
基本情况:姓名:杨XX,性别:女,年龄:47岁。
主诉:下腹痛1个月余。
妇科检查:双侧附件区包块,左侧大小约4cm左右,右侧大小6cm左右,活动欠佳。右侧骶韧带结节增厚。
家族史:否认。
肿瘤标记物:CA125:711.6 U/ml ,HE4:358.6 pmol/L,ROMA-B:91.8,ROMA-A:94.5,CEA,CA199均正常范围。
彩超:双附件区囊实混合性肿物,左侧大小约2.9x3.4cm,右侧大小约5.6x4.5cm,CDFI均可检出较丰富血流信号,建议进一步除外卵巢cancer。
胃肠镜:未见明显异常。
PET-CT:1、盆腔内多发软组织密度肿块、结节,SUVmax=17.17,邻近网膜增厚,盆腔脂肪间隙密度增高,考虑恶性(卵巢癌?)可能大,需注意盆腔网膜转移;盆腔少许渗出、积液。2、腹膜后、左侧锁骨上及左侧颈部多发代谢增高肿大淋巴结,考虑淋巴结转移。
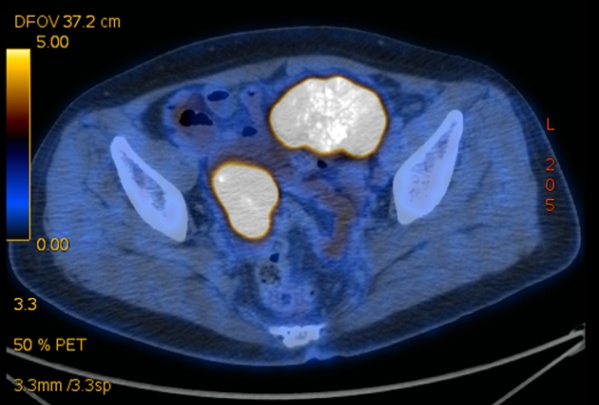
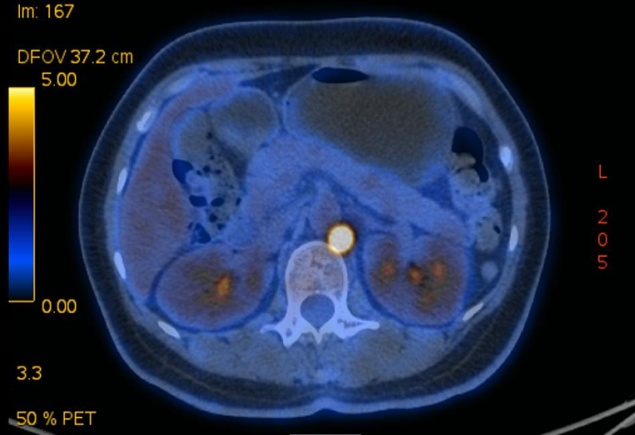
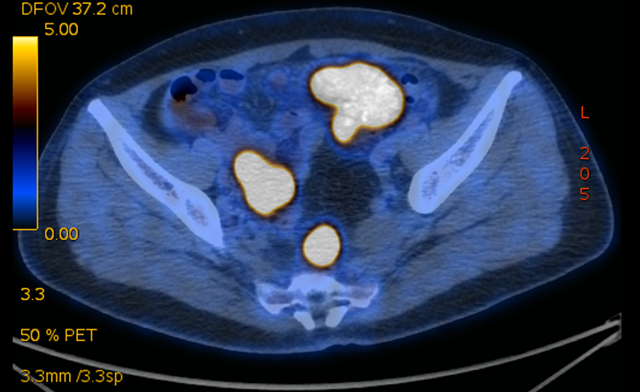
术前临床诊断:卵巢癌IVB期!
患者治疗选择
晚期(III、IV期)卵巢癌的初始治疗目标:R0 !!!
手术? or 新辅助化疗+手术?
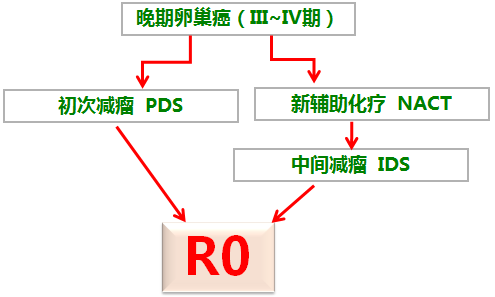
卵巢癌手术切除范围
上腹部根治性手术:膈、肝、脾、胰等切除Optimal 80%。
盆腔超根治手术:改良后盆腔肿瘤清除术;部分直肠-乙状结肠切除;部分膀胱、输尿管切除;广泛肠管切除;Optimal 50%。
标准手术:全子宫/双附件/大网膜/阑尾+系统的腹主动脉旁淋巴结切除Optimal 30%。
治疗前评估
影响能否“R0”因素
上腹部病变
盆腔病变
患者的状态
手术团队
术中情况
2017-12-12:行卵巢癌肿瘤细胞减灭术+肠管切除术+肠管吻合术。
术中所见:淡血性腹水1000ml,盆腔粘连,右侧卵巢肿物5*5*4cm,与周围组织粘连,右侧盆壁腹膜,右侧骶骨韧带受侵,左侧卵巢肿物侵及膀胱浆膜层及乙状结肠浆肌层,形成包裹,病变范围最大直径7cm。
盆腹腔肉眼残留病灶:无,“R0”!!! (颈部淋巴结未处理)。
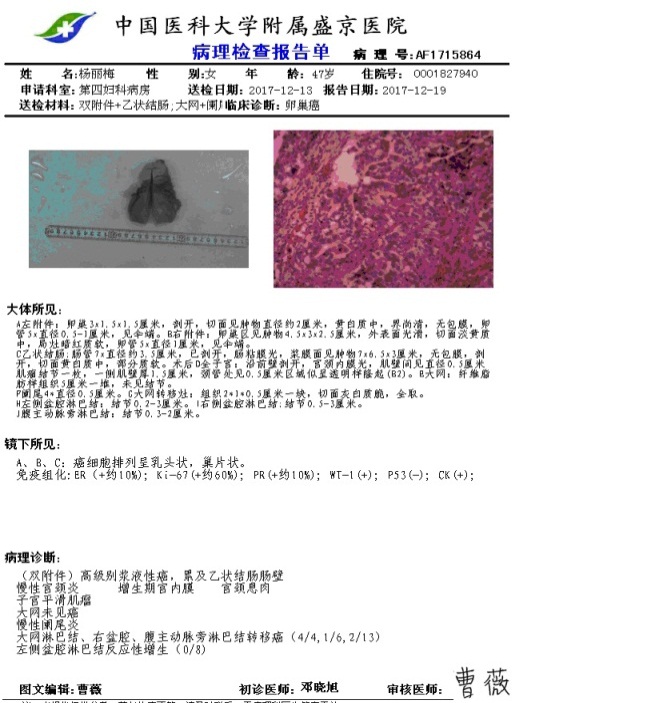
术后病理
双附件高级别浆液性癌。
乙状结肠肠壁受累。
大网淋巴结、右盆腔、腹主动脉旁淋巴结转移癌(4/4,1/6,2/13)。
手术病理分期:卵巢高级浆液性癌IV期。
术后化疗
NCCN指南卵巢上皮癌一线静脉化疗方案(2018.V2)
1、顺铂腹腔/紫杉醇静脉化疗
2、紫杉醇+卡铂 3周疗
3、多西紫杉醇+卡铂 3周疗
4、紫杉醇周疗+卡铂 3周疗
5、低剂量紫杉醇+卡铂周疗
6、卡铂+多柔比星脂质体 4周疗
7、紫杉醇+卡铂+贝伐单抗
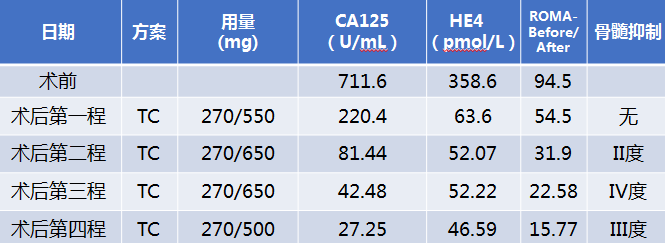 卡铂AUC :5 ,紫杉醇:175 mg/m2 ,d1,q21;第四程后:PLT 61*10^9/L,遂更改方案为TP继续化疗
卡铂AUC :5 ,紫杉醇:175 mg/m2 ,d1,q21;第四程后:PLT 61*10^9/L,遂更改方案为TP继续化疗
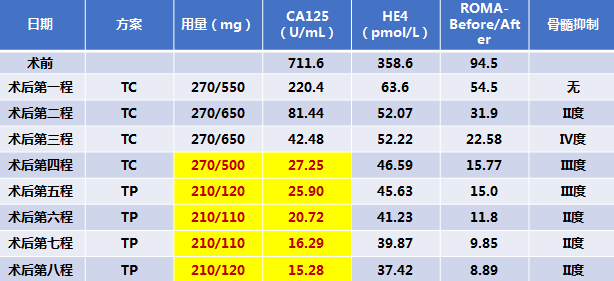
停疗日期:2018年6月1日
注:顺铂75 mg/m2 ,紫 你 杉醇135 mg/m2 ,d1,q21
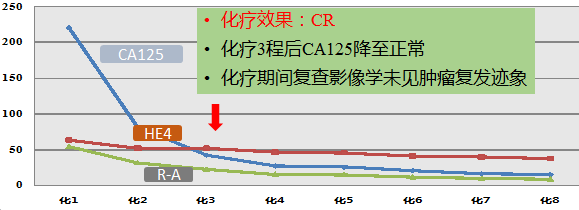
肿瘤标记物变化
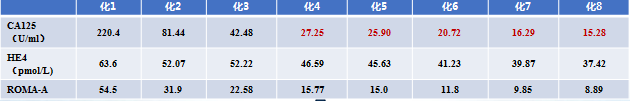
治疗选择
手术+化疗;新辅助化疗+手术+化疗
如何进一步治疗?
观察随访?
后续治疗?
晚期卵巢癌治疗现状
3年内复发,再治疗,多线化疗,且化疗有效期逐渐缩短
值得期待的Solo 1 结果,值得期待的奥拉帕利
Study 19 and Solo 2:铂敏感复发2线维持治疗有效。
Solo 1: BRCA突变铂敏感1线维持(2018.10)。
停疗日期:2018年6月1日。
ESMO:2018年10月。
美国FDA2018年12月批准用于BRCA突变患者一线维持治疗。
化疗后维持治疗及随访
2018年7月行基因检测:BRCA1突变。
2018年7月23日起奥拉帕利(Olaparib)300mg Bid po(6.1停化疗,其后满7周)。
副反应:偶有恶心,乏力,无其余不适主诉。
服药期间化验血常规及肿瘤标记物如下:
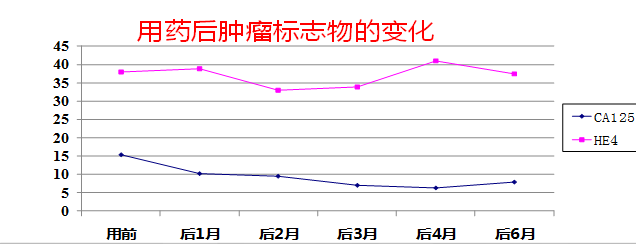
肿瘤标记物与化疗结束时相比,呈继续下降趋势。
血常规除血小板计数略下降,余未见明显异常。
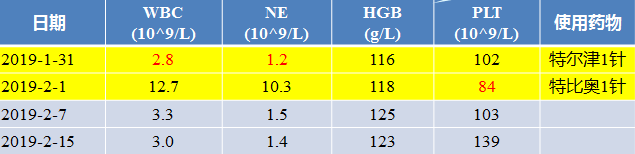
2019年1月29:日早患者因误多服奥拉帕利300mg
2019年1月31:化验血常规白细胞及中性粒细胞均达II度骨髓抑制(WBC2.8x10^9/L,NE1.2x10^9/L)予特尔津1针皮下注射
复查:血常规血小板降至84x10^9/L,再次予特比奥1针升板治疗
嘱患者奥拉帕利减量为早150mg晚300mg口服
2019-2-7:再次复查血常规恢复正常。
卵巢癌靶向治疗药物:PARP抑制剂--奥拉帕利
作用机制:
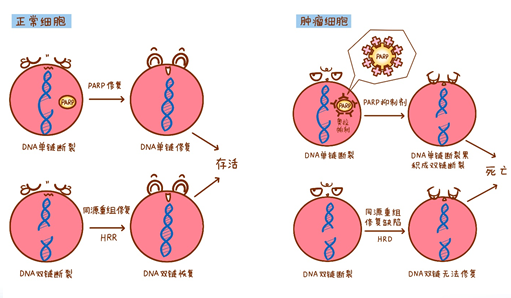
奥拉帕利(Olaparib)适应症
2014年12月欧盟EMA 获批
铂敏感复发的高级浆液性上皮性。
卵巢癌、输卵管癌、原发腹膜癌。
胚系BRCA突变。
含铂化疗后处于CR或PR。
单药维持治疗。
2017年8月美国FDA获批
维持治疗。
复发的上皮性卵巢癌、输卵管癌、原发腹膜癌。
含铂化疗后处于CR或PR。
单药治疗。
既往接受过≥3线化疗治疗的晚期卵巢癌。
具有可以致病胚系BRCA基因突变阳性。
奥拉帕利(Olaparib)适应症。
2018年8月22日奥拉帕利中国获批,中国卵巢癌靶向治疗之路正式开启
铂敏感复发上皮性卵巢癌、输卵管癌,或原发性腹膜癌。
含铂化疗后处于CR或PR。
无论BRCA突变与否。
2018年10月21日 ESMO公布
PARP抑制剂在卵巢癌一线维持治疗的SOLO1研究结果。
2018年12月美国FDA获批
BRCA突变晚期卵巢癌的一线维持治疗。
Olaparib对于新发初治卵巢癌效果如何?
2018年10月21日 ESMO发布SOLO 1奥拉帕利用于携带BRCA1/2突变的晚期卵巢癌含铂类化疗
初始治疗后的维持治疗

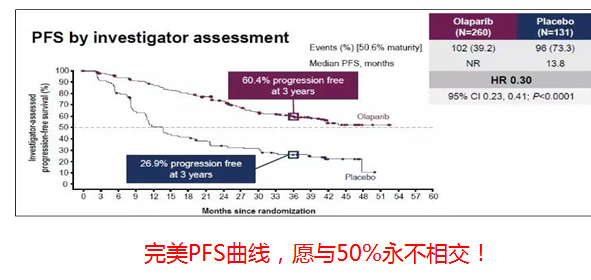
SOLO1结果显示
PFS:中位随访41个月,奥拉帕利组mPFS未达到,仍有半数患者未进展(安慰剂组mPFS13.8个月,疾病进展或死亡风险降低70%)。3年无进展或死亡的患者比例为60.4%,对照组为26.9%。
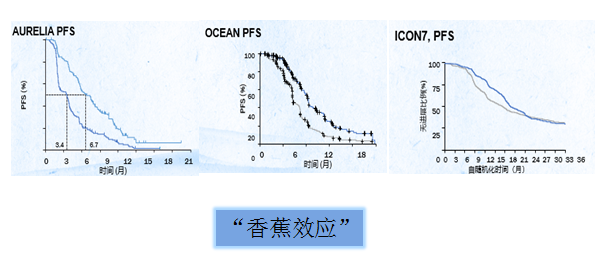
PARP抑制剂——铂敏感复发性卵巢癌维持治疗的推荐选择
奥拉帕利等3种PARP抑制剂获NCCN卵巢癌指南推荐,用于铂敏感复发性卵巢癌维持治疗。

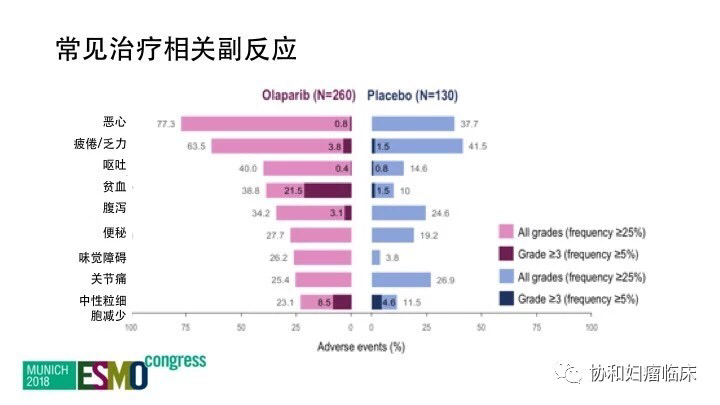
Olaparib常见化疗副反应
奥拉帕利组最常见不良反应是胃肠道反应,疲劳和贫血。
PARPi维持治疗
“三阶梯”:手术,化疗,维持治疗。
疗效:一线维持,对于BRCAm新诊断晚期卵巢癌,显著延长PFS达近3年,为治疗卵巢癌带来无限可能。
安全性:停药和减量患者少,易于管理;不良反应多为轻中度,长期治疗安全性及耐受性良好。
病例特点
47岁发病,无家族史,BRCA1m。
双卵巢高级别浆液性癌IV期。
满意减瘤“R0”。
规范化疗,获得CR。
一线化疗达CR后PARPi维持治疗。
停化疗8个月无复发。
维持治疗期间不良反应轻微可耐受。
一次用药错误引起血小板短暂下降,很快恢复。
总结
规范治疗(正规满意减瘤手术+一线化疗)是卵巢癌患者长期生存的基础。
化疗期间注意细节管理,根据患者骨髓副反应及时调整化疗用量、更改化疗方案以增加患者化疗耐受性非常重要。
化疗后可选择适宜药物维持治疗。奥拉帕利副反应轻微,对于携带BRCA突变的卵巢癌新诊断患者,一线化疗后可考虑尽早使用奥拉帕利维持治疗。
查看更多