查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





一般资料:患者中年男性,52岁,于2020年11月25日就诊。
主诉:右上腹疼痛20余天。
既往史、个人史及家族史:无特殊。
肿瘤标记物:AFP 216ng/ml↑。
HBV-DNA:阴性。
PET-CT(2020年11月19日):肝S6段肿块及结节,糖代谢增高,考虑恶性肿瘤,原发性肝癌并肝内转移可能性大。
腹部增强CT(2020年11月26日):1.肝S6段占位,结合AFP考虑原发性肝癌并肝内、肝门区淋巴结转移,建议活检。肝包膜少量包裹性积液。肝S6见低密度肿块影,范围约64mm×52mm×46mm,肝门区巨大淋巴结(75mm×71mm×44mm);右侧输尿管结石并右肾积液(考虑非肿瘤压迫所致);如图1所示。
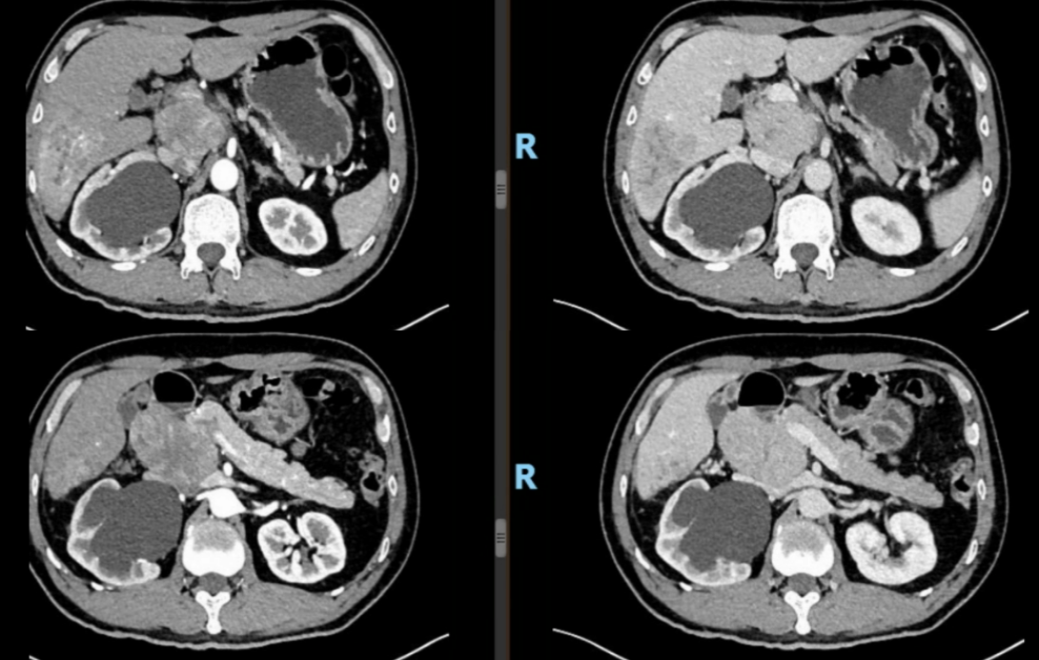
图1:治疗基线腹部增强CT
治疗前DSA造影:如图2所示。
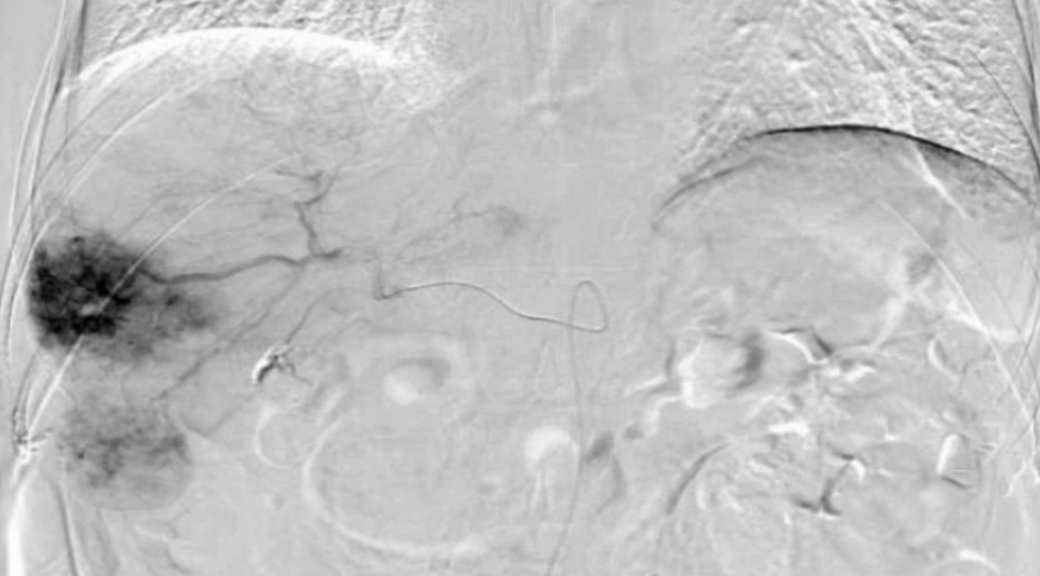
图2:治疗前DSA造影
临床诊断:1.肝细胞癌(BCLC C期),肝功能Child-Pugh A级;2.肝内、肝门区淋巴结转移
治疗方案:患者肝细胞癌伴肝内、肝门区淋巴结转移。与患者充分沟通病情,经患者充分知情同意并签署知情同意书后,先后于2020年11月30日、12月23日及2021年1月20日行免疫+靶向+HAIC(mFOLFOX)治疗,免疫治疗药物选用替雷利珠单抗。
实验室评价:AFP逐渐降至正常(从216ng/ml降至3.09ng/ml)。
影像学评价及疗效评价:3周期后腹部增强CT复查见肿块明显缩小,如图3所示,疗效评价为部分缓解(PR)。
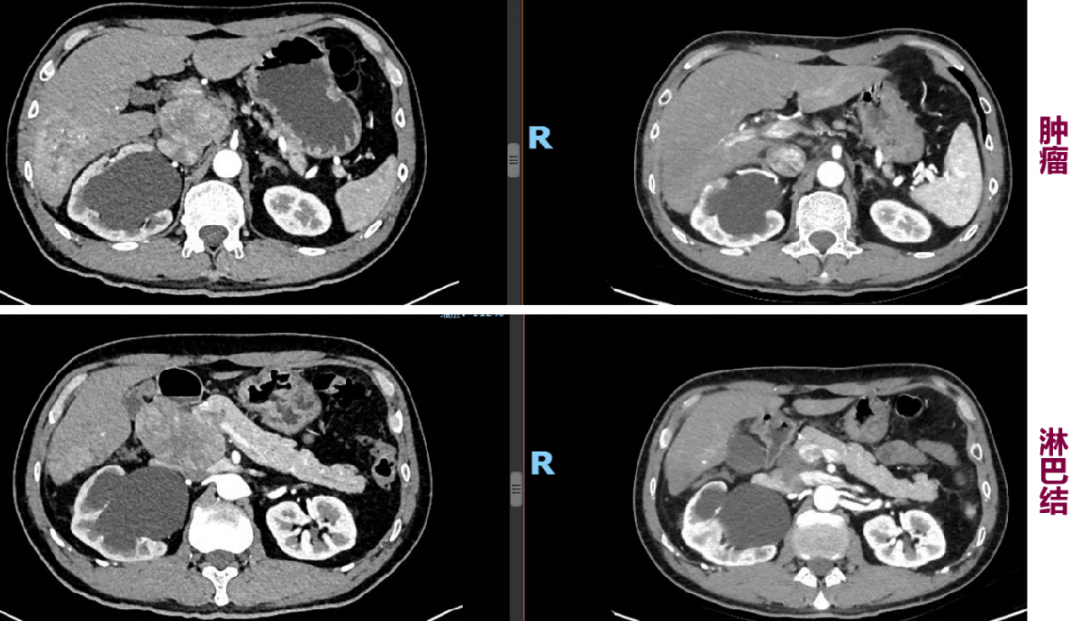
图3:左右分别为治疗前后腹部增强CT
治疗方案:患者于2021年3月8日行手术治疗(腹腔镜肝S6段切除+胆囊切除+胰后淋巴结切除)。
术后病理:1、肝肿物,见广泛纤维化及多灶坏死伴组织细胞增生,周围肝组织内大量淋巴细胞浸润,未见癌组织残留,符合肝恶性肿瘤治疗后改变;2、“门静脉旁”淋巴结见纤维化及坏死伴组织细胞增生,未见转移癌组织;3、慢性胆囊炎,未见癌。如图4所示。
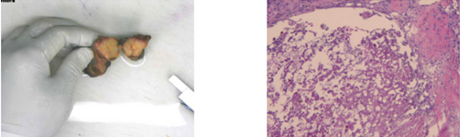
图4:术后病理
疗效评价:术后病理学提示pCR。
治疗方案:术后于2021年3月14日继续给予替雷利珠单抗维持治疗。
复查与随访:患者先后于2021年4月16日及2021年8月6日复查腹部CT,见肝右叶肝癌及胆囊切除术后改变,未见肿瘤复发征象,末次复查时腹部CT如图5所示。

图5:末次复查腹部CT
本例患者因“右上腹疼痛20余天”就诊,既往体健,无特殊疾病及家族史。根据患者病史及相关影像学检查,诊断为肝细胞癌,并存在肝内、肝门区淋巴结转移。患者BCLC分期为C期,无法行手术治疗。结合患者意愿后,临床治疗采取了转化治疗方案,希望可以使患者得到降期并进一步手术切除病灶。
经患者充分知情同意并签署知情同意书后,予以免疫+靶向+HAIC治疗3周期后,AFP明显下降至正常,腹部增强CT和DSA造影也显示肝内肿块明显缩小,疗效评估为PR。遂进一步行手术切除治疗,术后病理提示为pCR。术后继续给予患者替雷利珠单抗治疗,定期复查,未见肿瘤复发征象,截至发稿,患者仍在持续获益,且治疗期间未发现明显不良反应。
肝癌外科治疗是肝癌患者获得根治和长期生存的最重要途径,但由于我国很多肝癌患者就诊时已为中晚期,难以获得手术根治治疗。通过肝癌降期转化治疗,使不能手术但具有潜在手术性的患者经多种治疗手段,控制肿瘤进展甚至降低临床分期、改善肝功能,从而可行手术,有助于进一步提高疗效,改善患者预后。肝癌降期转化治疗也因此成为当前肝癌临床研究的热点之一,局部与系统治疗的科学排兵布阵显示了较好的持续缩瘤效果,为根治手术创造了更多机会。近年来,系统治疗领域,免疫治疗的成功突破为肝癌患者带来了新的治疗希望,也为肝癌降期转化治疗增添了一抹亮色。
综合本例患者的整体情况,在规范化、精准化治疗的基础上,予本例患者制定了免疫+靶向+HAIC的联合治疗方案,在3周期的综合治疗后,患者病灶迅速、持续缩小,AFP等肿瘤标志物降至正常,最终成功实施根治性切除术,再次以临床真实疗效成功证实了这一联合方案在肝癌转化降期治疗策略中的有效性。
本例患者应用的替雷利珠单抗是百济神州自主研发的PD-1抑制剂,其经结构优化,带来了抗肿瘤疗效及作用持续时间的升级。替雷利珠单抗单药治疗中国不可手术的晚期肝细胞癌患者的客观缓解率(ORR)达17%,疾病控制率(DCR)为56%;替雷利珠单抗单药二线及以上治疗不可切除肝细胞癌的全球、多中心、Ⅱ期临床研究(RATIONALE 208研究)结果显示,替雷利珠单抗单药二线及后线治疗不可切除肝细胞癌仍显示了良好疗效和安全性,二线中位总生存(mOS)达13.8个月,近80%客观缓解患者持续缓解时间超过一年(一年DoR率79.2%);部分患者实现深度缓解,单药治疗后有3例患者达到完全缓解(CR),疗效比肩国际同类药物既往数据,表明替雷利珠单抗单药治疗或可为患者带来更多生存获益。安全性方面,≥3级治疗相关不良事件(TRAE)发生率仅为14.5%,处于同类药物较低区间。基于RATIONALE 208研究数据,国家药品监督管理局(NMPA)于6月22日正式批准替雷利珠单抗用于至少经过一种全身治疗的肝细胞癌的治疗,未来有望为更多的患者带来治疗生机与希望。现阶段,替雷利珠单抗在肝癌领域的多项临床研究仍在积极探索,期待相关数据早日公布,为临床用药提供更多指导。

中国医学论坛报编辑|金金 整理
查看更多