查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:复旦大学附属华山医院感染科 胡越凯 李新宇 王超 陈明泉
病史简介
主诉
患者男性,28岁,江苏如东人,海员。因“皮疹、咳嗽2个月,发热1月余”入院。
现病史
2017年10月23日
患者在航行中出现全身皮肤红斑(图1),不伴有瘙痒,涂曲安奈德软膏后皮疹逐渐消退。
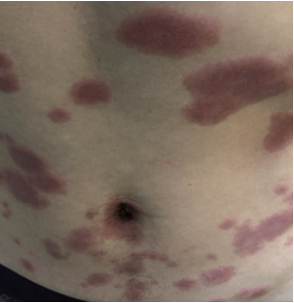 ▲图1 10月23日的皮疹
▲图1 10月23日的皮疹
11月4日
患者再次出现皮疹,自服扑尔敏,皮疹减轻,此时开始出现阵发性咳嗽,不剧烈,咳少量白痰。
11月中旬
患者出现发热,体温39℃左右,无寒战,咳嗽较前加重,但无胸闷、憋气。
11月24日
查血常规:白细胞(WBC)18.6×109/L,中性粒细胞百分比(N%)为78.9%,嗜酸性粒细胞百分比为5.6%,血红蛋白(Hb)112 g/L,血小板(PLT)404×109/L,考虑“荨麻疹”,予抗过敏药物、头孢类药物口服,全身皮疹基本消退,有色素沉着。但患者咳嗽依旧,同时出现乏力、盗汗,夜间为著。
11月30日
行胸部CT(图2)示,两肺粟粒状结节影,右肺下叶实变,右肺门、纵隔、右侧颈部根部锁骨上、右侧膈肌脚旁淋巴结肿大,右侧胸腔积液。查血常规示WBC 26.4×109/L,N%为91.1%,淋巴细胞百分比(L%)为3.5%,Hb 111 g/L,PLT 325×109/L,血沉(ESR)82 mm/h,结核抗体阳性,肿瘤、类风湿、抗核抗体阴性。B超示,肝、胆、胰、脾、双肾未见异常,双侧胸腔积液(右侧狭长),心包未见积液,双侧锁骨上多发淋巴结肿大(右侧为著)。
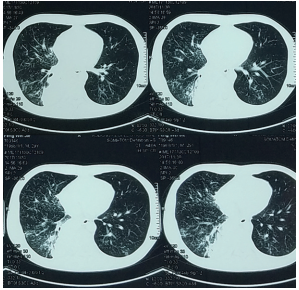 ▲图2 2017年11月30日胸部CT
▲图2 2017年11月30日胸部CT
12月1日-12月8日
抗感染治疗:莫西沙星(12月1日至3日,12月5日至8日),美罗培南(12月3日至8日)。
12月5日
(1,3)-β-D葡聚糖检测(G试验)551.8 pg/ml,半乳糖甘露醇聚糖抗原检测(GM试验)、抗可溶性核抗原(ENA)抗体、抗中性粒细胞胞浆抗体(ANCA)阴性,ESR 105 mm/h,血结核感染T细胞斑点试验(T-SPOT.TB)阳性(A孔6,B孔6)。
12月8日
右侧颈部淋巴结活检示肉芽肿性炎伴坏死,予复方磺胺甲恶唑(SMZco)并加用伏立康唑抗真菌治疗。支气管镜肺泡灌洗液未找到抗酸杆菌,灌洗液细菌培养、真菌培养均阴性,GM试验阴性,灌洗液结核分枝杆菌RNA阴性。
12月12日
复查胸部CT(图3):右肺下叶感染性病变,双肺弥漫性病变考虑结核,右侧胸腔积液伴右肺下叶膨胀不全,纵隔内多发肿大淋巴结,心包少量积液。
其间家属曾自带切片至上海某医院,专家病理会诊高度怀疑寄生虫感染(12月27日回报寄生虫抗体检测阴性)。
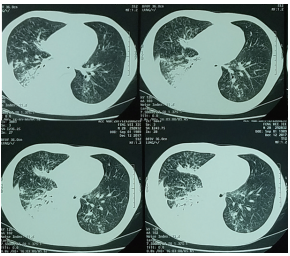 ▲图3 2017年12月12日胸部CT
▲图3 2017年12月12日胸部CT
12月14日
患者转入结核科行诊断性抗结核治疗,停用伏立康唑,予异烟肼、利福平、乙胺丁醇、吡嗪酰胺(HREZ)抗结核治疗。
12月18日
复查血WBC 21.6×109/L,加用哌拉西林他唑巴坦加强抗感染治疗,患者体温未见好转。
12月22日
转入上海某医院继续予抗结核治疗,并查血常规示WBC 16.78×109/L,N% 73.8%,ESR 68 mm/h,结核抗体阴性,痰未见真菌孢子及菌丝,G试验53.4 pg/ml,血培养正常。
12月26日
行胸水穿刺,并放置引流管。胸水生化:氯102.9 mmol/L,葡萄糖5.88 mmol/L,总蛋白40 g/L。胸水病理报告:未见恶性细胞。血结核杆菌T细胞免疫反应阴性,结核杆菌γ干扰素释放试验(T-N)0,淋巴细胞培养+干扰素(基础水平N)0.08,淋巴细胞培养+干扰素(刺激水平T)0.0790,混合淋巴细胞培养+干扰素(阳性水平M)>10,结核分枝杆菌阳性对照反应(M-N)>10,结核涂片阴性。
12月28日
再行胸部CT检查(图4)示,右肺下叶实变不张,双肺弥漫性结节,伴双侧颈部及纵膈肺门淋巴结多发增大融合,上腔静脉局部狭窄,考虑恶性可能,右侧胸腔积液、邻肺受压。患者体温仍在38℃-39℃波动,为求进一步诊治来我院住院治疗。
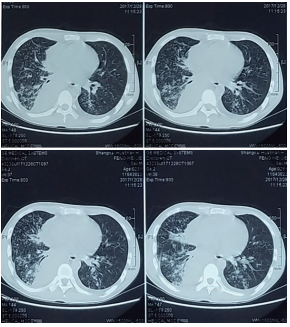 ▲图4 2017年12月28日胸部CT
▲图4 2017年12月28日胸部CT
患病以来,患者精神萎靡,胃纳差,睡眠尚可,大小便正常,体重明显下降约5 kg。
入院查体
体温37.6℃,脉搏100次/分,呼吸20次/分,血压107/73 mmHg,身高170 cm,体重50 kg;左侧锁骨上、右侧颈部多个淋巴结融合成团,质硬、活动度差、与周围有粘连。右下肺呼吸音偏低,未闻及干、湿性啰音。外院留置右胸引流管一根。
辅助检查
血WBC 20.52×109/L,N% 84.4%,L% 8.7%,嗜酸性粒细胞1.7%。
降钙素原(PCT)0.1 ng/ml↑,C反应蛋白(CRP)127 mg/L↑,铁蛋白887.2 ng/ml↑,ESR 62 mm/h↑。
T-SPOT.TB:阴性,阴性对照孔:0,抗原A(ESAT-6)孔:0,抗原B(CFP-10)孔:0,阳性对照孔:正常。G试验:166.8 pg/ml↑。
EB病毒(EBV)衣壳抗体IgM:阴性,EBV DNA定量检测:低于检测下限。
肿瘤、类风湿、抗核抗体阴性。
淋巴细胞亚群:5.51%↓,CD3+ 72%,CD4+ 26.33%↓,CD8+ 36.33%,NK+ 20.44%,CD19+ 5.89%↓,CD4/CD8:0.72↓。
B超示双侧颈部至锁骨上可见多枚异常肿大淋巴结,以锁骨上明显,部分融合成团,右侧最大32 mm×20 mm、左侧最大18 mm×25 mm,内未见明显髓质回声,内见少量血流信号。双侧腋下、双侧腹股沟未见明显异常肿大淋巴结。肝脏、胆囊、胆总管、胰腺、脾脏、双肾未见异常。后腹膜大血管周围未见明显异常回声,未见明显肿大淋巴结。
12月29日胸水:淡黄色,浑浊,红细胞610×106/L,有核细胞1600×106/L,N% 25%,L% 70%,间皮细胞5%,蛋白34 g/L。
胸水各种涂片培养2次均阴性。结核分枝杆菌检测(Xpert MTB)2次均为“trace”。
2018年1月3日拟行支气管镜检查。因患者咳嗽剧烈,未能进行。
入院后诊疗结果
因患者外院T-SPOT.TB阳性,肺内粟粒性改变伴淋巴结肿大,且我院Xpert MTB检测2次均为“trace”,故患者入院后(2017年12月30日-2018年1月2日)仍予抗结核治疗,并避免了利福平药物热可能(异烟肼0.3 g qd+吡嗪酰胺0.5 g tid+乙胺丁醇0.75 g qd+莫西沙星0.4 g qd+利奈唑胺针600 mg q12h),但体温和咳嗽无好转。
临床关键问题及处理
关键问题1——何为Xpert MTB?其检测结果有何意义?
结核分枝杆菌/利福平耐药(Xpert MTB/RIF)检测试剂盒是近年来结核病分子诊断技术的代表。该方法使用半巢式实时定量PCR技术,2小时报告结果。因为针对MTB复合群rpoB基因,可同时检测MTB及利福平耐药情况。2010年,世界卫生组织(WHO)推荐其用于成人、儿童疑似耐药结核,人类免疫缺陷病毒(HIV)感染与MTB双重感染患者的初始检测;并推荐用于疑似肺外结核患者的肺外标本检测。因其特异度≥95%,可作为结核病确诊试验。
2017年研发出的Xpert MTB/RIF Ultra是新一代试剂盒,也被WHO推荐用于活动性肺结核的快速诊断。相较旧版,Ultra增加了对IS1081和IS6110两个短重复序列的检测,提高了低菌量标本的检测灵敏度。
但与其他检测手段相同,敏感度的提高在一定程度上使特异度降低。当仅检测到IS1081和IS6110而未检测到rpoB基因片段时,其结果报告为“trace”。研究表明,“trace”存在一定假阳性可能,特别是既往有结核病史患者,因为即使结核治愈,仍有死菌存在可能。
因此,对于“trace”结果的解读,WHO建议,对于HIV患者、儿童及肺外结核标本,“trace”应作为阳性结果;对于无HIV病史的成年患者标本且首次报告“trace”结果时,应采用新标本重复实验,如第2次仍为”trace”则可诊断。须指出的是,目前Ultra相关临床研究主要来自肺结核与合并HIV的结核性脑膜炎患者,而结核性胸膜炎、结核性腹膜炎、脊柱结核等其他肺外结核,特别是非HIV感染患者活动性结核的诊断仍缺乏临床应用实例,诊断价值尚不明确。
在如此强有力抗结核治疗效果不佳的情况下,我们在2018年1月6日为患者做了正电子发射计算机断层显像(PET)-CT(图5)。结果显示,患者右下肺实变,两肺弥漫斑片结节,颌下、双侧颈部、双侧锁骨区、双侧腋窝、纵隔、双肺门、右侧肋隔角、右侧腹股沟多发淋巴结,氟代脱氧葡萄糖(FDG)代谢异常增高,结合病史考虑恶性病变可能大(淋巴瘤?),建议病理学检查。左侧鼻咽部局灶FDG代谢轻度增高,考虑炎性,必要时鼻咽镜随访。
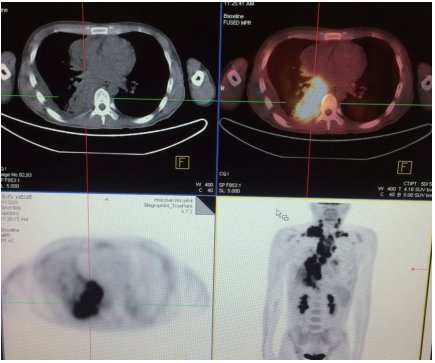 ▲图5 PET-CT,右下肺实变及全身淋巴结异常显像
▲图5 PET-CT,右下肺实变及全身淋巴结异常显像
从临床角度看,患者有如此广泛淋巴结累及和肿大,部分淋巴结有明显融合,肺内多发结节,淋巴瘤是一个可以理解的结果。
此时,患者将其所在货船的具体航行航线告知我们。9月30日洛杉矶抛锚,10月6日靠港洛杉矶卸货,10月13日离港,10月15日直靠斯托克顿,10月20日离港去温哥华,10月24日温哥华抛锚,10月26日靠港,10月29离开温哥华,11月16日到日本,11月19日到东京湾。
我们惊喜地发现,他的皮疹发病前1-2周左右的航线在一个很值得深思的区域——美国西海岸加利福尼亚州。
结合患者的航行线路及病史、胸部CT特点,考虑粗球孢子菌感染可能,2018年1月2日至1月10日使用伊曲康唑针剂治疗后体温峰值开始逐渐下降,咳嗽缓解。
1月9日,患者自外院拿回淋巴结活检涂片,送真菌室再次读片见厚壁孢子囊(图5a-b),符合粗球孢子菌形态。但在涂片上与粗球孢子菌孢子囊样形态类似的有多种真菌,须注意鉴别。
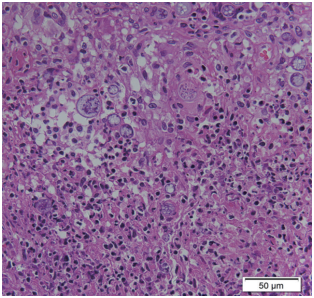 ▲图5a 低倍镜下所见
▲图5a 低倍镜下所见
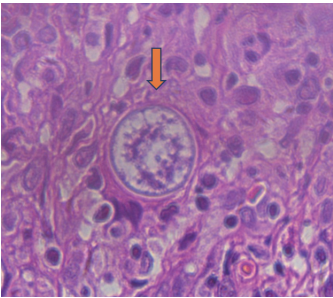
▲图5b 高倍镜下所见孢子囊
虽然患者大体诊断明确且治疗效果尚佳,但需要更准确的病原学结果。既然考虑到很有可能是粗球孢子菌,或再次活检,或再次支气管镜灌洗行病原体培养。然而,正因如此,我们反而面临且绕不开一个关键问题——微生物暴露安全性。
关键问题2——如何应对粗球孢子菌的职业暴露和预防?
与其他病原性真菌相比,球孢子菌的传播性和致病性较强,在美国政府制定的潜在危险生物武器病原体列表中是唯一在列的真菌。球孢子菌培养物的意外暴露是引起感染的重要方式,即使是非疫区的实验室也可能从输入性病例标本中培养到球孢子菌,微生物实验室须对此提高警惕[危险等级2,生物安全3级实验室(BSL-3,P3)]。
重要的预防措施包括:所有丝状真菌培养物必须在生物安全柜内打开,当临床医师疑诊球孢子菌病时,应及时告知微生物实验室人员。一旦发生实验室暴露,应迅速撤离人员。对可能污染的空间,须先行封锁,再进行消毒灭菌处理。对所有可能暴露人员进行登记,留取基线血样检测抗体,并行球孢子菌素皮试。对发生暴露的非孕期人员,给予氟康唑400 mg qd口服,预防性治疗6周,并观察随访至少6周。
正因我们已临床判断为粗球孢子菌,而它的培养和处理需要在P3实验室中进行,我们缺少P3实验室,也就缺乏病原微生物培养鉴定及药敏的诊断途径。
而在诊断基本清晰、治疗有效情况下,为了进一步确诊再次挖取淋巴结做测序,对患者又过于严苛,因此,我们在多个便于获得的体液(血、胸水、淋巴结附近体液、新发水疱样皮疹内液体)做了测序,结果只在胸口皮肤新发的水疱样皮疹内液体中测得了粗球孢子菌的序列,而在血液、胸水、淋巴结附近体液均未测得,这也符合文献关于胸水培养物诊断率较低的描述。
至此,患者粗球孢子菌病诊断确立,且患者存在皮肤、淋巴结和肺部多系统多部位累及,故考虑其为播散性粗球孢子菌病。考虑到关于热病的推荐意见以及患者的经济条件,我们于1月10日将抗真菌方案调整为氟康唑400 mg q12h静脉滴注。治疗后第2天,患者体温再次上升、咳嗽加剧,遂从1月15日起将治疗方案调整为伊曲康唑针剂治疗,患者体温再度降至正常,咳嗽明显缓解。之后患者伊曲康唑口服液和针剂交替使用。患者体温变化如图6。从ESR和CRP也可看到患者的炎症指标呈现逐渐下降至正常(表)。
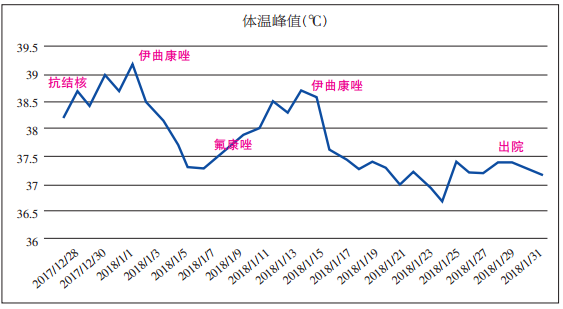 ▲图6 治疗期间体温变化情况
▲图6 治疗期间体温变化情况
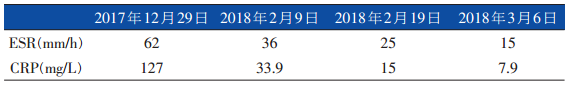 ▲表 患者治疗后血沉和CRP变化
▲表 患者治疗后血沉和CRP变化
有趣的是,我们在1月30日对患者再次复查了T细胞亚群和免疫球蛋白的检测:CD3+ 86%,CD4+ 41%,CD8+ 39%,CD19+ 5%,自然杀伤细胞(NK)9%,IgG 20.7 g/L,IgA 2.5 g/L,IgM 0.49 g/L。可以看出,治疗后患者的CD4+细胞计数恢复正常,故患者入院时的CD4+细胞计数低下与粗球孢子菌病相关,而非患者本身的细胞免疫低下所致。
背景知识介绍
球孢子菌概述
1892年,阿根廷人波萨达斯(Posadas)报告首例球孢子菌感染病例,并将其误认为是一种原虫感染(恰恰与本例患者病理在外院读片类似)。1900年,奥夫勒斯(Ophuls)和莫菲特(Moffitt)发现这是有两种形态的真菌。
球孢子菌属包括粗球孢子菌(C.immitis)和波萨达斯球孢子菌(C.posadasii),两者在基因组和转录组水平上有差异,但菌种形态学、表型特点和致病性十分相似,临床上一般不加以细分。前者在美国境内的分布局限于加利福尼亚州;后者则主要分布于美国亚利桑那州南部和西部,流行区向东延伸至德克萨斯州,北至犹他州,南至墨西哥。1998-2011年全美上报的117717例球孢子菌病患者中97%来自亚利桑那州和加利福尼亚州。美国疾病预防控制中心(CDC)数据显示,1988年,球孢子菌病的发病率为5.3/10万,随后逐年上升,至2011年已达42.6/10万,升高近10倍。此外,南美洲一些国家,例如委内瑞拉、阿根廷、巴拉圭、哥伦比亚、玻利维亚等,也有病例报告。球孢子菌病流行区多为半干旱气候,冬季温和,利于真菌繁殖;夏季炎热,有助于关节孢子的传播。这些地区的土壤具有碱性、高盐、富含有机物等特点,不利于其他微生物存活,却有利于球孢子菌的生长。
中国学者总结1958-2017年中国地区球孢子菌病例报告,纳入的38例球孢子菌病例中,16例(42.1%)无明确疫区接触史。这一现象对我国不是球孢子菌病疫区的传统流行病学观念提出了质疑。但若考虑到国内同样存在利于球孢子菌生长的环境,这一现象也能得到解释,希望当地流行病学家进行环境取样加以证实。
由于其在肺部的表现类似粟粒性肺结核的影像学改变,并常伴有淋巴结肿大,常会被初诊为肺结核。在此,我们根据塞西莉亚(Cecilia M)等在2014年针对粗球孢子菌病肺部影像学表现的综述进行介绍。
肺球孢子菌病影像学表现
根据宿主的免疫状态、共存疾病和感染程度不同,临床表现也不同。在临床和影像学检查的基础上,肺球孢子菌病被分为急性、播散性和慢性。
1. 急性肺孢子菌病的胸部影像学
急性球孢子菌病的胸部表现包括肺实质异常、胸部淋巴结病变和胸腔积液。肺实质异常包括实变、结节、空洞和支气管壁增厚。
最常见的肺实质异常是实变,发生在75%的病例中,表现为孤立或多个区域的肺段或肺叶阴影。实变可以发生在肺的任何区域,但主要是单侧、周围和基底部。实质阴影的密度可从磨玻璃到致密的均匀实变,很像细菌性肺炎。有时,肺实变区域可表现为薄壁或厚壁的空洞,还可以看到多灶性实变或弥漫性肺部阴影。
另一种常见的实质异常表现是肺部结节状阴影,在多达20%的病例中可见。结节的大小可以相似,或者在0.5-2.5 cm之间变化。它们通常是多个且局限的,并且主要见于肺门和下肺区,很像转移性疾病。在CT上观察到的大多数结节表现多样且呈双侧,具有不明确的边界,且直径在0.5 cm-3 cm之间。
40%患者CT上可以看到肺门或者纵膈淋巴结肿大。约15%-20%的急性球孢子菌病患者可出现胸腔积液。胸腔积液可以是漏出性的或渗出性的,通常由邻近实质的持续感染传播引起。胸膜下肉芽肿的破裂、免疫复合性胸膜炎和血行播散是胸腔积液的其他原因。胸腔积液可以独立发生或与实质性疾病有关。单侧、少量的胸腔积液可在1~8周内吸收。中度或大量胸腔积液可在数周内清除,或可持续1年以上。多达45%的球孢子菌病患者在CT检查中可以看到大量胸腔积液。在多达22%的住院患者中胸腔积液可发展为脓胸,需要开胸手术。
2. 播散性肺孢子菌病的胸部影像学
播散性疾病是球孢子菌病最严重的表现,发生在不到1%的病例中(在住院患者中可达11%),其经典肺部表现是血行播散引起的粟粒状结节,肺实变的原发灶偶尔会出现,且通常存在肺门和纵隔的淋巴结肿大。
急性呼吸窘迫综合征(ARDS)是一种罕见的并发症,通常发生在免疫功能低下的宿主中。艾滋病患者真菌病和ARDS风险增加。即使使用抗真菌和支持性治疗,这些患者仍具有很高的病死率,接近100%。ARDS还可以发生在具有免疫力的患者或具有其他共存疾病,例如糖尿病或肾衰竭的个体中,病死率为40%-60%。
肺外传播频繁发生,最常见的是皮肤、淋巴结、骨骼和关节,以及中枢神经系统。椎体疾病可以发展到软组织中,形成椎旁蜂窝织炎或腰大肌脓肿。即使有正确的诊断和抗真菌治疗,血行播散的病死率仍达到28%-56%。
3. 慢性肺孢子菌病的肺CT表现
慢性肺孢子菌病的影像学表现包括残留结节、慢性空洞、伴或不伴淋巴结病变的持续性肺炎、胸腔积液和转归。空洞可以在先前实变的区域中形成,导致薄壁“葡萄皮”空洞,或者可以在结节中形成厚壁空洞。90%的空洞是孤立的。空洞通常是局限的圆形,直径为2-4 cm。大多数空洞可自发消失,50%的病例空洞可在2年内消失。即使空洞仍然存在,胸外的播散感染却罕见。有时,空洞细菌双重感染可导致化脓性肺脓肿,伴有气液平。扩大的外周空洞可能破裂到胸膜腔,导致气胸、脓气胸或支气管胸膜瘘,比较少见。
治疗
2005年,美国感染病学会(IDSA)发表了球孢子菌病治疗指南,又于2016年进行了更新。
根据该指南的推荐意见,对于免疫正常宿主急性肺部感染,由于一般为自限性病程,无需抗真菌治疗,只需定期随访;对于慢性肺部感染、播散性感染或免疫低下患者的感染,则首选唑类药物(氟康唑、伊曲康唑)治疗。
两性霉素B治疗球孢子菌感染疗效确切,但不良反应较大,一般不作为首选抗真菌药物,仅用于以下情况:唑类药物无法耐受或疗效不佳者、严重骨关节病变者、免疫低下且肺部病灶迅速进展或肺外播散者。
此外,因氟康唑有致畸风险,故孕早期患者推荐使用伊曲康唑或两性霉素B治疗。
脑膜炎患者推荐首选氟康唑或伊曲康唑治疗,次选其他唑类药物或鞘内注射两性霉素B。
■翁心华教授点评
虽然播散性粗球孢子菌病在肺部粟粒状改变的表现会使得临床医生先局限于结核的诊断,之后融合和显著肿大的淋巴结又引导至淋巴瘤的考量。然而,患者船员的身份和航行路线为疾病的诊断提供了完美的流行病学史,有经验的真菌学家对于病理的解读起到关键性的作用。由于病原学培养囿于实验室暴露风险而不能顺利开展,最后由分子诊断技术提供了强有力的证实,使得这一例播散性粗球孢子菌病患者能够得到确诊和良好的治疗。
这是我科第4例确诊的播散性粗球孢子菌病,或许预示,随着国内外交流的增多,以往认为这种在我国罕见的病例,会越来越值得感染科、呼吸科等各科医生提高认识。同时,由于有少数患者为非输入性病例,缺少典型流行病学史,希望临床医生在遇到这些影像学以肺部粟粒状改变为主要表现酷似结核,且接受抗结核治疗效果不佳或结核诊断依据不足的患者时,也能够考虑到这一疾病。
查看更多