查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过








患者2月余前无明显诱因出现发热,最高体温39.6℃,并发现右侧腹股沟、右膝部外侧无痛性皮下结节,表面皮肤完整无破溃,当地医院胸部CT示“双肺多发结节”,予亚胺培南静脉输液治疗后虽然体温降至正常,但复查胸部CT“双肺多发结节较前增大、并出现左肺渗出、实变影”。1月前患者出现咯血,18天前再次发热,分别予青霉素、左氧氟沙星、亚胺培南静脉输液,咯血无明显好转,皮下结节呈增大趋势,并出现疼痛。1天前因咯血加重收住院。辅助检查:2019年11月14日 血常规:白细胞 17.43×10^9/L ↑,红细胞 2.2×10^12/L ↓,血红蛋白 58.0 g/L ↓ ,血小板 125.0×10^9/L 。G试验、GM试验、T-SPOT和TB均阴性。血培养阴性。入院后行气管镜检查显示左肺上叶、下叶基底段黏膜水肿、增厚,管腔狭窄。黏膜病理:支气管黏膜急慢性炎,伴肉芽组织增生,特殊染色未见确切病原体。 特殊染色结果:PAS(-),PASM(NS),抗酸染色(-)。 分子病理结果:荧光PCR-TB(-)。分别行左肺病变及皮下结节穿刺活检:肺及小腿组织病变一致,均表现化脓性肉芽肿性炎,伴坏死,坏死物内见大量中性粒细胞,病变中血管壁见炎细胞浸润,以上病理改变可见于感染性疾病(如真菌,NTM)或肉芽肿性多血管炎。PAS(-),PASM(-),抗酸染色(-)。临床上考虑不除外真菌感染,予伏立康唑治疗,患者体温恢复正常,咯血缓解,皮下结节逐渐消失,复查胸部CT提示“双肺结节及左肺实变影较前明显缩小” 。出院后长期口服伏立康唑200 mg Bid治疗。
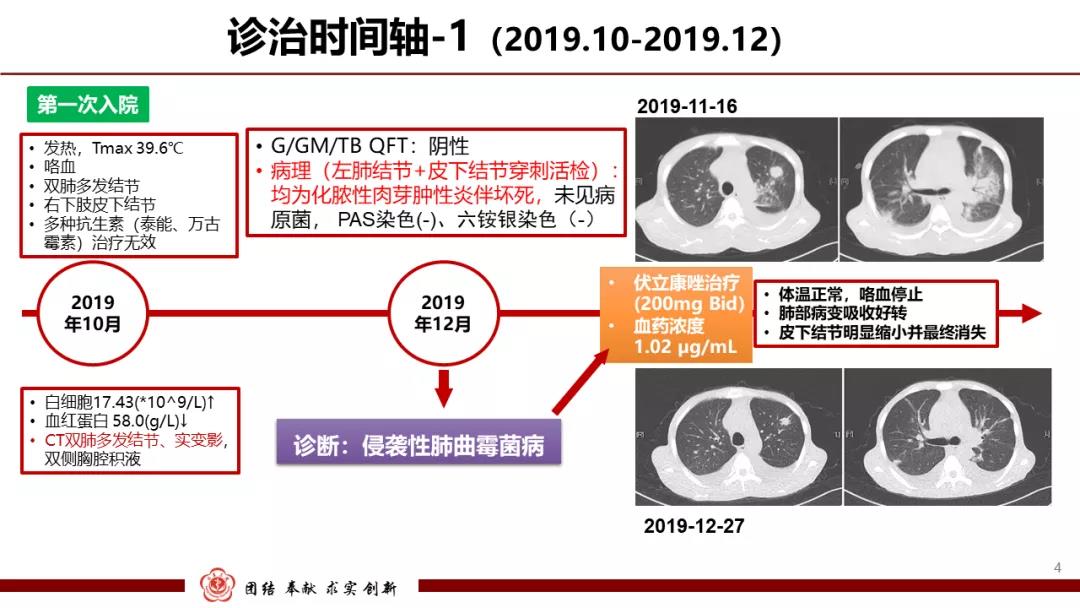
患者因“发热20余天”于2020-3-25第二次入院,此时伏立康唑治疗已接近4个月,且未停药。患者20余天前再次发热,体温最高39.5℃,伴寒战、憋气、干咳,复查胸部CT示“肺部感染部分较前吸收、部分较前进展,双侧胸腔积液”,无皮下结节。
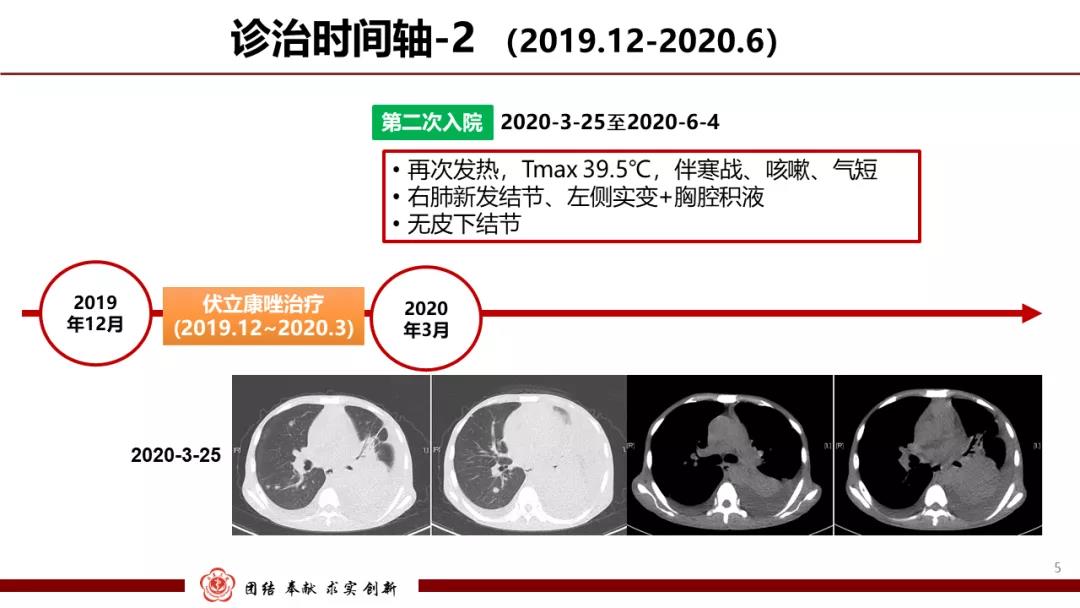
围绕着患者持续发热以及肺部新发结节的症状,对于第二次入院诊断考虑以下几点:
1.是否延续之前第一次入院的侵袭性真菌病的诊断,但是患者长期服用伏立康唑,是否发展为耐药?
2.由于患者存在发热,是否考虑血源播散性感染?但是患者多次血培养结果为阴性。
3.是否考虑肺结核?虽然患者TB QFT阴性,胸腔积液化验结果不支持,但是仍不能排除。
4.血液系统恶性肿瘤肺浸润?目前患者肿瘤标志物正常,胸腔积液未见肿瘤细胞,需要进一步排除。
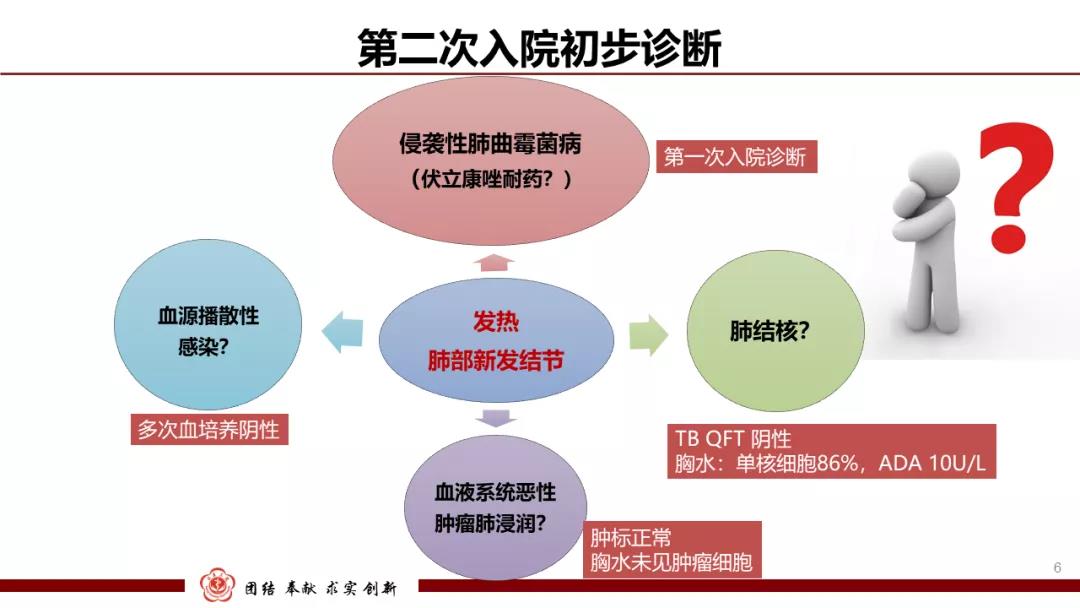
根据前面的推测诊断,该患者二次入院后予患者继续口服伏立康唑200 mg Bid治疗,并先后给予万古霉素、哌拉西林舒巴坦、替加环素、美罗培南、环丙沙星等多种抗生素治疗,但复查胸部CT见肺部病变仍在进展,临床诊疗陷入了困境。

针对患者诊断不明确,经验治疗效果不佳的问题,科室展开了激烈的讨论,下一步到底如何进行呢?是继续升级抗真菌治疗换成两性霉素B?经验性抗结核治疗?还是再次继续进行肺穿刺,明确病因?最后讨论的结果为:宁做创伤性诊断,不做毁灭性治疗,再次进行肺穿刺明确病因。

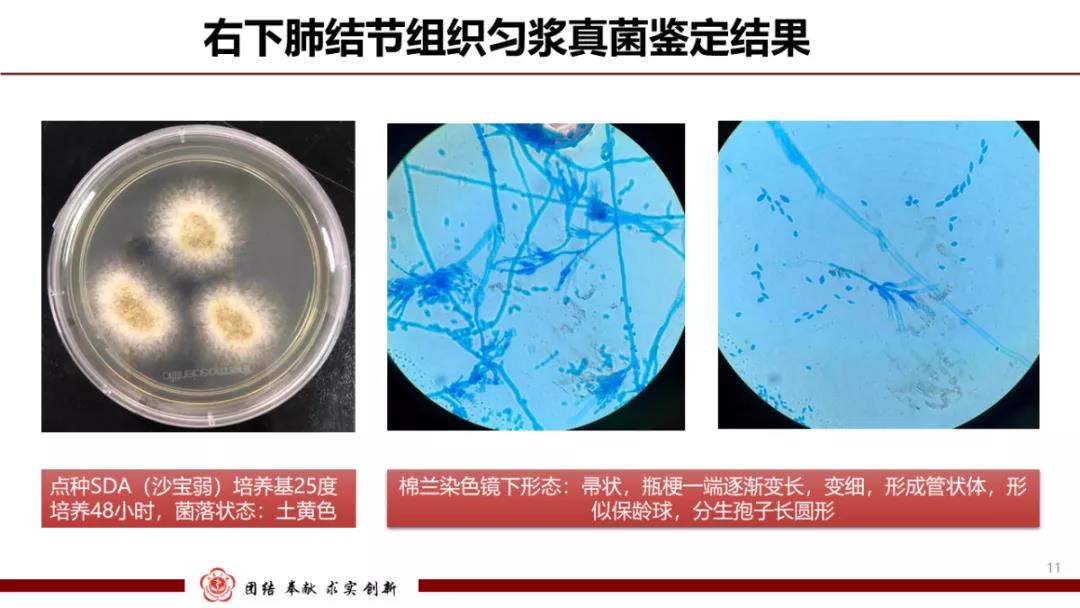
微生物实验室也回报了穿刺的右肺组织匀浆真菌结果,SDA培养基培养25℃,3天后,生长出大量的土黄色丝状真菌菌落。

进一步点种SDA培养基,该菌生长迅速,48小时可见菌落大量生长,仍然为土黄色。棉兰染色镜下形态:该菌分生孢子梗呈典型的帚状形态,梗基部膨大,逐渐变细成为一个相当细而长的颈部,形成管状体,形似保龄球,分生孢子长圆形,通过形态学鉴定基本锁定了该菌为拟青霉属。
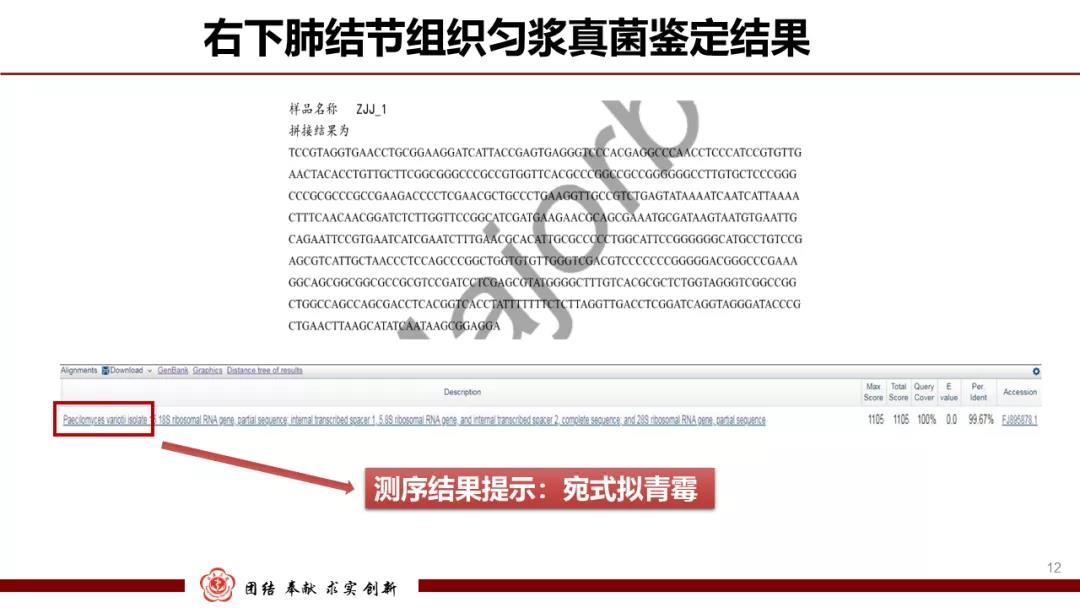
进一步对菌落进行基因测序,结果确定为宛氏拟青霉。
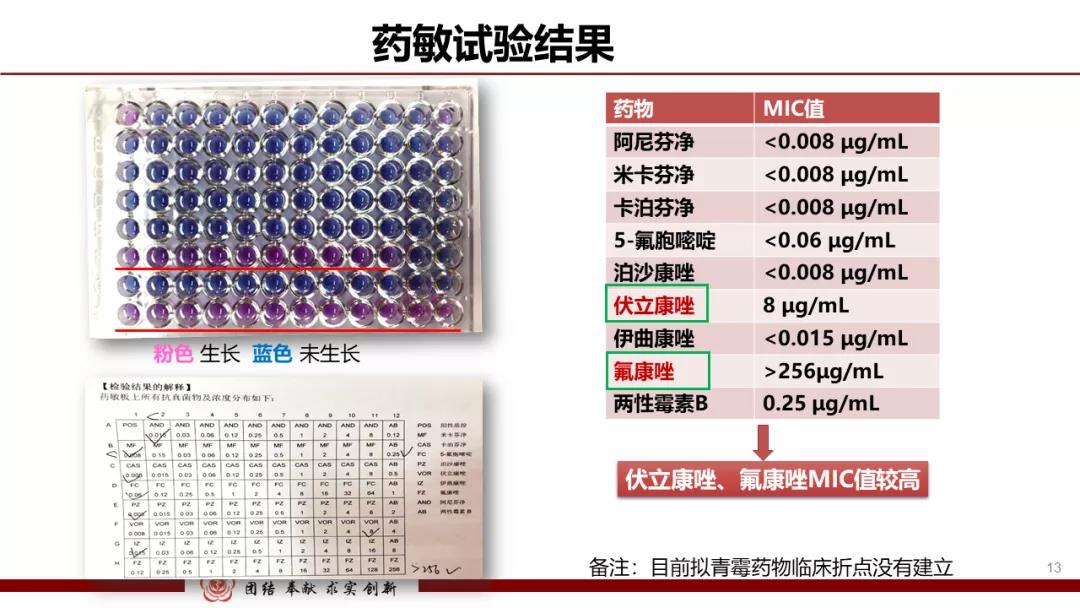
同时对该菌进行了药敏检测,药敏结果:
1.阿尼芬净 <0.008 µg/ml;
2.米卡芬净 <0.008 µg/ml;
3.卡泊芬净<0.008 µg/ml;
4.5-氟胞嘧啶<0.06 µg/ml;
5.泊沙康唑 <0.008 µg/ml;
6. 伏立康唑 8 µg/ml;
7. 伊曲康唑 <0.015µg/ml;
8. 氟康唑 >256 µg/ml ;
9. 两性霉素B 0.25 µg/ml 。
结果提示泊沙康唑、阿尼芬净、米卡芬净、伊曲康唑、卡泊芬净、5-氟胞嘧啶、两性霉素B的MIC值较低。氟康唑、伏立康唑的MIC值较高,而此患者恰巧前期一直在服用伏立康唑,根据药敏结果我们推荐临床调整抗真菌治疗方案。
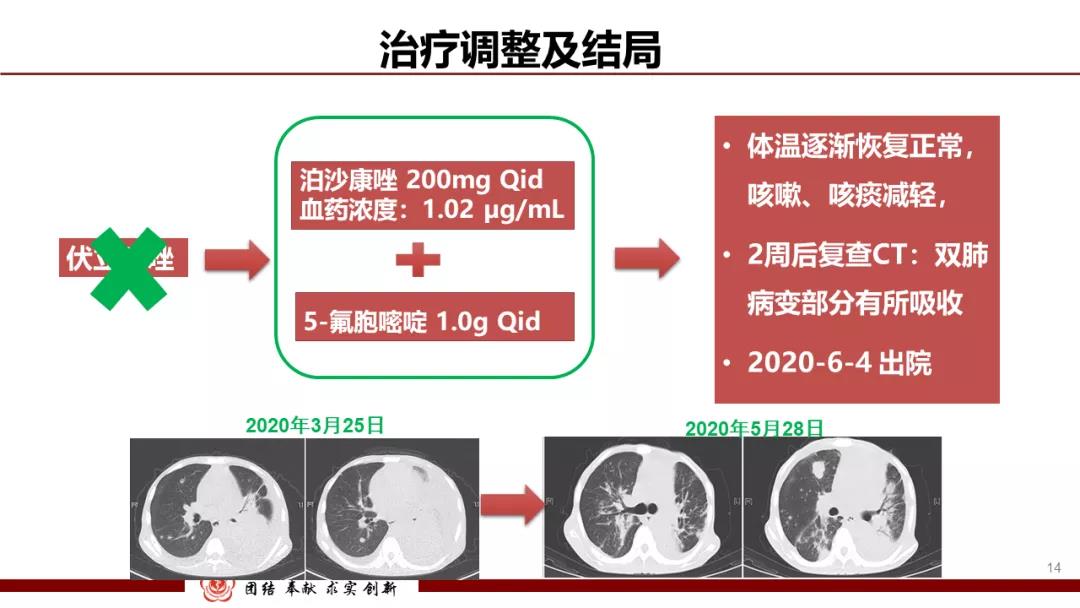
临床采纳了实验室建议,予患者停用伏立康唑,并给予泊沙康唑200 mg Qid联合氟胞嘧啶(1g Qid)口服治疗,患者体温逐渐恢复正常,咳嗽、咳痰减轻,复查胸部CT提示双肺病变部分有所吸收。患者于2020年6月4日出院。

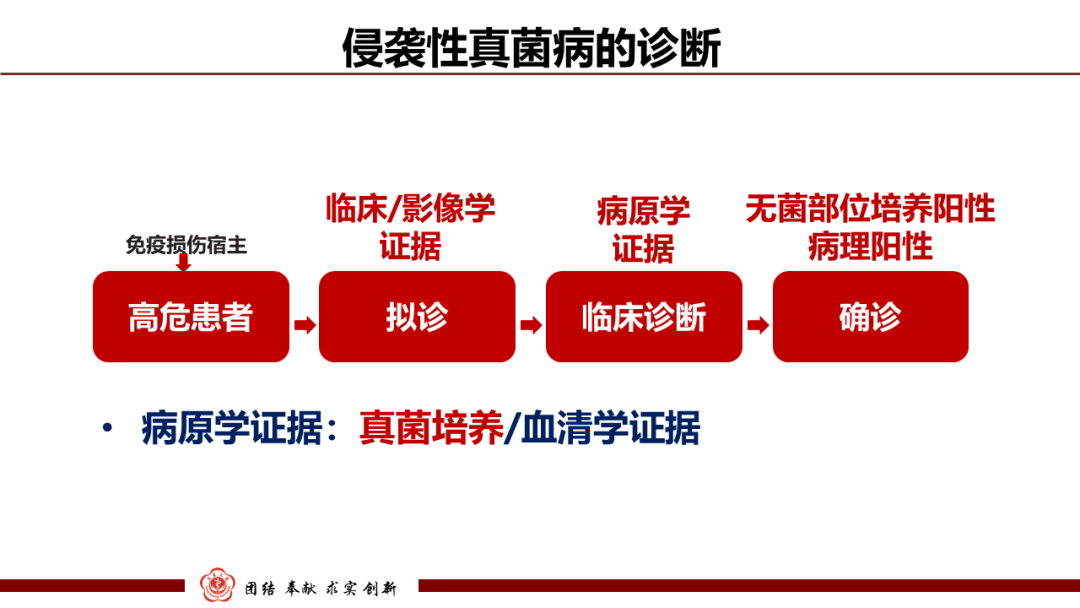
通过本例患者的诊疗,提示我们病原学证据尤其是无菌部位培养阳性是侵袭性真菌病诊断的重要标准,微生物检验的重要地位和角色是不可忽略的。
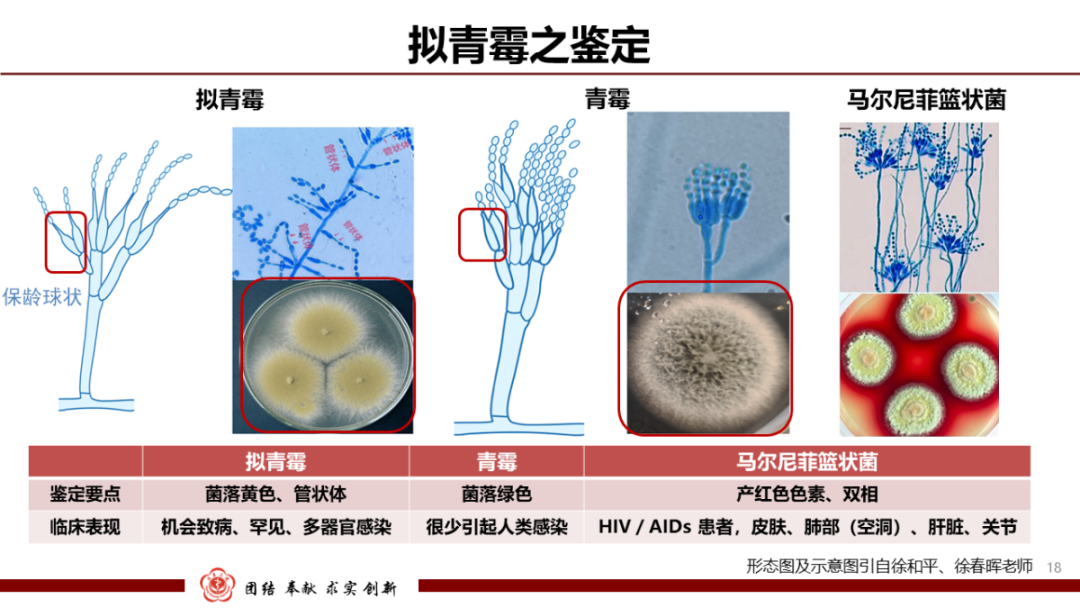
拟青霉属属于腐生性丝状真菌,在土壤、腐烂的植物和蔬菜中生长,世界范围内分布。作为机会性致病菌,所致感染较为罕见。可在免疫功能正常和免疫功能不全的宿主引起感染,主要易患人群:接受免疫抑制剂治疗的器官移植、淋巴瘤、慢性肉芽肿性疾病的患者。临床表现可累及多个系统:下呼吸道、皮肤、骨骼、血液、眼睛(眼内炎)、鼻窦、腹腔(腹膜炎)。拟青霉属中临床最常见的致病菌为宛氏拟青霉。

拟青霉属与青霉属、马尔尼菲篮状菌形态虽然有相似之处,但是还是有不同点,鉴别要点主要包括:
1.拟青霉属菌落生长快速,粉状或小山羊皮状,金黄色,黄绿色、黄棕色、淡紫色或棕褐色,但绝不会出现青霉菌属的绿色或蓝绿色。
2.拟青霉属相对青霉属梗更长、一端逐渐变细成为长的、更纤细的管状体,使它们成为保龄球状,这也是拟青霉独有的特点。
3.马尔尼菲篮状菌能够产独特的红色色素,并且具有双相性。
目前拟青霉的治疗药物临床折点没有建立,有文献对拟青霉常见抗真菌药物的折点进行研究,指出宛式拟青霉对伏立康唑、雷夫康唑表现为高MIC值分布,而对泊沙康唑呈现低MIC值分布。

关于宛氏拟青霉治疗目前并没有明确的治疗方案提出,只有部分文献报道了宛氏拟青霉治疗成功的案例:包括主要为以两性霉素B为主的单用或联合唑类药物,以及泊沙康唑单药或者联合使用。

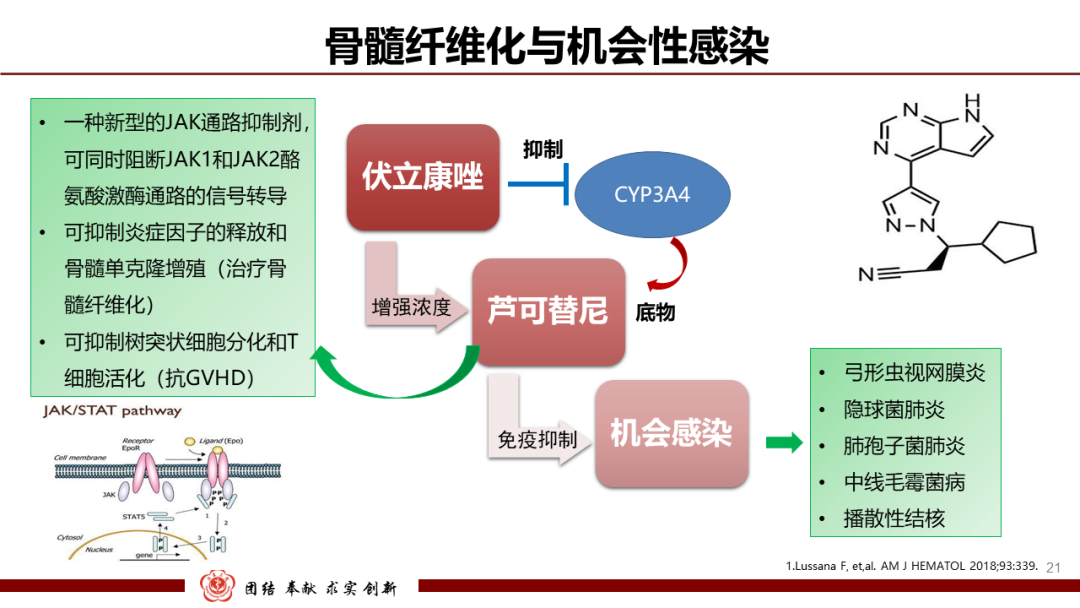
骨髓纤维化本身与机会性感染关系并不密切,但该患者长期口服芦可替尼,芦可替尼是一种新型的JAK通路抑制剂,可同时阻断JAK1和JAK2酪氨酸激酶通路的信号转导,一方面可抑制炎症因子的释放和骨髓单克隆增殖(治疗骨髓纤维化),一方面可抑制树突状细胞分化和T细胞活化,从而引起各种机会性感染。芦可替尼引起机会性感染的个案报道:弓形虫视网膜炎、隐球菌肺炎、肺孢子菌肺炎、中线毛霉菌病、播散性结核。而且,芦可替尼与三唑类抗真菌药物存在明显的相互作用:芦可替尼经过CYP3A4代谢,三唑类(氟康唑、伏立康唑、泊沙康唑等)为CYP3A4强抑制剂,可明显增加芦可替尼的血药浓度,从而进一步增加芦可替尼的免疫抑制作用。本患者前期考虑肺部真菌感染已经服用伏立康唑一段时间,可能增强了芦可替尼的进一步免疫抑制作用,导致机会性感染的加重,也是后续患者肺部培养出拟青霉的重要始动因素。
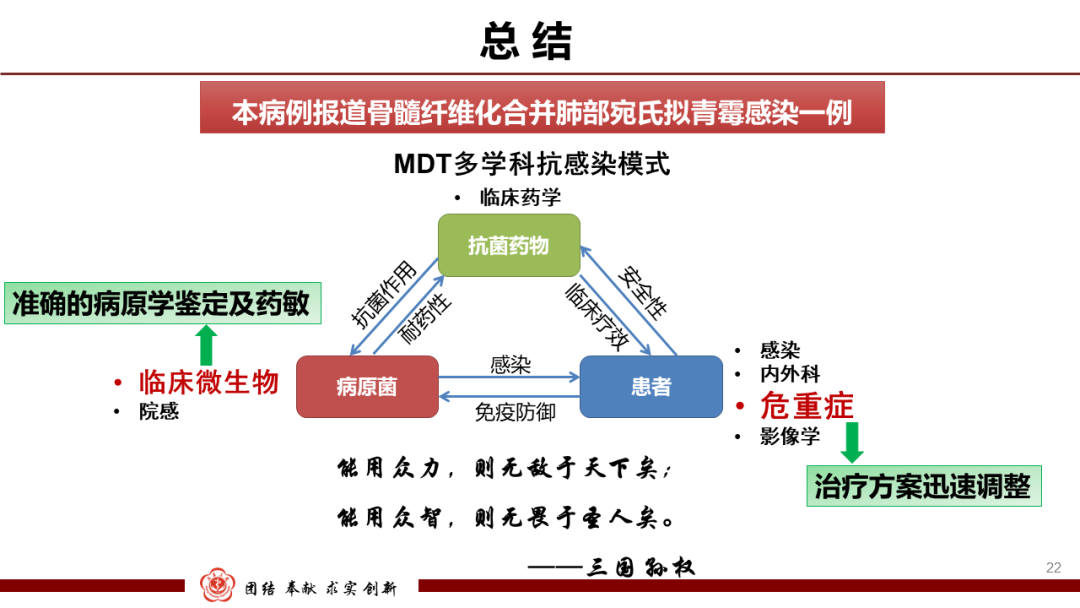
该病例报道了北方地区比较罕见的一例拟青霉属导致的患者机会性肺部感染病例。临床结合患者病史、影像学以及病理学结果给予了肺部真菌感染的初步诊断,并给予伏立康唑进行长期抗真菌治疗。检验科微生物实验室从患者的肺组织匀浆培养出病原菌,并通过形态学进行初步鉴定,进一步又通过测序等不同方法鉴定到种,互为佐证,快速获得准确病原学证据,体现了微生物的扎实功底。此外,微生物实验室提供的宛氏拟青霉药敏结果为患者接下来治疗方案的调整提供了很好的依据。患者长期使用伏立康唑,宛氏拟青霉药敏提示伏立康唑耐药,随即临床更换抗真菌药泊沙康唑联合氟胞嘧啶,把握住治疗时机,取得了良好的临床治疗效果。临床和实验室结合紧密,互为配合。微生物检验为临床诊疗保驾护航,提供精准治疗依据;临床根据检验结果迅速明确病原,调整治疗方案,并且取得治疗效果。
作者|北京大学第三医院 郑佳佳、路明
本文首发自京港感染论坛
查看更多