查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:上海交通大学医学院附属仁济医院 上海市消化疾病研究所 上海市脂肪性肝病诊治研究中心 茅益民

一、CIOMS的DILI国际共识正式发布
2020年6月,历时数年的国际医学科学组织理事会(CIOMS)DILI国际共识在全球正式发布,中国发布会于2020年11月20日在上海通过线上方式举行,这是2020年度DILI领域最重要的事件。
CIOMS国际共识的主题为:“药物性肝损伤:药物研发和上市后环境中的当前现状和未来方向”,该共识由国际上主要的药品监管机构、学术界和制药企业组成的专家组起草,中国医药生物技术协会药物性肝损伤防治技术专业委员会的发起人、中华医学会肝病分会药物性肝病学组组长茅益民教授参与了此国际共识的讨论和撰写。该国际共识依据DILI领域的最新研究证据和当前对相关问题的普遍共识,详尽地阐述了药物性肝损伤的定义、风险因素、临床试验阶段DILI信号识别、临床诊断和严重程度评估、临床管理、上市后药品的监管等各方面。该共识包含8个章节共160页,提出了81条推荐意见,无论是对新药研发的临床试验阶段,还是药品上市后的肝脏安全性监测和监管,都具有重要的指导意义。值得高兴的是,国内DILI领域的多项研究成果被该国际指南引用。




CIOMS的DILI国际共识


DILI国际共识分组讨论
DILI国际共识中国发布会(2020.11.20)
二、 DILI领域的相关研究进展
(一)预测潜在的肝毒性药物
药物是否会导致肝损伤,具有潜在的肝脏毒性,一直是药物研发中的巨大挑战。2020年度,Gastroenterology报道了一种基于人类肝脏的类器官(HLO)高通量毒性筛查(LoT)的新型模型,有助于识别潜在的肝毒性药物。Tadahiro Shinozawa等首先建立了可重复的步骤和流程,从多能干细胞系中生成HLO。多层面的研究和验证提示HLO可很好的模拟人体的肝脏组织:在基因表达和功能方面,HLO中的基因表达与原代肝细胞具有相似性,功能也和原代肝细胞相当,可以模拟成熟肝细胞的主要特征;微解剖结构方面,HLO的肝细胞样细胞之间有胆小管样结构存在,HLO含有指向腔的微绒毛,也具有极化特征,这些都反映了HLO具有类似于体内肝组织的独特的微解剖结构。同时,研究也证实HLO不仅具有类似小管的形态和结构,而且还具有胆汁酸的产生和分泌活性,即功能性构建了胆汁酸的转运途径。
在此基础上,研究人员开发了一种基于384孔的高速实时成像平台,也称为基于HLO的高通量毒性筛选(LoT)模型(图1)。LoT系统通过独特的成像算法每孔可评估15-20个类器官。研究人员评估了238种市售药物包括32个阴性对照和206个已经报道的DILI化合物,显示LoT系统具有较高的预测能力(灵敏度为88.7%;特异性为88.9%)。因此,研究人员认为,这种基于肝脏类器官的毒性筛查模型具有识别潜在肝毒性药物的潜力,可用于毒理学研究,对促进化合物优化、早期药物研发和相关机理的研究,可能具有潜在的价值。

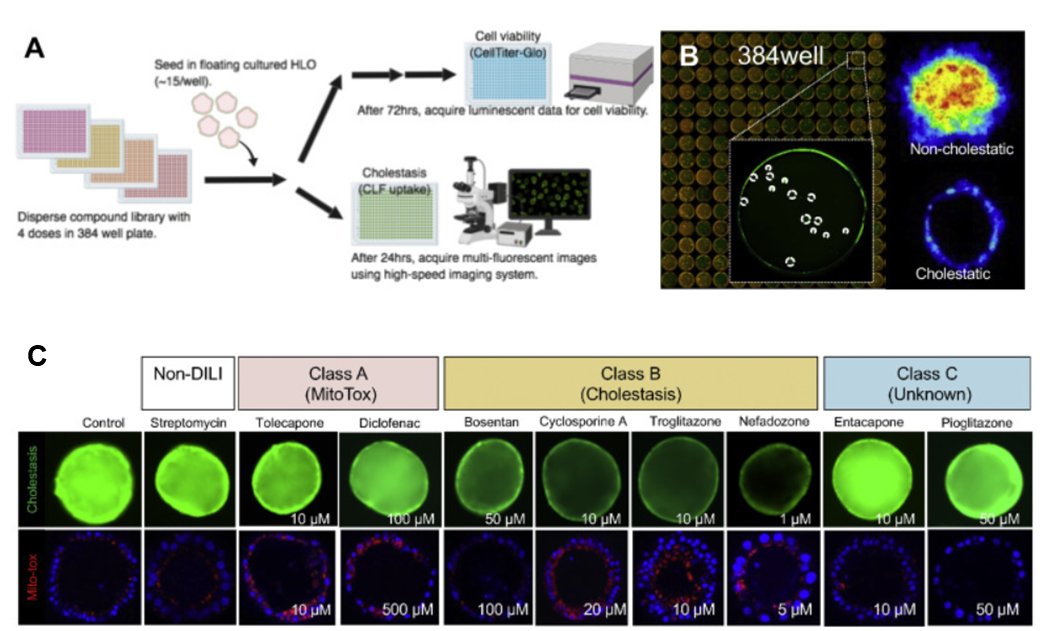
图1 LoT系统评估药物诱发的胆汁淤积潜力和线粒体毒性潜力
(二)预测高风险人群
1. 随着基因组学研究的飞跃发展,全基因组关联研究(GWAS)为复杂性疾病的遗传机制研究指明了方向。Nature Medicine发表了一篇关于通过多基因风险评分预测DILI风险的报道。在本研究中,Masaru Koido等通过汇总既往大规模全基因组关联研究中确定的众多全基因组基因的效应,建立了DILI多基因风险评分系统(PRS),在使用法西立泮、阿莫西林-克拉维酸或氟氯西林的患者中验证,并通过接受超过10种不同药物治疗的多个供体的原代肝细胞和干细胞来源的类器官对DILI的遗传易感性进行研究。研究显示,PRS在涉及十多种药物测评中都被证实有效,包括环孢素、波生坦、曲格列酮、双氯芬酸、氟他胺、酮康唑等。由于PRS所包含的基因与肝脏代谢药物的一系列常见机制相关,所以理论上可适用于不同类型的药物。该研究提示在服药前进行PRS评分,可预测高风险的患者,避免使用相关药物。
2. 既往多篇研究报道了HLA等位基因突变与药物的肝损伤风险相关。2020年Hepatology发表的一项研究探讨了HLA等位基因突变与甲氧苄啶磺胺甲基异恶唑(TMP-SMX)所致特异性DILI的相关性,结果显示,HLA-B * 14:01的基因多态性与欧裔美国人的TMP-SMX 所致肝损伤密切相关,而HLA-B * 35:01的基因多态性与非裔美国人TMP-SMX 所致肝损伤密切相关。同时,Hepatology发表的另一篇报道显示,在美国药物性肝损伤协作网络中的1414例DILI患者中,有40例是由绿茶引起,在这些绿茶相关肝损伤患者中,72% (95% CI: 58%至87%)有HLA-B * 35:01位点的突变,因此,研究认为HLA-B*35:01的基因多态性与绿茶相关性肝损伤相关,可作为的潜在生物标记物。
(三)DILI的机制研究
2020年度,多篇报道分别阐述了DILI的多种机制模式、特异质型DILI的相关机制以及药物引起的急性肝衰竭中可能的分子机制。
1. DILI相关机制
Nature Reviews Drug Discovery发表的一篇综述,概述了正在研究的DILI的多种机制模型,例如线粒体功能障碍、胆汁外排抑制、溶酶体损伤、反应性代谢产物和内质网应激的产生以及免疫系统的参与。①线粒体功能障碍:药物引起线粒体功能障碍主要体现在线粒体DNA复制的抑制,线粒体蛋白质合成障碍和脂肪酸氧化受损。②胆汁外排抑制:由肝胆转运蛋白系统的功能改变引起的药物性胆汁淤积是DILI严重的临床表现。③溶酶体损伤:当穿过溶酶体膜时,阳离子两亲药物呈中性电荷,但在酸性溶酶体区室中带正电,因此膜的渗透性较低。一旦被困在溶酶体中,阳离子两亲药物可能会直接抑制磷脂酶的活性,从而导致加工磷脂或与磷脂结合的能力降低,从而导致无法被代谢或加工大型复合物。④反应性代谢产物:反应性代谢物由已知引起肝毒性的药物形成,基于微粒体的化学反应代谢物和/或ROS积累导致细胞毒性损伤。⑤内质网应激的产生:直接肝毒性药物可在不同细胞器(例如内质网)中诱导氧化应激,导致坏死或凋亡,内质网应激与多种药物诱导的肝损伤有关,在药物性肝损伤(DILI)中,对ER应激的研究程度远小于其他机制。 需要更多的研究工作来了解内质网应激是DILI中的具体作用方式。⑥免疫系统的参与:DILI的免疫机制包括先天性(非特异性)和适应性(抗原特异性)免疫反应。DILI的损伤机制模型具体见图2。

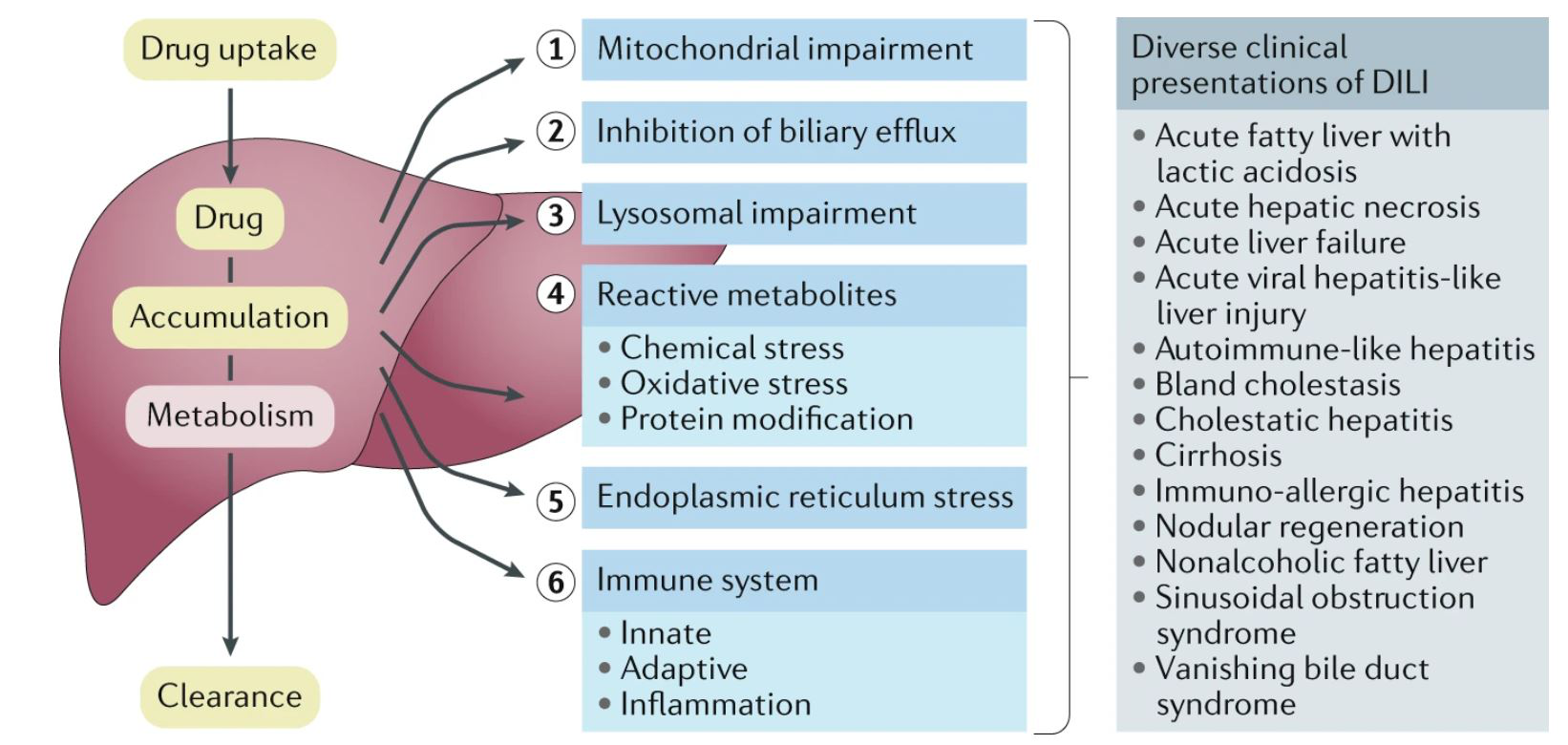
图2: DILI的损伤机制模型
2. 特异质型DILI肝脏炎症相关机制
DILI一般分为固有型和特异型两类。其中异质型DILI发生率低,但伴有严重肝损害,由于其性质复杂,对其机制了解不足,预测其发生十分困难。Annual Review of Pharmacology and Toxicology发表的一篇报道就详细介绍了特异型DILI中的几种损伤机制。其中,特异质型DILI在肝脏中反应性代谢物介导的炎症反应的机制:反应性代谢产物和ROS在肝细胞中蓄积,ROS激活先天免疫系统相关因子,反应性代谢产物最终导致细胞损伤,受损的细胞释放DAMP,DAMP通过TLR和NALP3炎性小体激活库普弗细胞。已激活库普弗细胞释放细胞因子(例如TNF-α和IL-1β)和趋化因子(例如MIP-2),导致肝脏中性粒细胞浸润。中性粒细胞浸润加重了肝损害并引起炎症介导的肝损伤。这种炎症介导肝损伤还通过从受损肝细胞中进一步释放DAMP来加速炎症反应。这种由DAMP介导的反应回路加剧了肝损伤,而反应性代谢物通过原代肝细胞损伤触发了这种炎症反应回路,具体见图三。同时文章也进一步阐述了氟烷、甲巯咪唑以及曲格列酮诱导的肝损伤的相关机制。

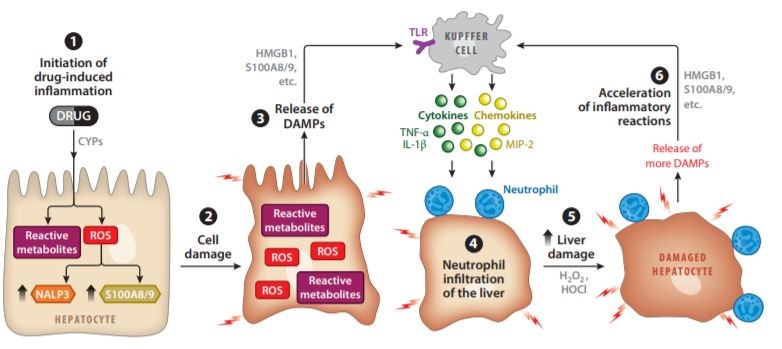
图3:特异质型DILI的肝脏炎症反应机制
3. 药物引起急性肝衰竭的相关机制研究
对乙酰氨基酚(APAP)过量应用是西方急性肝衰竭的主要原因,但目前对其机制仍知之甚少。Nature Communication发表的一项研究显示,阻断血小板C型凝集素样受体2(CLEC-2)信号传导可通过上调TNF-α的产生来增强急性中毒性肝损伤(APAP和四氯化碳)的肝脏恢复,进而增强肝脏组织的中性粒细胞补充募集。这些数据证明血小板CLEC-2可能影响肝脏的无菌炎症反应,为药物引起急性肝衰竭提供了潜在的治疗靶点。
(四)DILI干预措施方面的研究探索
目前药物性肝损伤除了停用可疑药物尚无明确的治疗措施。但当药物引起急性或亚急性肝功能衰竭时,可考虑应用唯一的药物N-乙酰半胱氨酸。
发表在Journal of hepatology的一项研究报道了新型细胞疗法。在该项研究中,给APAP过量导致的急性肝损伤小鼠注射可选择性激活的骨髓源性巨噬细胞(AAMs),AAMs在注射后4h内迅速定位于肝脏和脾脏。注射AAMs后可特异性减少APAP过量后导致的肝细胞坏死,HMGB1易位和浸润中性粒细胞。原代巨噬细胞的呈递同时还刺激了肝细胞和内皮细胞的增殖,并在24h内降低了循环系统中多种促炎因子的水平(图4)。活性的原代巨噬细胞在注射后在体外和损伤的肝组织中均表现出高吞噬活性。巨噬细胞有望成为潜在的基于细胞的急性DILI疗法。

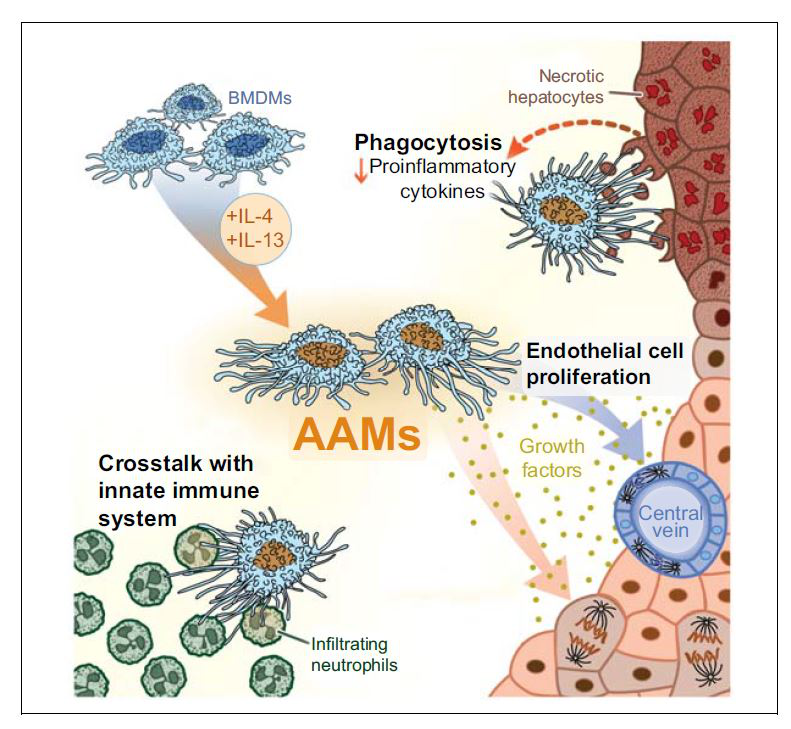
图4:AAMs注射可促进急性肝损伤后坏死的消退
(五)OA引起DILI
脊髓性肌萎缩症(SMA)是一种运动神经元疾病,其根源是SMN蛋白缺乏,基因治疗可能是唯一的途径。Onasemnogene abeparvovec(OA)是一种单剂量静脉注射基因疗法,可以通过利用重组腺相关病毒血清型9(AAV9)衣壳提供稳定,功能齐全的人SMN转基因,以增加SMN蛋白表达并防止运动神经元细胞死亡,从而改善神经元和肌肉功能。OA目前被认为是解决SMA根本原因的基因疗法,然而,肝脏被确定为OA的主要毒性靶器官,OA可导致肝脏相关的不良反应。2020年发表在Journal of hepatology的一项研究分析了325例接受了OA 治疗的SMA患者的数据。90%患者有血清转氨酶升高,其中在临床试验和长期随访中,分别报道了34%和23%的患者有肝脏相关不良反应。研究指出,肝毒性是OA已知的相关风险,相关专业人员应开展进一步研究以确定影响因素,并通过适当的监测和干预措施降低风险。
2020年度,在DILI领域尽管取得了一些进展,而且,CIOMS的国际共识也正式发布。但是,目前在DILI领域仍有大量未被满足的临床需求,包括其确切的发病机制、预测风险和预后的生物标志物、临床诊断和鉴别诊断、干预措施等,因此,期待更多的转化研究为DILI的防治提供科学依据。
中国医学论坛报版权
查看更多