查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





随着近年来临床超广谱抗菌药物的广泛应用,我国细菌耐药性问题已空前严峻。
为解决这一棘手问题,古老药物多黏菌素再次被推向一线。然而,其药物敏感性试验方法和结果解读仍存在诸多争议。
为此,我国多学科专家经反复深入研讨,达成《多黏菌素药物敏感性检测及临床解读专家共识》,为临床医生规范科学使用提供重要依据。
推荐意见
临床微生物实验室在进行多黏菌素药物敏感性测定时,应把握以下原则:
(1)首选美国CLSI以及EUCAST推荐的标准肉汤微量稀释法进行多黏菌素B和黏菌素的药物敏感性试验;对于黏菌素的敏感性测定,也可选择美国CLSI推荐的CAT和CBDE试验;
(2)次选经临床实验室性能验证的商品化肉汤微量稀释法测定板条[使用前应了解国家食品药品监督管理局( FDA)注册情况及药物浓度范围];
(3)药物梯度扩散法(纸片扩散法和E-test法等)不推荐临床实验室使用;
(4)自动化仪器法不作常规推荐,除非获得仪器/药物敏感性板卡制造商的明确允许以及经过临床实验室的性能验证,证实其性能满足临床检测和报告的需求,在某些限定情况下使用时需向临床告知自动化仪器法可能的风险;
(5)多黏菌素药物敏感性试验的质控菌株需包含一株敏感株(如大肠埃希菌ATCC25922或铜绿假单胞菌ATCC27853)以及一株耐药株(如产Mcr-1的大肠埃希菌NCTC13846);
(6)多黏菌素B和黏菌素的药物敏感性试验结果可相互推导。
药物敏感性折点的科学设定需兼顾流行病学折点( ECOFF)、PK/PD折点和临床折点等内容,同时考虑药物的耐药机制及临床给药剂量/方式。下文将介绍目前国际已公布的多黏菌素折点现状,并分步阐述本共识推荐折点所考量的ECOFF、PK/PD折点和临床折点依据。
1.国际折点现状
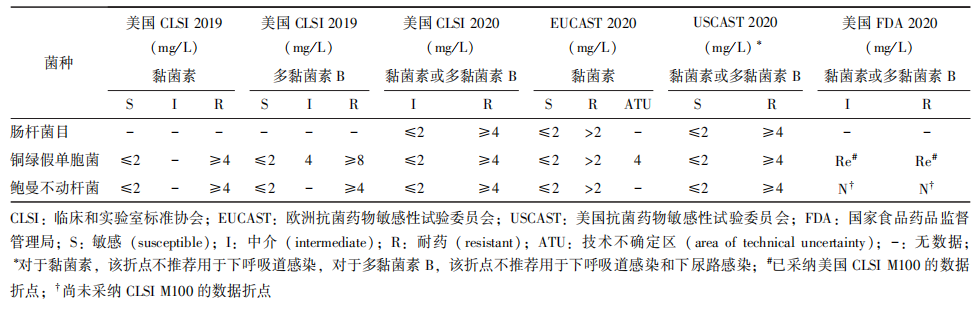
目前,美国CLSI、EUCAST、USCAST及美国FDA等国际折点制定组织已发布了多黏菌素的折点(表2)。美国CLSI认为即使依照折点判断药物敏感性结果获得“中介”结果时,多黏菌素的临床效力亦有限,因此美国CLSI强烈推荐使用多黏菌素的替代用药,即使使用多黏菌素时也应与一种或多种抗菌药物联用。EUCAST则坚持了该组织对于黏菌素的既往折点不改变,即对于肠杆菌目、假单胞菌属和不动杆菌属,黏菌素的折点均为S≤2 mg/L、R>2 mg/L。USCAST折点与EUCAST一致,亦设定为S≤2 mg/L、R≥4 mg/L,但USCAST不推荐此折点用于下呼吸道感染。此外,由于多黏菌素B主要不随尿液排出体外,因此USCAST的多黏菌素B药物敏感性试验折点亦不被推荐用于下尿路感染。
表2 国际组织公布的多黏菌素药物敏感性试验折点
2.流行病学折点
ECOFF是将微生物群体区分为无获得耐药或无突变耐药的“野生型”以及有获得耐药或有突变耐药的“非野生型”菌株的MIC值或抑菌圈直径,其为“野生型”菌株群体敏感性的上限,是设定临床折点的重要参考指标。ECOFF基于体外药物敏感性数据,“野生型”指MIC值≤ ECOFF,说明菌株无获得性和/或无突变耐药;而“非野生型”指MIC值﹥ECOFF,说明菌株有获得性和/或有突变耐药。
EUCAST已发布依据多地区、多组织监测数据得出的多黏菌素对多种菌株的ECOFF值(表3)。
表3 EUCAST公布的黏菌素对不同菌种的ECOFF值(截至2020年7月)
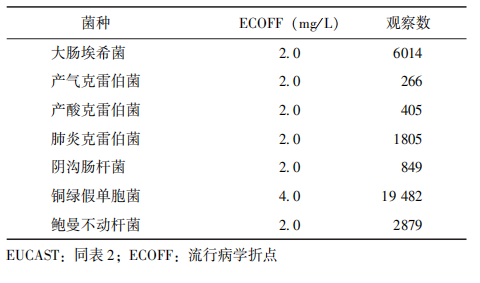
美国CLSI的肠杆菌目与EUCAST的肠杆菌目、不动杆菌属、假单胞菌属折点数据均参考了该机构发布的多黏菌素对相应菌种的ECOFF值。临床不建议直接使用ECOFF值对未确定折点的菌株进行敏感/耐药性判断,但可通过ECOFF值判断菌株属于多黏菌素“野生型”或“非野生型”,对制定临床折点以及选择药物有重要作用。
3.PK/PD折点和用药方案优化
■ PK/PD折点
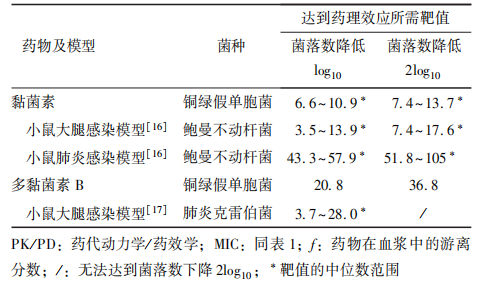
多黏菌素临床上主要包括多黏菌素B硫酸盐、硫酸黏菌素以及CMS。CMS为前体药物,活性成分为黏菌素,而硫酸黏菌素、多黏菌素B硫酸盐为活性形式,可直接用药。黏菌素和多黏菌素B的体外抗菌活性相似,对GNB具有明显抗菌活性,为浓度依赖性抗生素,无PAE,PK/PD指数为ƒAUC/MIC。多黏菌素的PK/PD靶值主要来源于小鼠感染模型。在小鼠的大腿感染模型中,多黏菌素药物对铜绿假单胞菌、鲍曼不动杆菌感染菌落数降低2log10,对肺炎克雷伯菌感染的菌落数降低log10,黏菌素、多黏菌素B需达到的PK/PD靶值均<20;其中肺炎克雷伯菌感染时,多黏菌素B无法使该菌种的菌落数降低2log10。小鼠肺炎模型中黏菌素对铜绿假单胞菌和鲍曼不动杆菌的PK/PD靶值明显高于大腿感染模型(表4)。
表4 多黏菌素对不同革兰阴性杆菌的PK/PD(ƒAUC24h/MIC)靶值
根据以上黏菌素及多黏菌素B的PK/PD靶值,2019年多黏菌素国际指南共识推荐黏菌素的稳态AUCss,avg达到50 (mg·h)/L,相当于稳态平均血药浓度Css,avg达到2 mg/L;推荐多黏菌素B稳态AUCss,24h达到50~100 (mg·h)/L,相当于稳态平均血药浓度Css,24h达到2~4 mg/L。
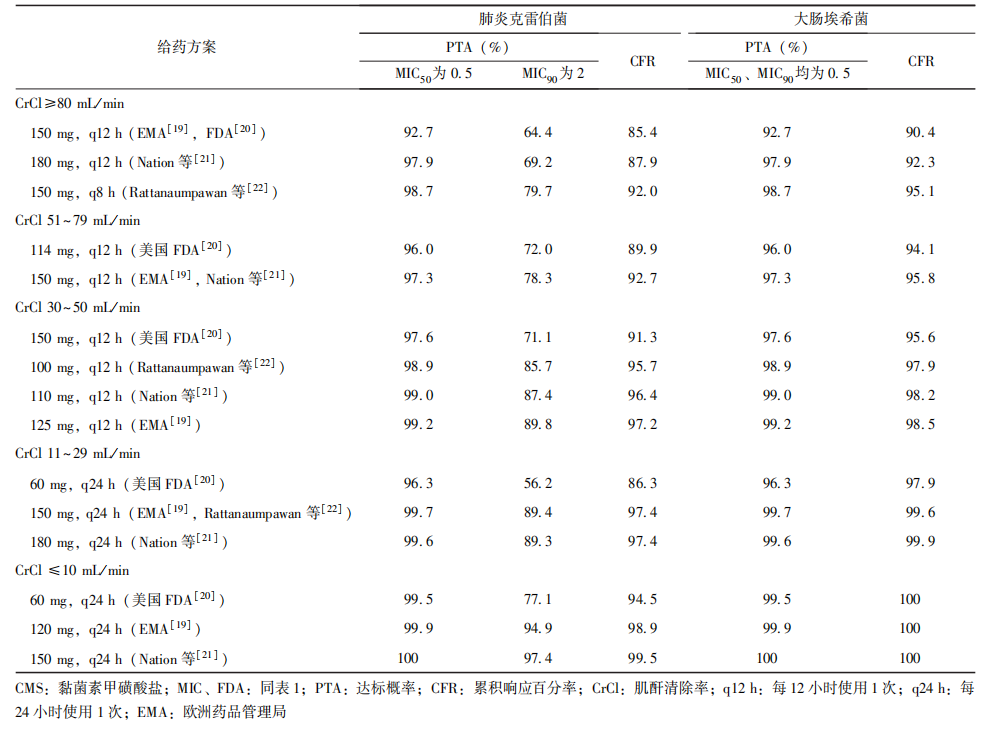
由于CMS主要经肾脏代谢,当肌酐清除率(CrCl)下降时需调整剂量。根据CMS在危重患者中的PPK,结果显示当黏菌素对细菌的MIC≤0.5 mg/L时,在正常肾功能下,CMS剂量以黏菌素活性基质(CBA)计算为150 mg或180 mg 每24小时使用1次的给药方案[欧洲药品管理局(EMA)、美国FDA和Nation等推荐剂量]以及150 mg 每8小时使用1次的给药方案(Rattanaumpawan等)对上述细菌的PTA均可达90%以上;肾功能减退时,需根据CrCl相应调整CMS的给药剂量。
当黏菌素对肺炎克雷伯菌的MIC达2 mg/L时,仅在CrCl ≤10 mL/min的患者中120 mg或150 mg 每24小时使用1次(EMA及Nation等[21]推荐剂量)的PTA可达90%以上,其他正常或肾功能减退患者的PTA无法达到90%(表5)。
表5 不同肾功能情况下CMS推荐给药剂量的PTA和CFR
结合黏菌素对泰国临床分离肺炎克雷伯菌和大肠埃希菌的MIC分布,计算不同推荐剂量下的CFR发现,对于多黏菌素敏感的肺炎克雷伯菌、大肠埃希菌,在肾功能正常的患者中,仅CMS剂量为150 mg 每8小时使用1次的给药方案(Rattanaumpawan等)可使CFR达到90%。对多黏菌素耐药的肺炎克雷伯菌、大肠埃希菌,任何推荐剂量均无法使CFR达到90%以上。
由于MIC50、MIC90以及CFR与细菌的MIC分布有关,因而不同地区的给药剂量推荐应结合当地多黏菌素类药物对目标病原菌的MIC分布情况。
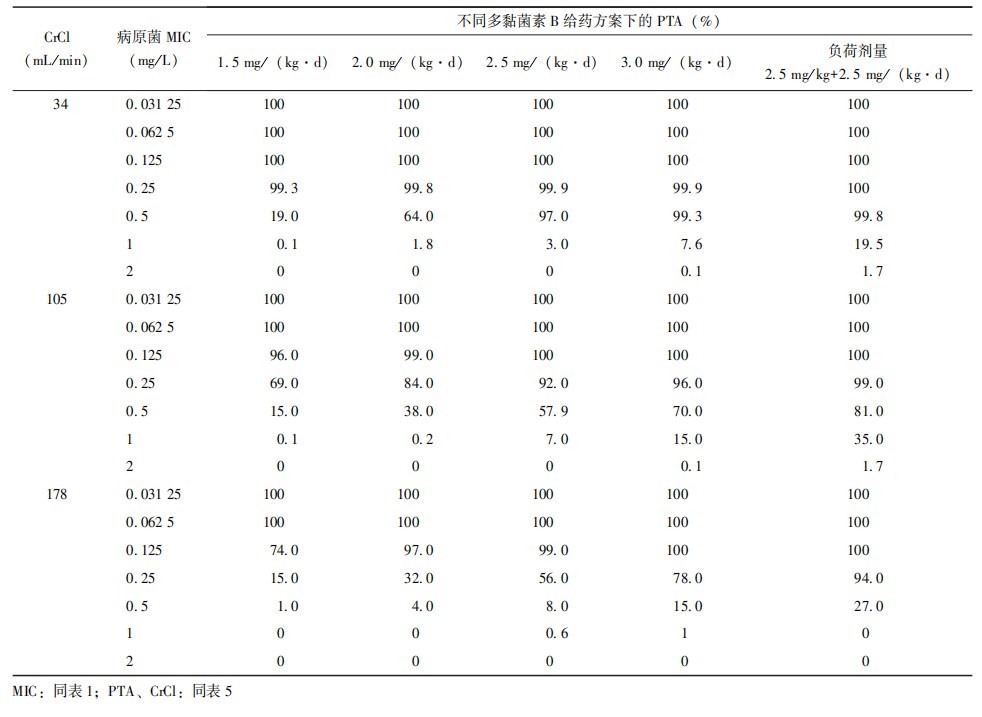
根据PK/PD分析,多黏菌素B无须根据肾功能调整剂量。然而在囊性纤维化患者中,PPK模型发现多黏菌素B的清除与CrCl有关,根据此模型进行MCS,肾功能亢进的患者需增加多黏菌素B的剂量(表6)。
表6 不同肾功能的囊性纤维患者在多黏菌素B给药方案下的PTA
■ PK/PD指导下的多黏菌素治疗方案优化
对于注射用CMS,在剂量换算方面100万IU对应80 mg的CMS和33 mg的CBA。由于CMS需根据肾功能调整剂量,在EMA、美国FDA、美国说明书以及文献研究中对于推荐静脉滴注剂量亦各不相同。
2019年多黏菌素国际共识推荐静脉滴注CMS时,需给予负荷剂量300 mg CBA(约900万IU),并在12~24 h后给予维持剂量。对于肾功能正常者,每日维持剂量为300~360 mg的CBA[(900~1090)万IU],分成两次输注(每12小时给药1次),需每天监测肾功能,根据CrCl调整剂量。
注射用多黏菌素B硫酸盐剂量在不同国家的说明书或共识指南中略有不同。
不同的推荐剂量分别为:(50~100)万IU/d,分两次使用(中国上海上药第一生化药业有限公司的说明书剂量);肾功能正常的成年人和儿童为(1.5~2.5)万IU/(kg·d),分两次(每12小时给药1次),总剂量不超过2.5万IU/(kg·d),肾功能正常的婴儿最大剂量可达4万IU/(kg·d)(美国X-GEN制药公司的说明书剂量)。肾功能正常患者2.5~3.0万IU/(kg·d),分2次静脉滴注[2016年美国感染病学会治疗医院获得性肺炎( HAP)/呼吸机相关性肺炎(VAP)推荐静脉剂量];
对于危重患者,肾功能正常时负荷剂量为2.0~2.5 mg/kg[相当于(2~2.5)万IU/kg],输注1 h以上,维持剂量为每12小时 1.25~1.5 mg/kg[相当于(1.25~1.5)万IU/kg],输注1 h以上[2019年多黏菌素国际共识推荐静脉剂量]。
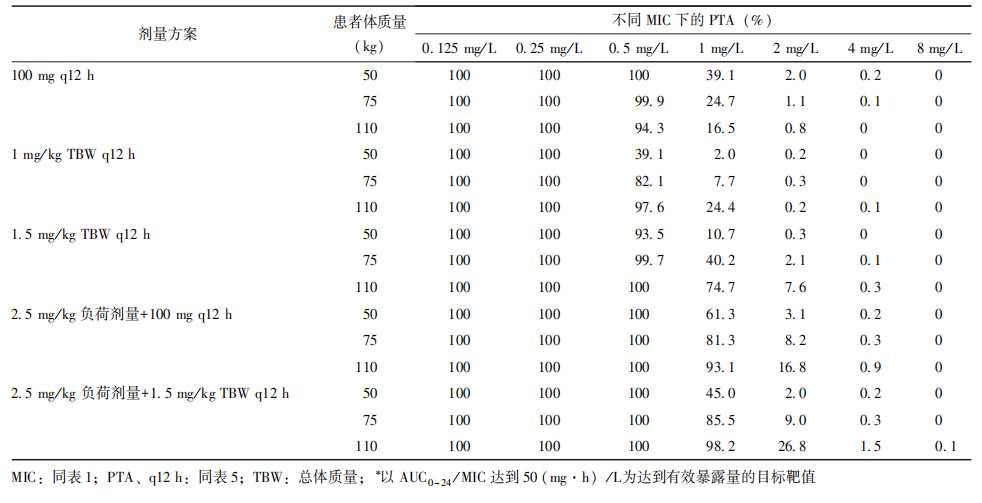
不同剂量下的PTA结果见表7。多黏菌素B剂量为100 mg每12小时给药1次,有无负荷剂量均可使MIC≤0.5 mg/L的细菌的PTA达到90%以上。需注意的是,一般情况下,多黏菌素B的日总剂量不宜超过200 mg/d,以减少不良反应,提高患者依从性。
表7 不同MIC和多黏菌素B推荐剂量下的PTA*
推荐意见
对于多黏菌素药物的治疗方案优化,推荐对多黏菌素药物进行治疗药物监测,获得药物在患者体内的PK,结合分离病原菌的MIC制定治疗方案。
本文摘自多黏菌素药物敏感性检测及临床解读专家共识[J]. 协和医学杂志, 2020, 11(5): 559-570.
查看更多