200
评论
查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





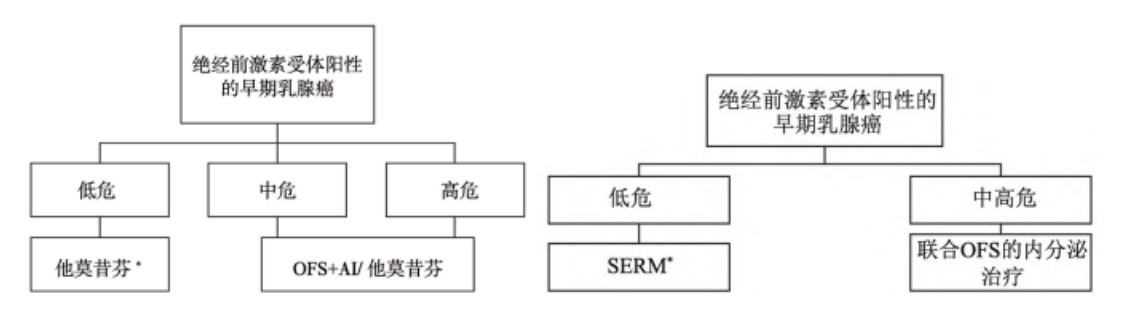
“OFS共识”更新迭代,盘点2021年新版共识值得关注的重点。


查看更多