查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






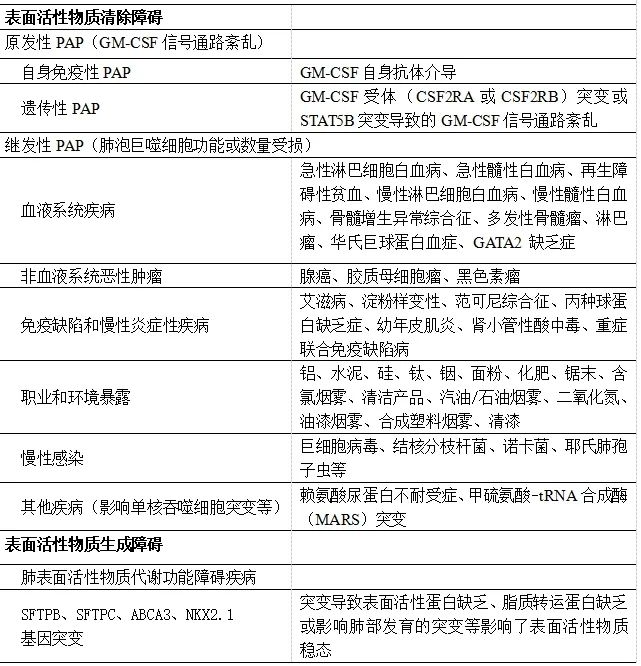
肺泡蛋白沉积症(Pulmonary Alveolar Proteinosis,PAP)是以表面活性物质在肺泡中积聚,导致进行性低氧血症性呼吸功能不全或呼吸衰竭的发生,并增加了继发感染和/或肺纤维化风险为特征的疾病(图1)。PAP病因复杂,存在多种不同致病机制(表1),主要可分为表面活性物质清除障碍和生成障碍两大类。
原发性PAP主要致病机制为粒细胞-巨噬细胞集落刺激因子(GM-CSF)信号传导破坏,继而引起肺泡巨噬细胞和中性粒细胞的功能障碍。其中,自身免疫性PAP(autoimmune PAP,aPAP)在整体人群中的患病率约为每百万人6.7—6.9例。而继发性PAP则是由某些潜在疾病或状态引起,这些疾病会影响肺泡巨噬细胞的数量和/或功能。
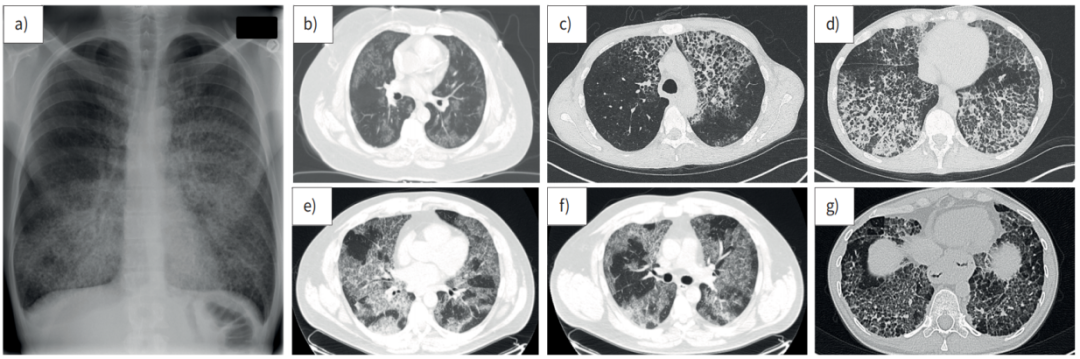
活动期PAP需满足以下任意一项表现:① 出现持续或进展性的症状,例如呼吸困难、咳嗽、咳痰、胸痛、体重减轻等;② 肺功能下降,主要是用力肺活量(FVC)或弥散功能(DLCO)的下降;③ 血气分析示低氧血症,主要为动脉血氧分压(PaO2)、动脉血氧饱和度(SaO2)、肺泡-动脉血氧分压差(PA-aO2)的改变;④ 高分辨率CT(HRCT)出现新的或较前加重的PAP特征性浸润表现,包括但不限于磨玻璃改变和铺路石样变等。同时应排除其他病因或并发症,如呼吸道感染、肺栓塞、肺动脉高压和充血性心力衰竭等。
此外,指南延续了2008年发布的基于症状和PaO2的评分方式,对疾病严重程度进行评估,并且提出了将吸烟、HRCT评分等指标纳入评分的可能性。然而,关于机会性感染的发生能否作为评价PAP严重程度的指标,或仅仅视为PAP并发症,这一点仍无法定论。

首先,由于BAL具备较低的并发症风险等优点,指南推荐可将其作为PAP患者诊断的必要手段。PAP患者肺泡灌洗液多为乳白色,镜下可见颗粒状嗜酸性团块与肺泡巨噬细胞混合。灌洗液细胞分类通常见以淋巴细胞为主的细胞数量增多,细胞学检查可见泡沫状巨噬细胞,其内含嗜酸性颗粒和PAS染色阳性的不规则形态物质,电子显微镜下可见类似管状髓样的板层小体。有报道显示BAL诊断PAP的准确率为90.7%。在操作过程中需关注灌洗部位和位置,灌洗所用液体总量和温度等以减少不良反应发生。
肺活检曾经是PAP诊断金标准。PAP患者活检病理可见完整的肺泡间隔结构,肺泡内及部分细支气管内充满脂蛋白样物质。美国国家PAP研究中心研究提出,由于PAP患者病灶可呈斑片状散在分布,28%病例未能通过组织学检查明确诊断,并且由于肺活检存在一定并发症和死亡风险,因此患者接受度相对低于BAL。若患者接受BAL以及其他无创性检查(如血清学及基因检测等)后仍无法确定病因,才应进行肺活检。
GM-CSF抗体检测具有检测风险低,诊断收益大等优点,推荐在所有PAP患者中进行,对于诊断aPAP有较大价值。有研究对248例经肺活检诊断为PAP患者进行分析发现,89.9%无可解释的PAP病因,但均有GM-CSF抗体水平升高,这提示了GM-CSF抗体检测对于aPAP诊断具有较大的参考意义。aPAP在PAP中有较高的比例,将GM-CSF抗体测定与基因检测相结合,可在无需活检的基础上确诊95%的PAP患者。因此,指南鼓励对所有疑似PAP患者GM-CSF抗体检测,并且提出在进行检测时,应重点关注抗体滴度,仅凭阳性或阴性结果无法确诊aPAP。
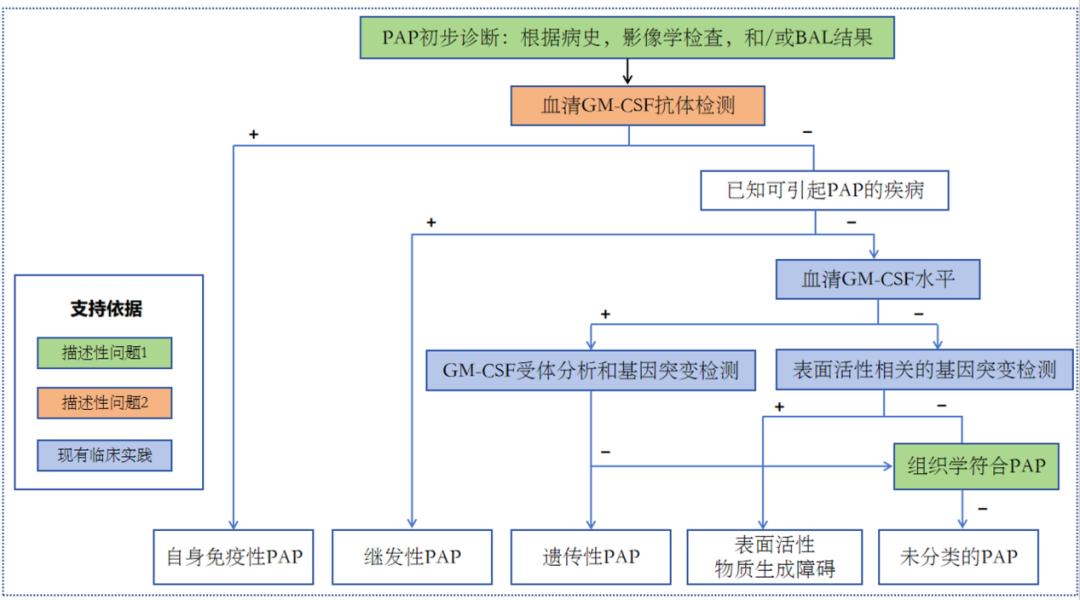
在治疗方面,指南推荐对出现气体交换障碍和其他功能损伤的aPAP患者行WLL治疗。WLL是PAP患者中最常见也是最主要的治疗方法,并且在抢救性治疗或过渡性治疗方面具有一定价值。WLL可显著改善呼吸道症状,指南纳入的10项与WLL治疗有关的研究中,6项研究中所有患者在WLL后症状都得到了改善,其他4项中也有68%-90%患者症状得到改善。并且在治疗后,患者的运动能力以及动脉血氧饱和度等也会在一定时间内得到不同程度的改善。但目前尚无证据表明其他类型的PAP患者是否需要行WLL治疗。并且WLL治疗后需关注患者有无发热、肺炎、气胸等并发症。
同时,指南建议对出现症状的aPAP患者给予GM-CSF吸入治疗,长期使用GM-CSF吸入可最大程度地减少患者对于反复WLL的需求。指南中引用分析了10项与GM-CSF吸入治疗有关的研究后提出,6个月以上的GM-CSF治疗可显著提高患者动脉血氧饱和度、运动能力、患者生存质量评分等各个方面,且不良反应发生率小,因此强烈推荐其用于aPAP的治疗。
若aPAP患者接受WLL和GM-CSF吸入治疗后,仍出现严重症状或需氧疗支持,可考虑使用利妥昔单抗。关于PAP患者应用利妥昔单抗治疗的研究较少,指南收录的7篇案例报道中,5篇报道了患者在利妥昔单抗治疗后3-12个月内的不同时间点取得了临床症状的改善,另外2篇报道显示患者未从利妥昔单抗治疗中获益。利妥昔单抗治疗在PAP中的安全性相关研究数量较少,指南参考了利妥昔单抗在类风湿性关节炎及肾病综合征等疾病中的安全性评估以供参考。
本文由中国医学论坛报呼吸与危重症编委会编委徐凯峰教授组稿
查看更多