查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





根据国际癌症研究机构(IARC)近期公布的全球癌症流行病学数据,胃癌新发(96.8万)和死亡病例(66.0万)分别位居常见恶性肿瘤的第5位和第6位1。内镜或手术切除是早期胃癌治疗的支柱,但是早期胃癌诊断困难,大多数患者在确诊时已处于晚期阶段2,化疗和靶向药物是这类患者的主要治疗手段。然而,常规化疗在转移性胃癌患者中的中位生存期仅约12个月3。基于免疫检查点抑制剂(ICIs)的免疫疗法开启了肿瘤治疗的新时代。近年来,多项临床研究已证实,帕博利珠单抗、纳武利尤单抗等ICIs联合化疗在晚期胃癌一线治疗中较传统化疗显著改善患者生存期4,免疫治疗联合化疗已成为晚期胃食管癌患者的一线标准治疗方案。但是,并非所有患者都能够从免疫治疗中的显著获益,因此,筛选免疫治疗适宜人群和预测疗效的生物标志物的探索成为近年来的研究热点。程序性死亡配体1(PD-L1)表达、微卫星状态(即,微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR))、肿瘤突变负荷(TMB)是美国食品和药物管理局(FDA)批准的免疫治疗的疗效预测指标,也是目前应用较多的预测性生物标志物。然而,患者差异以及胃癌不同组织部位和时间点的异质性是目前这些标志物所面临的重大挑战。动态生物标志物或新型、微创标志物如基于血液的生物标志物、放射学和肠道微生物组等,可以辅助个性化治疗5。今年ASCO会议报道了晚期胃癌ICIs治疗研究的生物标志物探索,本期特别邀请到复旦大学附属中山医院徐晨教授解读和点评相关进展。
探寻接受ICIs联合化疗的转移性HER-2阴性胃食管癌(mEGC)患者早期应答和耐药的循环免疫蛋白生物标志物
基于KEYNOTE 859等多项临床研究结果,ICIs联合化疗已成为HER2阴性转移性胃食管癌(mEGC)患者的一线标准治疗。基于组织样本的生物标志物可辅助指导 ICIs 治疗的选择,但检测标本需要通过侵入性活检获取,并且治疗获益的最佳临界值目前仍存在争议。KeyLargo研究(NCT03342937)是一项帕博利珠单抗联合奥沙利铂和卡培他滨一线治疗HER2阴性mEGC的单臂Ⅱ期研究,研究人员收集了参加该研究的患者的纵向血浆样本,以确定新的预后性和预测性循环蛋白生物标志物6。
研究采用大规模二代多重蛋白质组学(Olink Explore)评估了36例患者的1536个功能性蛋白生物标志物。分析基线 (n=36)、帕博利珠单抗单药治疗一周(C1D8) (n=28)、C2D1(n=25)、首次再分期C4D1 (n=26) 和进展(n=20)时的样本。单变量Cox模型评估每种标志物基线与结局之间的关联性,LASSO用作多变量分析,确定每种生物标志物最重要的组成部分。评估对治疗反应的变化,从基线到C1D8变化效应值>0.5,以及到其他时间点的效应值>1的生物标志物被认为是最重要的,显示为p<0.05(配对t检验)。
基线单变量分析
在基线时,79个标志物对PFS具有预后意义,64个标志物对OS具有预后意义(图1)。
与PFS最相关的5个标志物(p<0.001)为PREB、EPHA10、GHRHR、BAMBl 和 GDF15;SPINK1、S100P、LDLR、GDF15 和 PM20D1 与OS最相关(p<0.003)。图中标注出了20个最具显著性的标志物,与PFS和OS都相关的标志物用蓝色(更差的结果)或红色(更好的结果)表示。
图1. 基线时单变量分析
表1和表2显示通过 LASSO 选择的对预测PFS或OS影响最大的变量。
治疗过程中的分析
帕博利珠单抗治疗的所有时间点,循环 PD1 水平显著升高(图 2)。帕博利珠单抗治疗一周后,只有 6 个免疫相关生物标志物(TNFRSF8、CXCL9、CCL19、IFNγ、IL10、CXCL10)发生变化且效应值>0.5。C2D1时,IO 治疗基础上联合化疗显示,关键代谢和激素调节蛋白(KRT19、GCG、ARG2)变化最为显著(效应值>1)。这些蛋白在 C4D1 时仍然显著改变,此外还有 IL17A、COL4A1、GSTA1、KRT5 和 GPA33。疾病进展时,免疫相关表型再次出现,其中 IL10、IL17A 和 GPA33发生了变化,效应值>1。
图2. 发生显著变化的生物标志物
IO单药治疗1周后,仅发现细胞因子信号通路被调节(图 3)。开始化疗(C2D1)后,受影响的通路变得更加多样化,观察到细胞和代谢通路的改变。许多相同的信号通路在C4D1继续发生改变。在疾病进展时,多个通路仍然发生变化,免疫和炎症通路更加突出。
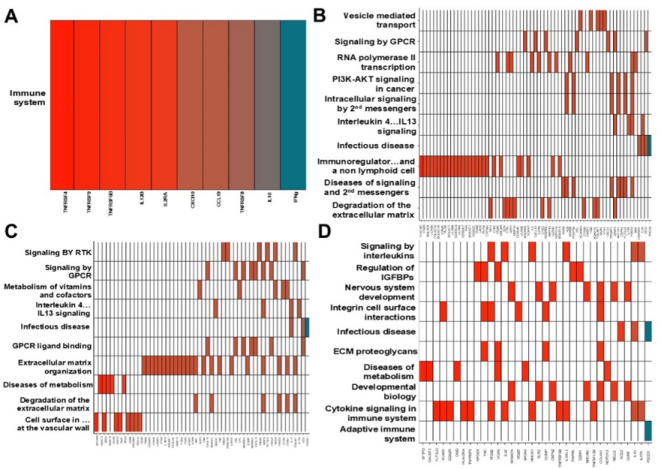
A)C1D8,B)C2D1,C)C4D1,D)PD
除评估基线预后标志物外,进一步探索了各个时间点生物标志物的任何变化是否与结局相关(图4):在任何给定时间点对PFS和OS都有预后意义的标志物用颜色突出显示(红色,HR<1;蓝色,HR>1)。IO单药治疗1周后(C1D8),CD48、BPIFB1 和 CD177 的升高与OS和PFS均显著相关。IO和化疗1个月后(C2D1),确定了多个PFS和OS的良好预后标志物(HR<1)和不良预后标志物(HR>1)。第一次重新分期(C4D1)时,与结局相关的变化标志物通常HR>1,包括PILRA、ESAM和GRN。
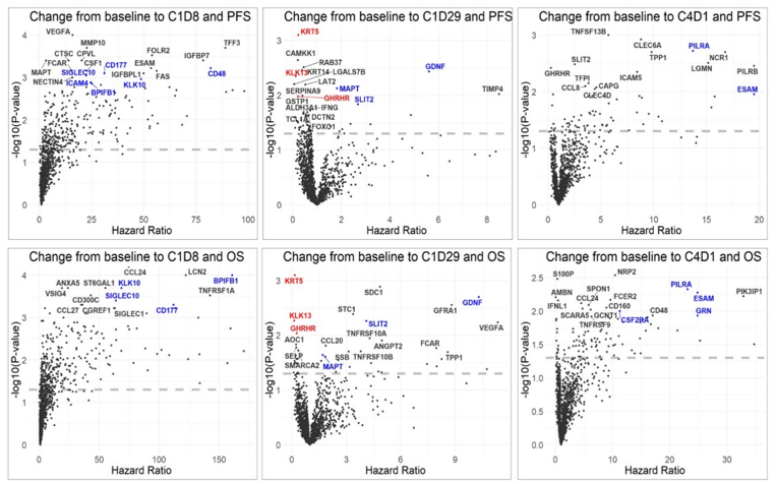
通过该分析,在mEGC中发现了与激素代谢和TGFβ生物学相关的多种预后生物标志物,包括GDF15——一种调节肥胖、肿瘤转移、免疫调节和恶病质的关键分子。免疫相关细胞因子的改变在IO单药治疗后出现,并在疾病进展时再次出现,突出了循环免疫生物标志物在mEGC治疗应答和耐药中的作用。对这1536个蛋白标志物的评估极大地扩展了识别驱动mEGC应答和耐药的新的功能性通路的能力。将蛋白生物标志物与正在进行的循环肿瘤DNA分析相结合,将为这些数据提供更全面的多组学视角。
超灵敏ctDNA动态分析精确捕捉帕博利珠单抗治疗胃食管癌患者的治疗反应
KeyLargo研究从2018年1月至2020年1月期间共纳入36例患者,33例可评估患者中的总体缓解率为76%,显示了令人鼓舞的抗肿瘤效果,但并非所有患者都能显著获益,凸显了进一步探索疗效评估生物标志物的必要性。因此,对25例患者基线和治疗期间的159份血浆样本进行回顾性分析,利用超灵敏肿瘤信息ctDNA评估分子/最小残留病灶(MRD)以及肿瘤演变7。NeXT Personal是一种肿瘤信息ctDNA 检测方法,通过肿瘤和正常样本的全基因组测序(WGS)为每位患者构建定制的液体活检panel,由多达1800个选定的体细胞变异组成,可实现低至1~3百万分率(PPM)的超灵敏检测。每位患者的NeXT Personal结果与影像学评估和临床结局一起分析。
图5. NeXT个体化流程图
追踪患者治疗反应需要超灵敏分析方法
NeXT Personal 可检测到ctDNA阳性事件,对低肿瘤比例(<0.01%)样本具有超高灵敏度。ctDNA 阳性样本的动态范围从406,067至1.5个ctDNA分子PPM(图6)。
图6.基线及不同治疗时间点患者的ctDNA水平
所有患者在基线和C1D8时均显示ctDNA阳性。大多数患者在其大部分纵向血浆样本(119/159)中显示ctDNA阳性,中位检测限为2.03PPM(四分位范围1.66~2.74 PPM)。在低PPM水平下观察到大量ctDNA阳性,20%(24/119)的ctDNA阳性时间点显示血浆中ctDNA水平低于0.01%(或100PPM)。
纵向ctDNA变化与患者生存相关
图7. ctDNA变化与治疗缓解情况
ctDNA谱分析比影像学更早发现疾病进展
ctDNA 水平变化与总体肿瘤负荷变化(根据RECIST标准以靶病灶直径总和来衡量)之间有很强的相关性(p=0.58,p=7.3e-9)。最佳总体缓解类别中的代表性例子显示,ctDNA(绿色)与肿瘤大小(灰色)之间高度一致。
此外,观察到的一些病例表明ctDNA谱分析具有很强的互补性,在影像学未检测到进展的患者中,ctDNA分析能够检测到患者的反应动态(患者 108)。对于所有患者,在临床进展之前或临床进展时可检测到分子进展,提前的中位时间为65天(Panel E)。
图8. ctDNA动态变化与影像学评估结果
分子清除和分子应答对临床结局的改善具有预后意义
缺乏早期的分子应答(ctDNA水平下降)则OS和PFS更差,ctDNA的分子清除与OS和PFS的改善相关。为了模拟检测限为 100 PPM的ctDNA结果,将所有≤100PPM的阳性检测结果改为“未检测到”重新分析了数据。在这个100PPM的模拟检测限下,ctDNA的清除与OS(p=0.68)和PFS(p=0.37)的改善不再相关。
图9. ctDNA动态变化与PFS和OS
在晚期疾病阶段,超灵敏ctDNA平台对于精准追踪和预测治疗反应至关重要。ctDNA谱分析与患者的最佳缓解和肿瘤大小的变化相关,是对影像学的补充,可更精细地评估患者对治疗的反应。肿瘤分子PPM动态变化对免疫治疗反应具有预后意义。
专家点评
血液中循环生物标志物是指外周血中包括细胞、核酸、细胞外小泡、蛋白质和代谢物等物质,有足够的敏感性和特异性,与疾病的严重程度相关,可以观察到预后的或预测性的生物标记物效应。ASCO会议报道了帕博利珠单抗联合化疗治疗转移性 HER-2 阴性胃食管癌患者早期反应和耐药的循环免疫蛋白生物标志物探索分析,研究纳入了广泛的功能性蛋白质生物标志物(1536个),涉及与激素代谢和 TGFβ生物学相关的蛋白质,采用二代多重蛋白质组学(Olink Explore)进行评估,发现了与PFS和OS获益明显相关的蛋白生物标志物,突出了循环免疫蛋白生物标志物在HER2阴性晚期胃食管癌免疫治疗敏感和耐药方面具有潜在的预测作用,期待在未来能够有更精准的探索。
ctDNA是目前为止应用较为广泛的血液循环生物标志物之一,被用于多种肿瘤的早筛、诊断、治疗疗效监测等方面。此次ASCO会议报道了超灵敏检测方法对ctDNA的动态分析,观察其与帕博利珠单抗联合化疗一线治疗胃食管癌患者治疗反应的相关性,ctDNA水平较早出现下降和清除的患者PFS和OS显著改善,而ctDNA水平在早期无变化的患者PFS和OS较差。ctDNA动态分析可更早地预测患者的治疗结局,基于ctDNA 的分子进展较影像学进展早2个月左右,而且ctDNA动态变化与肿瘤直径变化相关。这一研究进一步支持通过超灵敏检测方法动态监测ctDNA水平,精确地评估患者对治疗的反应,更早发现疾病进展患者并采取合适的干预方案,对于晚期胃食管癌患者接受ICIs联合化疗的治疗决策的优化具有重要意义。
时间和空间的强异质性是胃癌的突出特征,生物标志物对胃管癌治疗决策的制定和疗效预测至关重要。PD-L1表达、MSI/MMR的检测多依赖于组织样本,且检测结果因不同的抗体选择、判读方法等不同而存在差异。TMB受肿瘤类型、肿瘤微环境的遗传改变、外部致癌物的暴露和检测方法等多种因素的影响,从而影响其作为预测生物标志物的准确性。常规组织检测存在取样困难、取样窗口期有限、无法展现肿瘤全貌特征等诸多局限性。液体活检不仅具有微创、快速、敏感和准确等优点,还能动态反映肿瘤的基因组全貌,是精准诊断和判断预后的有效方法。此次报道的ctDNA和蛋白生物标志物对于预测帕博利珠单抗治疗晚期胃癌疗效令人鼓舞,期待这类标志物能在大型临床研究中进一步得以验证,并在未来能应用于临床实践,促进胃食管癌治疗决策的不断优化。
除上述生物标志物外,肠道菌群和幽门螺杆菌感染也被证明在胃癌免疫治疗中的预测作用。组学技术(如基因组学、转录组学和代谢组学)的快速发展也促使多种免疫微环境相关生物标志物在免疫治疗疗效预测中的探索,为指导胃癌免疫治疗带来新的希望。

徐晨 教授
复旦大学附属中山医院
复旦大学附属中山医院病理科副主任医师
复旦大学附属中山医院梅陇院区病理科执行副主任
美国国立卫生研究院(NIH)访问学者
中华医学会消化内镜学会病理协作组委员
上海市医学会病理专科分会第十二届青年委员会副主任委员
中国研究型医院学会分子诊断医学专业委员会青年委员会副主任委员
CACA-肿瘤病理专业委员会胃肠间质瘤协作组秘书
第二届CACA COP胃肠肿瘤学组委员
CACA第六届肿瘤病理专委会青年委员
第二届全国卫生产业企业管理协会试验医学专家委员会病理专委会委员
中国抗癌协会胃癌专委会基础与病理学组委员
中国研究型医院学会超微与分子病理专业委员会委员
《临床与实验病理学杂志》青年编委
参考文献:
1. Bray F, et al. CA Cancer J Clin. 2024 May-Jun;74(4)229-263.
2. Xu XQ, et al. Clin Exp Med. 2023 Nov;23(7):3189-3204.
3. Wagner AD, et al. Cochrane Database Syst Rev.2017 Aug 29;8(8):CD004064.
4. NCCN. Gastric Cancer. 2024 V2.
5. Holder AM, et al. Nat Rev Cancer.2024 Jul;24(7):498-512.
6. Nixon A, et al. ASCO 2024. Abstract 4024.
7. Nixon A, et al. ASCO 2024. Abstract 4025.
声明:
本资讯由默沙东医学团队支持,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
审批编号:MI-PD1-6364-CN
审批有效期:2024.12.31
查看更多