查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





“欲使其灭亡,必先使其疯狂。”
这句话用在癌细胞身上,恐怕再适合不过了。
从本质上讲,癌症就是一种基因病。当细胞内的基因突变积累到一定程度之后,细胞要么走向衰老死亡,要么就走向癌变。
不过这些突变在赋予癌细胞不死和无限繁殖能力的同时,也给它们的毁灭埋下了伏笔。
这个毁灭伏笔的序曲在1922年。
那一年,在哥伦比亚大学摩尔根实验室工作的遗传学家Calvin Bridges,在黑腹果蝇身上发现一种有趣的现象:当某两个特定的基因同时突变失活时,会导致果蝇的死亡;而这两个基因单独任何一个突变失活,都不会给果蝇带来致命的伤害。
1946年,Theodosius Dobzhansky给这种现象取了个名字,它就是今天大名鼎鼎的“合成致死”效应。
这个概念一沉寂就是51年。在考虑到癌细胞携带有大量基因突变之后,1997年,福瑞德·哈金森癌症研究中心的Stephen Friend敏锐地察觉到,这个“合成致死”的理念或许可以用到癌症的治疗中。
在Stephen Friend看来,正常细胞癌变是个异常的举动。俗话说,“物极必反”,那我们干脆就让异常来得更疯狂吧。
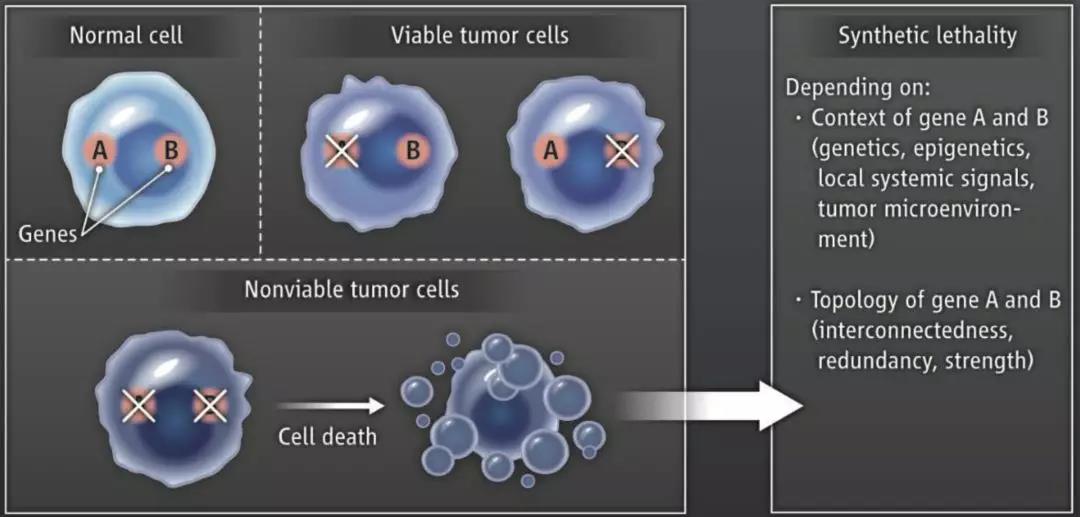
合成致死理念
这个想法很疯狂,不过竟真的能让癌细胞走向死亡。
2014年,全世界第一个按照“合成致死”理念设计的抗癌药物PARP(多聚ADP核糖聚合酶)抑制剂Olaparib,获得FDA批准用于治疗卵巢癌。随后,在2016年和2017年,PARP抑制剂Rucaparib和Niraparib先后闪亮登场。
一种全新的抗癌手段崛地而起。
实际上,大部分细胞从正常走向癌变,并不是说它们的基因天生就不好,而是因为在生长的过程中,细胞的DNA会不断遭受内在和周遭各种不利因素的夹击,例如,辐射、化学毒物、细胞自身有害代谢产物、DNA自己复制错误等,导致癌症相关基因发生了突变,最终导致了癌症。
据估计,人体每个细胞每天产生的单链DNA损伤数约为10000个,如果把其他损伤也都算上的话这个数据又要翻10倍,变成10万个。
与DNA遭受的损伤相比,癌症的发生风险就显得微不足道了,这主要得益于人体精密、复杂而高效的DNA修复系统。
在DNA损伤中,最严重的损伤是单链断裂和双链断裂,不过单链断裂更常见。这些断裂如果不能得到及时、准确的修复,会使基因组变得不稳定,进而引起癌变,甚至直接导致细胞死亡。

DNA单链断裂(SSB)和双链断裂(DSB)示意图
为维持正常生理功能,细胞必须有多种DNA损伤发现和修复机制,使受损的DNA得到及时精确的修复。
对于单链断裂而言,它的修复主要依赖于PARP,这个酶在人体内有17种,它们虽然长得有些像,但功能却不尽相同。
目前的研究认为,DNA损伤修复依赖的PARPs主要包括PARP-1和PARP-2,它俩都能精准地识别DNA的伤口,并与DNA亲密结合。只不过在修复DNA损伤的过程中,PARP-1发挥着90%以上的功能,PARP-2更像是个备胎。
而对于双链断裂而言,它虽然少,但是情况更严重,如果不能及时修复,细胞的DNA就会变得不稳定,细胞最终走向死亡。
所以双链DNA断裂有两种主要的修复方式。一种是非同源末端连接(NHEJ)修复,它更像个紧急救火队长,先不管修复的对不对,把断掉的DNA连上再说。这种方法最主要的优点是快,但是非常容易出错,一旦出大问题,对细胞来说有可能就是毁灭性的打击。
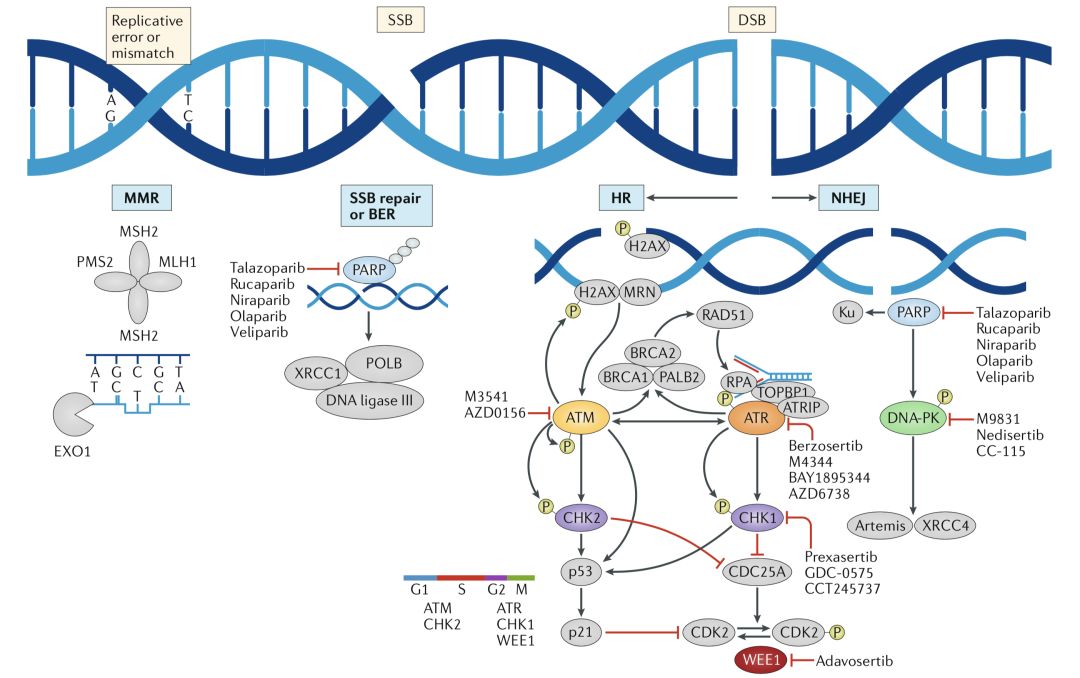
DNA断裂的修复方式一览
另外一种是同源重组(HR)修复途径,参与这种修复方式的蛋白非常之多例如BRCA、ATM、RAD51等等,其中最为人所熟知的是BRCA蛋白。这种修复方式像外科手术,是一种高保真、无错误的修复方式。
对于癌细胞而言,既然它是基因突变导致的,那肯定是上述修复过程没起作用,或者工作不到位造成的。
鉴于癌细胞也要维持自身基因组的稳定性,因此,作为一个“理性”的癌细胞,它们肯定不会让上述所有的DNA损伤修复机制全部瘫痪。不过为了保持进化的活力,部分修复方式失去功能是可能的。
这也就给了科学家们可乘之机。以DNA修复为靶点,把癌细胞这个DNA已经出现大量突变的“破罐子”彻底捣毁。
2005年,“摔破”癌细胞这个“破罐子”的曙光初现。
两个独立研究团队背靠背在顶级期刊《自然》发表重要研究成果,首次证实PARP抑制剂与BRCA1或BRCA2突变之间存在“合成致死”的相互作用。
合成致死治疗癌症的大门打开了。
结合前面介绍的DNA修复机制,你会发现PARP与BRCA是一对合成致死冤家这事儿并不难理解。癌细胞的DNA再混乱,它们也还是需要维持自身基因组的稳定。
如果负责双链断裂修复的BRCA突变失活了,我们再把管单链断裂的PARP抑制掉,癌细胞中每天出现的大量单链断裂就会变成双链断裂,最终导致癌细胞死亡。
不过,这个合成致死的机制看似简单,其实要设计一个优秀的PARP抑制剂并没有那么简单。
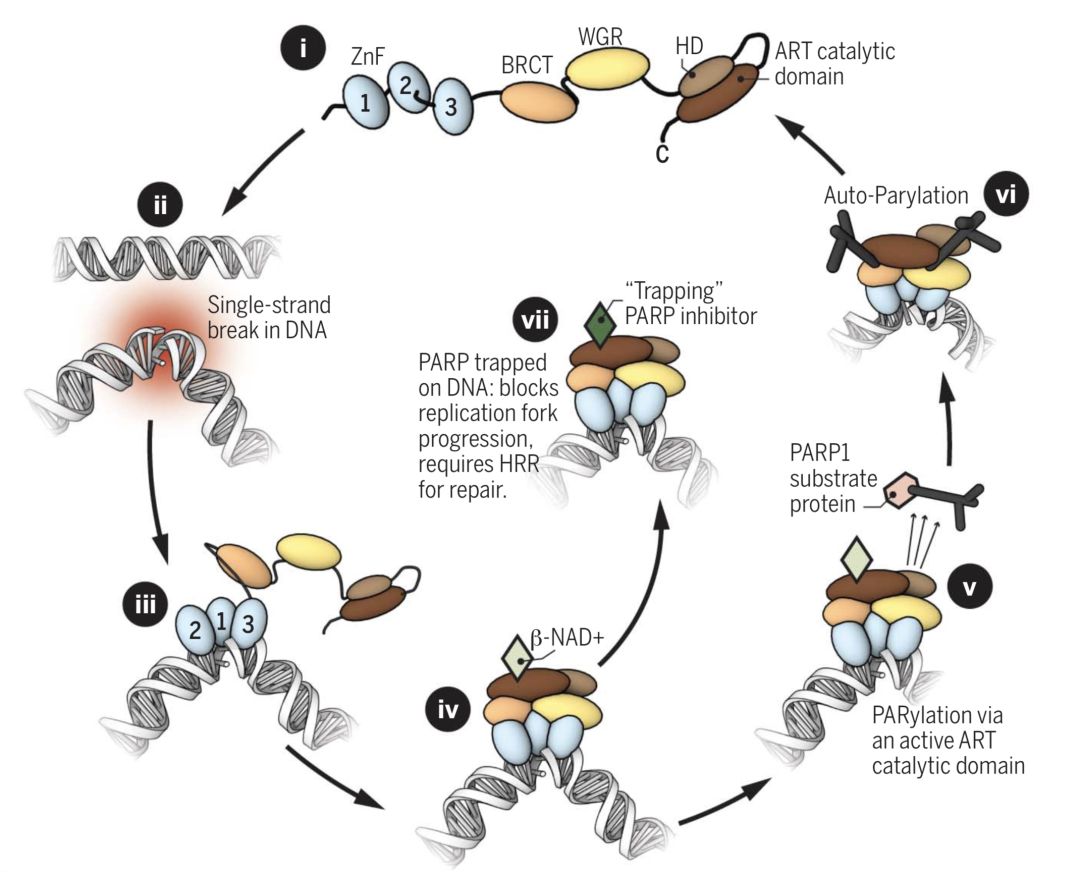
PARP抑制剂“合成致死”机制
要把这个事情说清楚,我们还得从PARP修复单链DNA断裂的过程说起。
在细胞内,一旦PARP发现DNA上存在单链断裂的缺口,就会立即结合上去,这种结合会激活PARP的催化活性。
此时,游荡在PARP周围的烟酰胺腺嘌呤二核苷酸(NAD+,这个物质最近非常火,抗衰老、抗癌都有它的份儿)会立即与PARP的活性位点结合,结合后的复合体会把周围参与DNA修复效应子统统拉过来,填补上DNA断开的缺口。与此同时,染色质也会变得松弛,PARP复合体就顺利从损伤缺口脱离下来,回到之前的失活状态待命。
在这个修复的过程中,NAD+与PARP的结合,就是那个关键的点。
实际上,早在30年前,小分子烟酰胺类似物就被证明可以竞争性抑制这个过程,并增强DNA损伤剂硫酸二甲酯的细胞毒性。
目前在临床中使用的所有PARP抑制剂,都有一个与NAD+竞争结合PARP的烟酰胺部分,因此它们抑制PARP催化活性的能力是类似的;然而,由于不同的抑制剂结构存在较大差异,它们对不同PARP家族成员的选择性存在一定的差异。
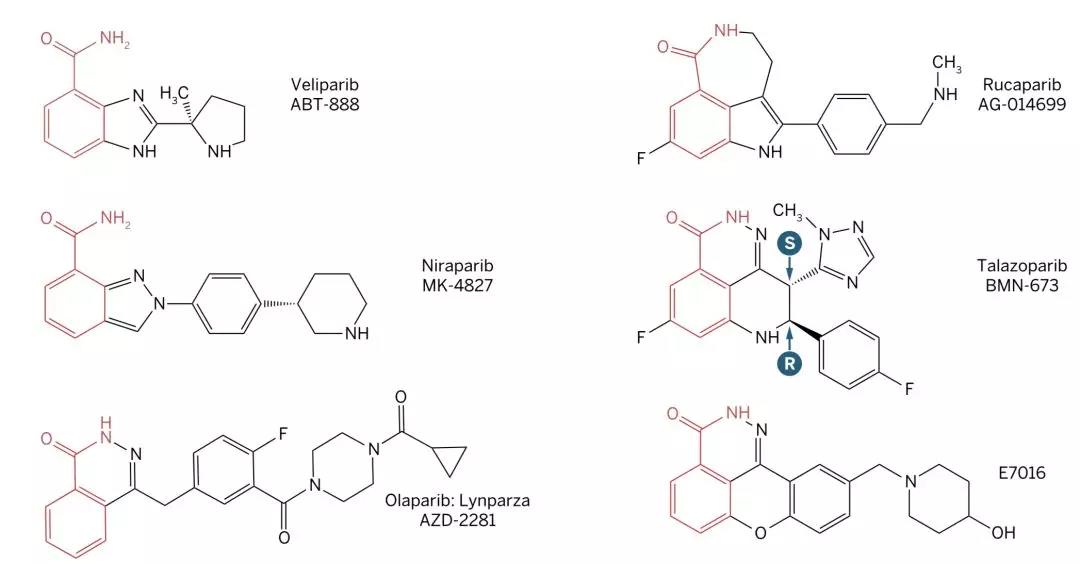
PARP抑制剂结构比拼:红色部分为共通部分
可别小看了这个差异,毕竟科学家对PARP-3的认知还不够。
虽然从结构上看,PARP-3与PARP-1也长得很像,但PARP-3在组织分布、生物学功能方面,与PARP-1却表现出很大的不同[。
除此之外,之前还有研究表明,当PARP-1表达被抑制之后,PARP-2的表达会代偿性地增加,以顶替PARP-1的职能;但PARP-3却不会在PARP-1和PARP-2表达被抑制后代偿性增加。而且也有研究表明,特异性抑制PARP-1和PARP-2,但不抑制PARP-3,就能让肿瘤消退。
这些似乎都表明PARP-3有其独特的生物学功能。
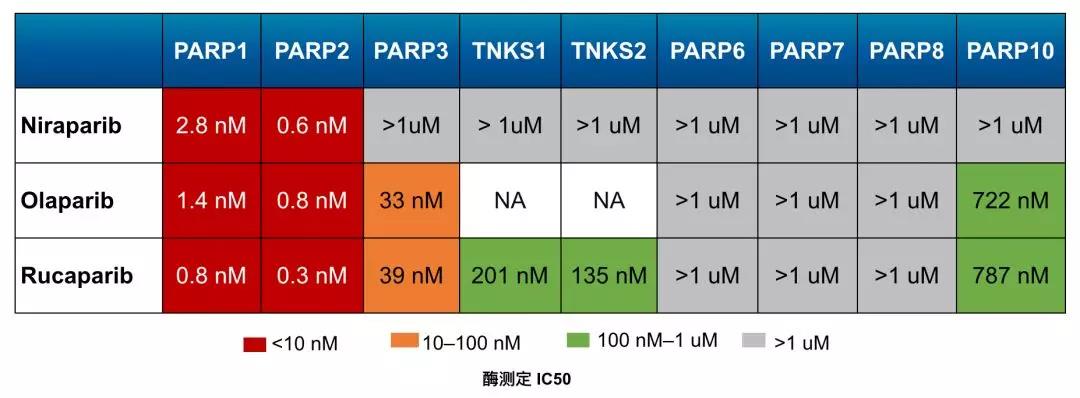
部分PARP抑制剂选择性的比较
由此可见,PARP抑制剂抑制PARP-3的活性,可能不仅没有抗癌效果,而且可能还有意想不到的副作用。
在研究PARP抑制剂的过程中,科学家们还发现了一个很奇怪的现象。
PARP抑制剂对癌细胞的杀伤力大于敲除PARP基因本身,这意味着PARP抑制剂的抗癌效果不仅仅在于抑制PARP的活性,背后可能还有其他的原因。
后来科学家发现,这个现象要归结于PARP抑制剂对PARP的“诱捕”作用。
所谓“诱捕”作用,说的是PARP抑制剂竞争性结合到PARP酶上之后,会导致与受损DNA结合的PARP-1和PARP-2被困在DNA上下不来了,同时直接造成其他的DNA修复蛋白也结合不上来了。后果是,DNA断裂不仅不能被修复,而且还从单链断裂变成双链断裂,最终导致细胞死亡。
实际上,科学家已经认识到,“诱捕”PARP并把它“钉”在DNA上,才是PARP抑制剂消灭癌细胞的最大杀器。因此,在比较单一PARP抑制剂抗癌活性时,必须基于其捕获效力。
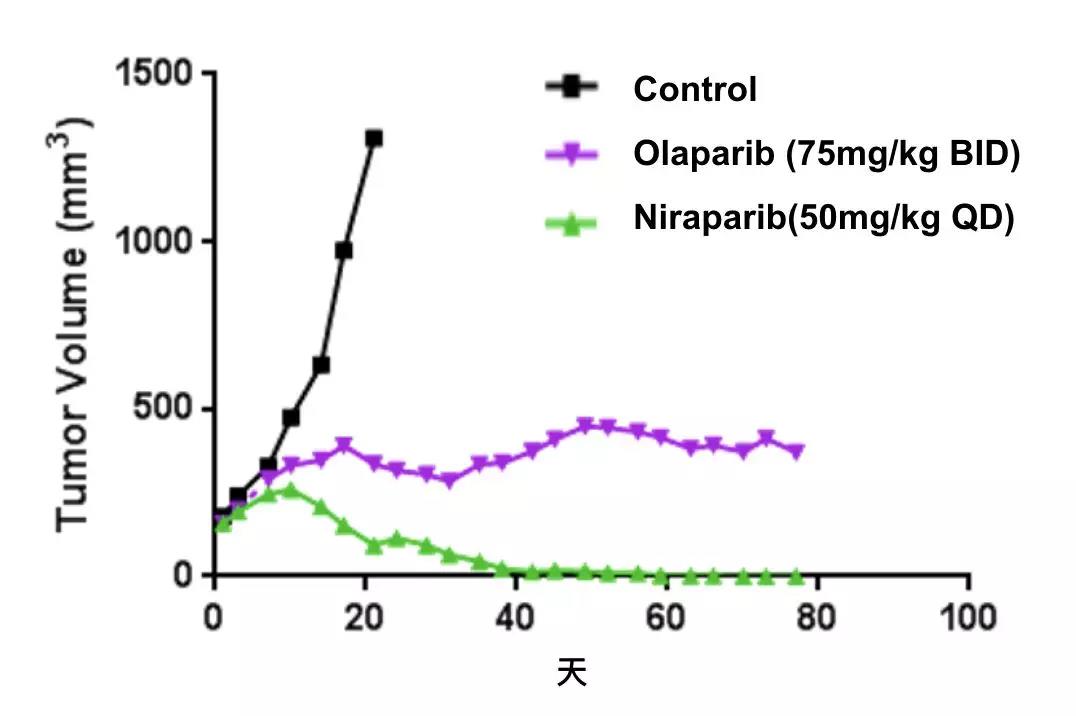
PARP抑制剂在BRCA2突变模式小鼠中的效果
它们捕获能力之间的这种差异,也反映在了抗癌效果上。
可能你已经发现了,上面介绍的都是PARP抑制剂与BRCA突变之间的协同致死作用,但是以BRCA为代表的同源重组通路并非只有BRCA这一条路,对于BRCA基因没有突变的癌细胞,PARP抑制剂是不是也有效果呢?
其实,2005年的研究就已经表明:PARP抑制剂对于BRCA没有突变的癌细胞也有杀伤力。
只不过与携带BRCA突变的癌细胞相比,BRCA没有突变的癌细胞对PARP抑制剂的敏感性差了近1000倍。
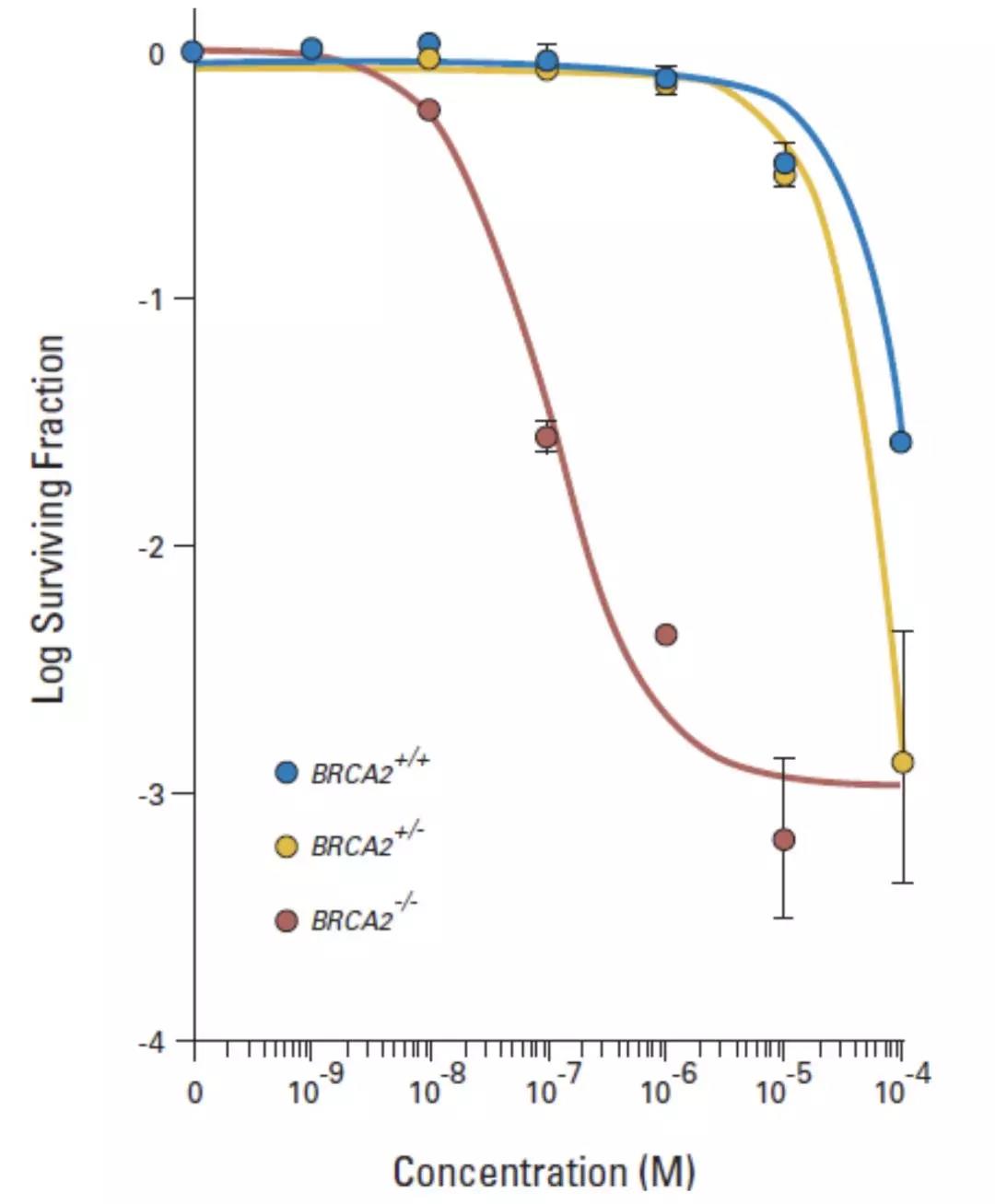
BRCA突变比不突变对PARP抑制剂更敏感
这也就意味着,对于那些BRCA基因没有突变的肿瘤,在使用PARP抑制剂治疗时,需要更高的药物暴露,才能到达与BRCA突变的肿瘤同样的效果。
当然,我们对于PARP抑制剂的认知还刚刚起步,它应该还有很多未知的技能等着我们去发现。
例如德州大学MD安德森癌症中心的研究团队发现,抑制肿瘤细胞的PARP修复通路,竟然可以触发STING免疫通路,进而募集杀伤性T细胞进入肿瘤。
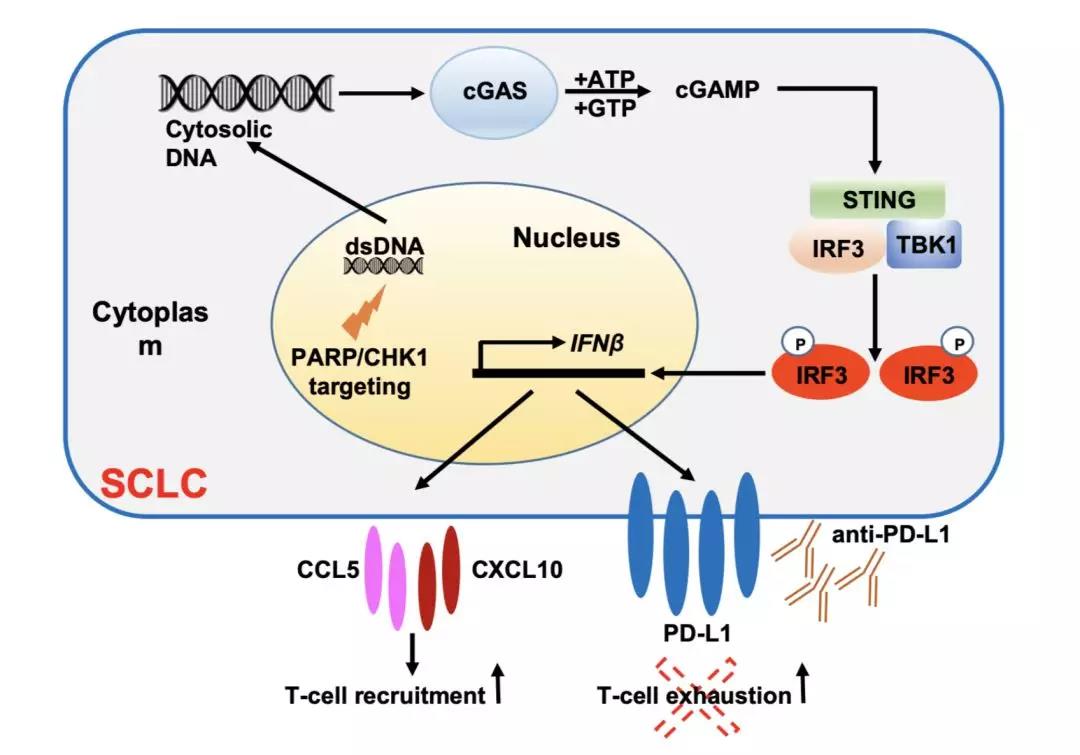
抑制PARP激活免疫通路的机制
这个研究暗示,PARP抑制剂联合免疫检查点抑制剂将大有可为。
PARP抑制剂的未来,可期。
来源:奇点网

查看更多