查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所 梁少珊 曾彩虹

患者为青年女性,右侧心脏死亡器官捐献供肾肾移植术后4年余,肾功能长期稳定,少量尿蛋白逐渐降至正常,血糖持续正常,近3月随PRA-Ⅱ类抗体阳性出现血清肌酐轻度升高。供体明确糖尿病病史15年,供肾肾脏病理表现为糖尿病肾病(DN);肾移植术后半年常规肾活检表现为供肾移入性DN;术后4年肾活检DN病理改变发生部分逆转,合并移植肾小球病。术后随访6年肾功能正常。

肾移植 零点活检 糖尿病肾病

病例摘要
现病史 24岁女性患者,因“肾移植术后4年余,血清肌酐(SCr)升高4年”于2018-10-11入院。
患者于2014年3月30日因慢性肾小球肾炎(CKD 5D期)在我院行右侧同种异体肾移植术。心脏死亡器官捐献(DCD)供肾,供体时年45岁,有明确糖尿病病史15年,供肾获取时SCr 81μmol/L,尿蛋白1+。术前抗胸腺淋巴细胞球蛋白(ATG)+甲强龙诱导,手术顺利,术后应用吗替麦考酚酯、他克莫司、强的松免疫抑制治疗,术后10日SCr降至104μmol/L,空腹血糖4.51mmol/L,糖化血红蛋白4.8%。术后于我科门诊规律随访,依血药浓度调整免疫抑制剂用量,SCr波动于99~120μmol/L,空腹血糖3.52-6.22mmol/L,尿检尿蛋白0.76~1.53g/24h,FK506血药浓度波动于3.86~8.17ng/ml。2014年9月入院行移植肾常规活检,免疫抑制方案未调整。患者SCr持续稳定于93~132μmol/L,尿蛋白阴性。2018年7月我科门诊查群体反应性抗体(PRA)-Ⅱ类抗体阳性(DP1,DP5),将吗替麦考酚酯从0.5g 1/12小时加量至0.75g 1/早+ 0.5g 1/晚、他克莫司从2.5mg 1/早 2mg 1/晚加量至2.5mg 1/12小时。发病以来二便正常,食欲、睡眠尚可。
既往史:2010年9月16日因眼睑浮肿当地医院检查发现尿蛋白3+,隐血2+,SCr约1000μmol/L,血压150/90mmHg,开始行维持性血液透析。否认糖尿病病史。
个人史、家族史:无特殊。
体格检查:体温36.5℃,脉搏75次/分,呼吸15次/分,血压155/93mmHg,身高164cm,体重46.8kg,体质量指数 17.4kg/m2。心肺体检未见明确异常,腹平软,全腹无压痛及反跳痛,肝脾肋下未触及,双下肢无浮肿。右下腹见一长约12cm的手术瘢痕,可及移植肾,质中,无压痛,边界清,未闻及血管杂音。

尿液:尿蛋白定量0.31g/24h,尿沉渣红细胞 阴性。
血常规:血红蛋白97g/L,白细胞4.3×109/L,血小板168×109/L。
血生化:白蛋白40.30g/L,球蛋白 20.4g/L,Scr 112μmol/L,胱抑素C 1.50mg/L,尿素氮24.4mg/L,尿酸426μmol/L,ALT、AST 正常,总胆固醇 3.32mmol/L,甘油三酯 1.25mmol/L,空腹血糖4.50mmol./l,餐后血糖为5.5~14.3mmol/L,电解质正常。CRP<0.5 mg/L。
免疫学:PRA-Ⅱ类抗体阳性(DP1 2582,DP5 1796),PRA-I类抗体、抗MICA抗体均阴性(术前PRA-I类、Ⅱ类、抗MICA抗体均阴性)。
血药浓度:他克莫司8.2ng/ml,霉酚酸 AUC0~12h 38.79mg.h/L。
其他:传染病四项HBsAg阴性,HCV阴性,梅毒阴性,HIV阴性。

超声:移植肾大小约110mm×46mm×75mm,肾窦回声未见分离,肾实质回声未见明确异常。肾内各级血管树显示清晰,血流色彩充填丰富。频谱多普勒显示波形正常、移植肾各级动脉阻力指数增高。

供肾活检(2014-03-30)
光镜:皮质肾组织1条。5个肾小球中1个球性废弃。余正切肾小球体积增大,系膜区重度增宽,2个球见K-W结节形成(图1A),毛细血管袢开放好,节段袢融合、扩张,囊壁增厚。PASM-Masson:阴性。肾小管上皮细胞刷状缘脱落,胞浆空泡变性,小管基膜增厚,散在小管萎缩、基膜增厚(<5%),非萎缩肾小管基膜亦增厚,间质散在单个核细胞浸润。入球及出球小动脉见透明变性。
免疫荧光:肾小球15个中5个球性废弃,余肾小球IgG+,弥漫分布,呈类线状沉积于血管袢(图1B);IgA、IgM、C3、C1q阴性。
小结:供肾肾小球结节样病变,肾小管急性损伤,肾小管基膜增厚,入球及出球小动脉透明变性,符合糖尿病肾病(DN)。供肾肾小球硬化2分,肾小管萎缩1分,间质纤维化0分,动脉管径狭窄1分,总评分4分(Remuzzi评分)
移植肾首次肾活检(2014-09-14)
光镜:皮质及皮髓质肾组织各1条。28个肾小球中13个球性废弃,2个节段硬化,余正切肾小球体积增大,肾小球系膜区中~重度增宽,系膜基质增多为主,5个球见K-W结节形成(图2A、B),个别球见系膜区结构疏松,毛细血管袢开放尚好,节段袢融合、扩张,袢内单个核细胞浸润1-8个/球,偶见透明滴,囊壁增厚、分层。PASM-Masson:阴性。肾小管间质中度慢性病变,多灶性肾小管萎缩、基膜增厚,非萎缩肾小管基膜亦增厚,小灶性肾小管上皮细胞刷状缘脱落,管腔内较多蛋白管型,间质灶性单个核细胞浸润,纤维化++。多处入球及出球小动脉透明变性,个别动脉管腔狭窄、闭锁,小叶间动脉弹力层增厚、分层。
免疫荧光:肾小球6个,IgM+,节段分布,呈颗粒状沉积于系膜区和血管袢。C4d管周毛细血管阴性。免疫组化:SV40染色阴性。
电镜:1个球性硬化的肾小球。
小结:移植肾体积增大伴肾小球中-重度系膜增生及结节形成,球性废弃(13/28)、节段硬化(2/28),肾小管间质中度慢性病变(30%),入球及出球小动脉透明变性,考虑移入性DN。(Banff评分见表1)
移植肾第二次肾活检(2018-10-19)
光镜:皮质肾组织2条。25个肾小球中6个球性废弃。余正切肾小球体积增大,系膜区中-重度增宽,偶见系膜溶解,未见明显K-W结节形成(图3A),毛细血管袢开放好,袢内单个核细胞浸润1~8个/球,偶见透明滴,个别球血管袢皱缩,节段外周袢与囊壁粘连,囊壁增厚、分层。PASM-Masson:肾小球节段外周袢分层。肾小管间质慢性病变,多灶性小管萎缩、基膜增厚,未萎缩小管基膜亦增厚,小灶性小管上皮细胞刷状缘脱落,管腔内见蛋白管型,间质灶性单个核细胞浸润,偶见小管炎(1个/切面),管周毛细血管炎不明显,灶性纤维化。小叶间动脉内膜增厚,小动脉数处透明变性。
免疫荧光:肾小球7个中1个球性废弃。IgM+、C3+、C1q+,弥漫分布,呈颗粒状沉积于系膜区和血管袢。IgG、IgA阴性。C4d管周毛细血管阴性。免疫组化:SV40染色阴性。
电镜:2个肾小球中1个球性废弃。肾小球系膜区增宽,系膜基质增多(图3B),系膜区少量高密度电子致密物沉积。肾小球毛细血管袢开放尚可,基膜增厚,约860-1160nm(图3B),数处基膜内皮下区域增宽、结构疏松或呈网格状、层状改变(图3C),数处系膜插入、新的基膜形成;基膜内皮下少量电子致密物沉积,上皮侧未见电子致密物沉积。肾小球足细胞足突融合5-10%,少数袢融合成片。管周毛细血管见分层(5~7层)。
小结:1移植肾肾小球中-重度系膜增生性病变,肾小球基膜增厚,球性废弃(6/25),肾小管间质慢性病变(25%),动脉透明变性,与上次切片相比球性废弃比例降低,系膜增生程度减轻;2.肾小球内皮细胞病变,内皮下分层,管周毛细血管分层,考虑合并移植肾小球病(Banff评分见表1)。
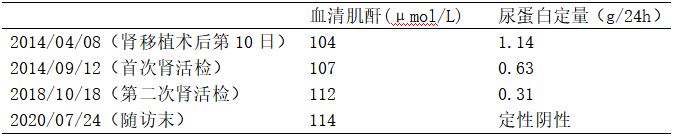
综合临床病理,最终诊断为右侧同种异体肾移植术后,供肾移入性DN,移植肾小球病。患者第二次移植肾活检病理与术后半年的相比肾小球增生程度改善显著,但患者病理穿刺有少许肾小球炎及移植肾小球病,同时伴有DP1和DP5抗体阳性,予以将吗替麦考酚酯加量至0.75g 1/12小时。肾移植术后一共随访75个月,病情稳定,末次SCr 114μmol/L,尿蛋白阴性(表2)(图4)。
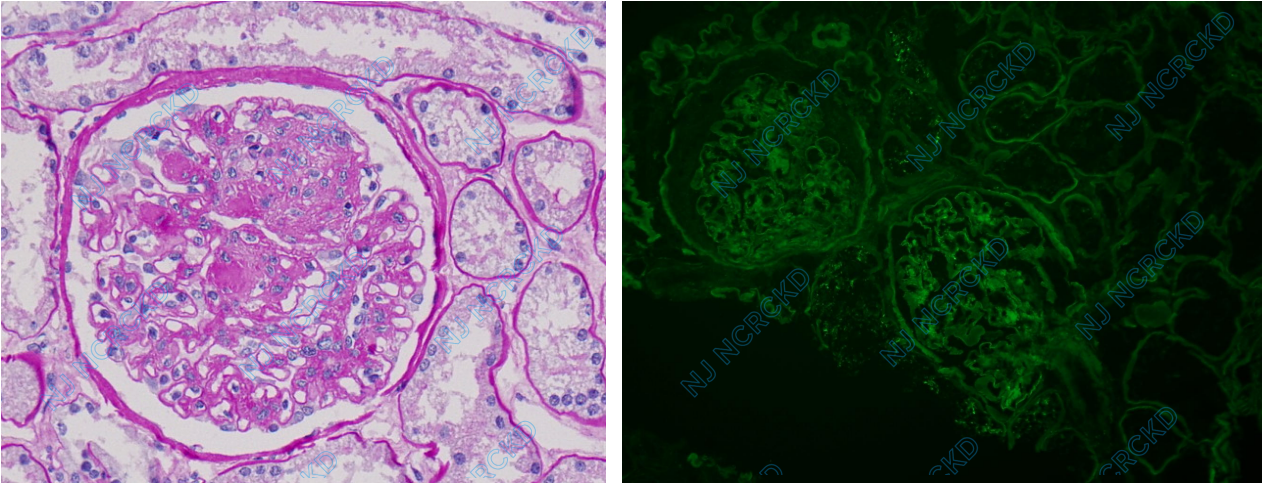
图1 供肾活检病理改变,A:肾小球系膜区重度增宽,见结节形成,肾小管基膜增厚(PAS,×400);B:肾小球IgG+类线状沉积于血管袢(IF)。
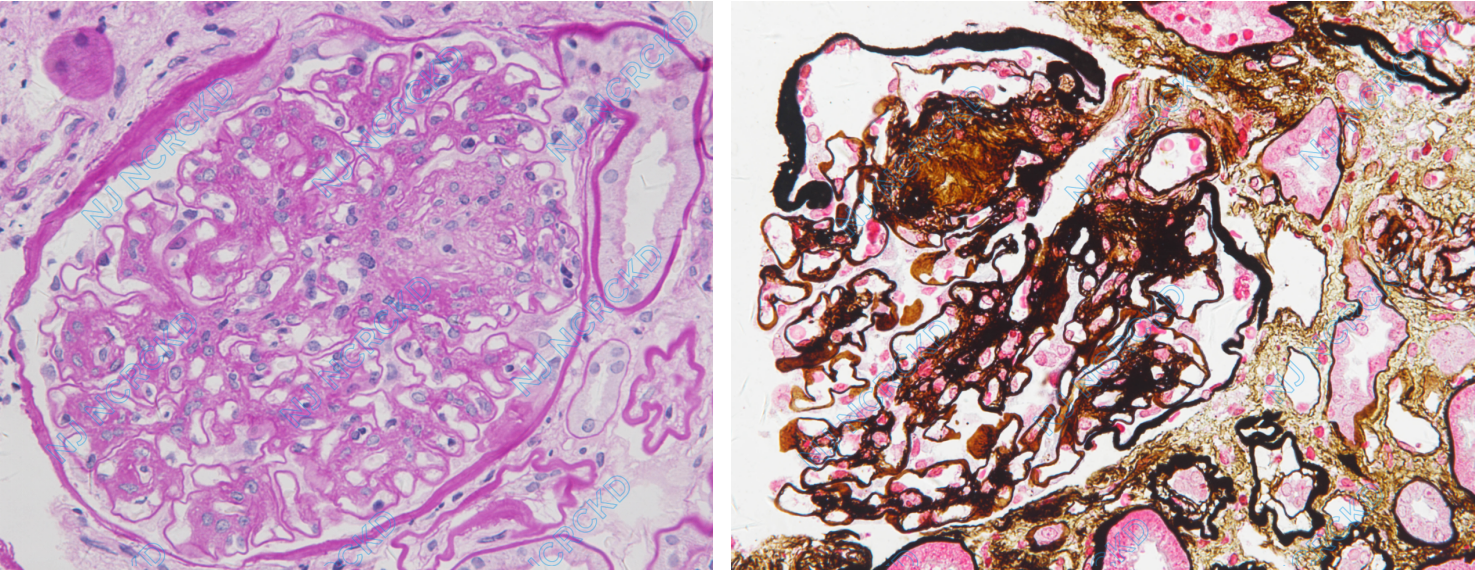
图2 移植肾首次活检病理改变,A:肾小球系膜区重度增宽,见结节形成,肾小管基膜增厚(PAS,×400);B:肾小球K-W结节形成(PASM-Masson,×400)。
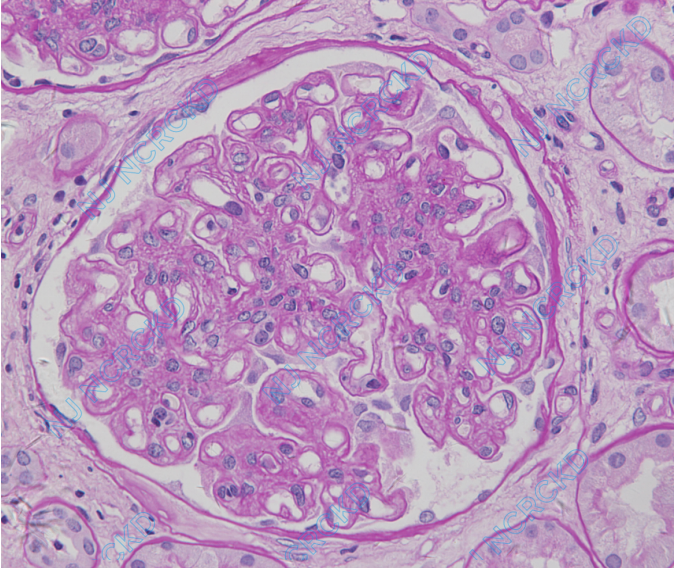

 图3 移植肾重复活检病理改变,A:肾小球系膜区重度增宽,节段基膜分层,见肾小球炎,肾小管基膜增厚(PAS,×400);B:肾小球系膜区系膜基质增多,基膜增厚(EM);C:肾小球基膜内皮下区域增宽、呈网格状、层状改变(EM)。
图3 移植肾重复活检病理改变,A:肾小球系膜区重度增宽,节段基膜分层,见肾小球炎,肾小管基膜增厚(PAS,×400);B:肾小球系膜区系膜基质增多,基膜增厚(EM);C:肾小球基膜内皮下区域增宽、呈网格状、层状改变(EM)。
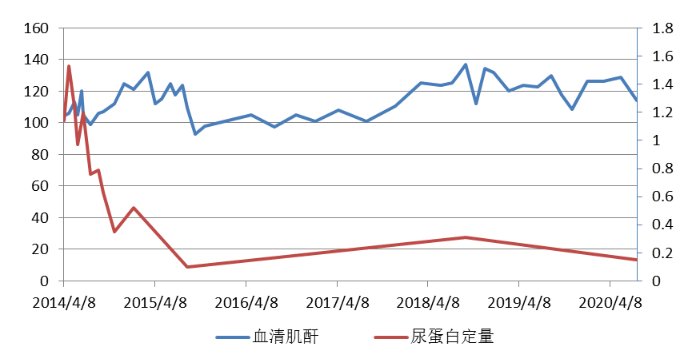
图4 肾移植术后血清肌酐和尿蛋白定量的变化情况
表1 供肾及两次移植肾肾活检的病理指标

C4d:C4d评分,g:肾小球炎,cg:移植肾小球病,mm: 肾小球系膜基质增生,t:肾小管炎,ct:肾小管萎缩,i:肾间质炎症,ci:肾皮质纤维化,ptc:管周毛细血管炎,v:动脉内膜炎,cv:动脉纤维性内膜增厚,aah:小动脉透明变性
表2 临床指标的变化

讨论
患者为青年女性,右侧同种异体肾移植术后4年余,临床表现为肾移植术后10日SCr恢复正常,肾功能长期稳定,尿蛋白定量从少量逐渐降至正常,血糖持续正常,近3月随PRA-Ⅱ类抗体阳性出现SCr轻度升高。
纵观供肾及两次移植肾肾活检,(1)供肾具有长期糖尿病病史,少量蛋白尿,肾功能正常,肾脏病理表现为DN(病理分级Ⅲ级),免疫荧光IgG类线状沉积于肾小球血管袢,(2)肾移植术后半年常规肾活检仍表现为DN(病理分级Ⅲ级),但免疫荧光IgG沉积消失,(3)术后4年肾活检肾小球未见结节性病变,DN病理改变较前改善(病理分级IIb)。本例患者展示了DN作为本例患者供肾移入性疾病,在非糖尿病内环境下发生的病理变化是缓慢的轻度的逆转。
为缓解供肾资源的短缺,糖尿病供者肾源所占比例近年逐渐上升。分析表明,非扩大标准的糖尿病供肾的移植肾存活率,优于非糖尿病的扩大标准供肾,但劣于非糖尿病的标准供肾,糖尿病供体/糖尿病受体移植肾存活率显著低于糖尿病供体/非糖尿病受体,但死亡截尾的移植肾存活率两者无显著差异。另一个研究组发现在获取时各组血肌酐无差异的情况下,5年人和移植肾存活率,2型糖尿病供体/非糖尿病受体优于非糖尿病供体/非糖尿病受体,后者则优于1型糖尿病供体/非糖尿病受体,但糖尿病供肾预存的损伤可能增加蛋白尿和移植后血糖不耐受(增加口服降糖药使用的比例)的风险,2型糖尿病供体/非糖尿病受体可能增加移植肾功能延迟恢复的风险。上述研究为糖尿病供体作为肾源提供了伦理依据。然而,经肾活检明确供肾为DN的肾源的报道很少。Truong等报道了11例供肾活检明确为DN的病例(8例 Ⅱa级,2例 IIb级,1例Ⅲ级),随访15~416周,移植肾活检示7例DN分级不变,1例可能进展,3例进展;随访末1例DN Ⅲ级且间质纤维化/小管萎缩40%的病例在76周时进入ESRD,5例SCr进展至177~239μmol/L,5例肾功能稳定。有个案报道了1例尿白蛋白阳性,且肾功能正常的DN供肾移植到非糖尿病患者体内,供肾活检提示结节性肾小球硬化及动脉透明变性(未提及肾小管间质病变),术后7月2例受体移植肾活检肾小球系膜增生完全逆转,基膜厚度恢复正常,但其中1例受体新出现糖尿病,30月时重复肾活检出现新生DN。
从另一方面,DN患者在内环境为正常血糖代谢的情况下也能发生组织学和尿蛋白尿排泄率的逆转。DN逆转见于成功的胰腺移植患者。Fioretto等观察了8例1型糖尿病的DN胰腺移植术后随访10年的患者,基线肌酐清除率均正常,糖化血红蛋白正常的情况下,肾小球的尿蛋白尿排泄率持续下降,肾小球体积持续下降,肾小球基膜和肾小管基膜厚度在第5年时变化不明显,第10年时显著下降,肾小球系膜增生在第5年时出现上升,但第10年时显著下降,K-W结节消失;肾间质和萎缩肾小管比例第10年时较第5年显著下降。但是2例在胰腺移植时即是“晚期”DN患者在随访5~10年时仍进展为ESRD。提示DN逆转有两个特点:其一是逆转时间长,其二与基础DN有关,早期DN可逆转,晚期逆转困难。本例患者术后肾活检组织学提示肾小球直径及体积均呈下降趋势。
DN是在长期慢性高血糖状态下,葡萄糖与游离氨基酸或组织蛋白结合,形成糖基化终末产物,与系膜细胞表面的糖基化终末产物受体结合,促使系膜细胞产生和释放细胞外基质,基膜增厚等,并导致蛋白尿发生。在转换为正常血糖代谢环境后,可能由于细胞外基质分子被严重糖基化和交联使其相对不易被降解,糖基化基质被缓慢取代,但DN的肾小球病变、肾小管间质病变仍可逆转,尿蛋白尿排泄率下降。
DN为代谢性肾脏疾病,缺乏系统性病因的受体在肾移植术后,肾小球病理改变可逐渐逆转。供肾为IgA肾病、狼疮性肾炎、膜性肾病等移入性疾病也有肾小球病理改变逆转的个案报道,这些病例为扩大供肾来源提供了一定的参考价值。
此外,本例患者PRA-Ⅱ类抗体阳性,肾小球基膜分层,超微结构观察肾小球内皮细胞病变,管周毛细血管分层,考虑合并移植肾小球病,第二次移植肾活检后加强免疫抑制治疗,长期随访肾功能稳定。
小结:本文报道了一例供肾移入性DN,尿蛋白数月后消失,长期随访肾功能稳定,DN在非糖尿病受体的正常糖代谢内环境中,病理改变可发生部分逆转。
来源:东部战区总医院供稿,摘自《肾脏病与透析肾移植杂志》
查看更多