查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导语:
功能失调的RNA结合蛋白(RBPs)与几种神经退行性变有关疾病。AD是痴呆症中最常见的一种,伴有进行性神经退行性变。
功能失调的RNA结合蛋白(RBPs)与几种神经退行性变有关疾病。最近这一研究范式已扩展到阿尔茨海默病(AD)的病理生理学。AD是痴呆症中最常见的一种,伴有进行性神经退行性变,影响了全世界4000多万人。一般来说,散发性AD病例的特点是认知能力下降缓慢,临床症状出现后疾病持续时间约为8年。然而,越来越多的证据显示临床表型和进展率都存在差异。最近,一种快速发展的AD(rpAD)被鉴定为微型精神状态检查(MMSE: a psychometric test)分数急剧下降(例如≥5分/年),和/或疾病持续时间缩短(约4年)。在不同的文献研究中,rpAD的临床定义差异很大。初步证据提供了一个令人信服的观点,即rpAD与独特的分子和致病级联相关。然而,在spAD和rpAD之间的核心神经病理学特征方面没有发现显著的差异,这表明需要了解导致这种异质性的潜在致病机制。
在文中,作者鉴定了散发性AD(spAD)、快速进行性AD(rpAD)和散发性Creutzfeldt Jakob病(sCJD)的RNA结合蛋白质组学(RBPome)的疾病亚型特异性变异以及使用RNA下拉分析结合蛋白质组学的对照病例。作者发现,其中一种已经被鉴定的蛋白质,剪接因子脯氨酸和谷氨酰胺丰富(SFPQ)在快速进展的AD患者、sCJD患者和处于疾病晚期的3xTg小鼠的死后大脑中表达下调。相比之下,3xTg小鼠在疾病早期和体外氧化应激刺激后SFPQ的表达升高。值得注意的是,在rpAD患者的大脑中,SFPQ表现出明显的核错位和与TIA-1的胞质共定位。此外,在rpAD脑损伤中,SFPQ和p-tau表现为核外共定位。值得注意的是,在rpAD大脑中SFPQ和tau寡聚体之间的联系表明SFPQ可能在tau蛋白的寡聚和随后的错误折叠中起作用。与来自人脑的研究结果一致,本文的体外研究表明,在氧化应激诱导后,SFPQ被招募到TIA-1阳性应激颗粒(SGs)中,并与这些颗粒中的tau/p-tau共定位,提供了通过病理性SGs导致SFPQ错位的可能机制。此外,体外表达的人tau诱导SFPQ显著下调,提示tau在SFPQ下调中起着因果作用。目前的研究结果表明,SFPQ的失调和错位、随后的DNA相关异常以及SGs与病理tau相关的异常动力学是导致AD快速进展的重要途径。
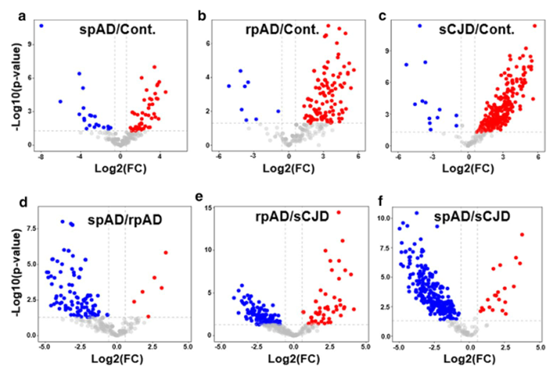
方法:本研究中的患者队列处理、神经病理学检查和脑组织收集均按照前面的描述进行。尸检时间间隔为3~18h,spAD和rpAD均为AD,Braak分期≥V,AD亚型的样本均无共同病理改变。同样,sCJD亚型(sCJD-MM1&-VV2)也完全由原发病构成。所有病例均经大脑皮质、丘脑、间脑、小脑和脑干25个区域的神经病理学检查证实。进行苏木精和伊红、Klüver-barera和免疫组织化学(用于胶质纤维酸性蛋白、β-淀粉样蛋白、磷酸化τ、α-突触核蛋白、TDP 43、泛素、p62和小胶质细胞特异性标记物)的研究。spAD的神经病理学评估是在Braak和Braak阶段之后进行的。所有rpAD病例均符合rpAD的现行标准。年龄分布无显著差异。
综上所述,与人脑研究结果平行,本文的体外研究(应激细胞模型)清楚地表明,在氧化应激治疗后,SFPQ和p-tau转化为胞浆TIA-1阳性的SGs。体外表达人tau(tau病理模型)可诱导SFPQ显著下调,提示tau在SFPQ下调中的作用。最后,3xTg小鼠模型研究特别揭示了靶蛋白组特征的非常早期的变化。在3xTg小鼠模型中,SFPQ和TIA-1的表达在疾病的早期已经显著升高,提示这些蛋白可能具有作为早期治疗靶点的潜在意义。
参考文献:Younas, N., Zafar, S., Shafiq, M. et al. SFPQ and Tau: critical factors contributing to rapid progression of Alzheimer’s disease. Acta Neuropathol 140, 317–339 (2020).
来源:MedSci梅斯
查看更多