查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





慢性肾脏病(CKD)是一个全球性的健康问题,中国成人CKD患病率已超过10%。慢性肾脏病矿物质与骨异常(CKD-MBD)是CKD的严重并发症,是CKD患者致残、致死等不良结局的重要原因之一,国际上一些肾脏病组织相继制订了一系列指南用于规范CKD-MBD的诊断和治疗。
2013年刘志红教授领导的团队制订了《慢性肾脏病矿物质和骨异常诊治指导》,极大地推动了我国肾脏病学家对CKD-MBD的认识和管理水平,对于改变我国CKD-MBD知晓率低、检查和监测不合理、治疗不规范且治疗达标率低、相关临床和基础研究缺乏等问题起到了巨大的推动作用。随着我国临床工作者对CKD-MBD认识的深入、对CKD-MBD规范化管理的实施,及CKD-MBD临床和基础研究的开展,制订《中国慢性肾脏病矿物质和骨异常诊治指南》(以下简称《指南》)的基础和时机已经基本成熟。经过工作组专家的努力,《指南》已付梓出版。
本《指南》的内容包括:CKD-MBD概述;CKD-MBD的诊断;CKD-MBD的预防和治疗;CKD患者骨质疏松的预防与治疗;肾移植受者相关骨病的诊断和治疗。附录则包括:CKD-MBD相关诊断流程,糖皮质激素相关骨质疏松和肝素相关骨质疏松的预防与治疗及不同食物和食品添加剂磷的含量。
工作组专门成立了文献收集评价小组,对相关文献进行全面系统地评价,综合分析了循证医学证据和国际指南,共纳入746篇文献,其中来自我国的文献有111篇,反映了我国肾脏病专家在CKD-MBD方面做出的贡献。但我们也认识到,目前CKD-MBD还有很多亟待解决的问题,例如,对透析患者关注多,非透析患者重视不够;横断面研究多,长期随访研究少,多中心、大样本、随机对照临床试验少,基础研究少等等。这些问题需要在今后的工作中加以改进和提高,为下一版《指南》更新提供更多、更好的证据。本文简要阐述《指南》的概要。
本《指南》对CKD的分类诊断参照2012年改善全球肾脏病预后(KDIGO)指南分类诊断标准制订。
CKD-MBD是指由于CKD所致的矿物质与骨代谢异常综合征,可出现以下一项或多项临床表现:(1)钙、磷、甲状旁腺激素(PTH)或维生素D代谢异常;(2)骨转化、骨矿化、骨量、骨线性生长或骨强度异常;(3)血管或其他软组织钙化。
上述定义中所涉及异常指标的诊断标准主要参考2012年KDIGO的CKD评估和管理指南,以及2009年和2017年CKD-MBD指南。
2.1 生化指标的监测
2.1.1 对于成人CKD患者,推荐从CKD G3a期开始监测血清钙、磷、全段PTH(iPTH)及碱性磷酸酶(ALP)水平,并建议检测血清25(OH)D水平。(未分级)
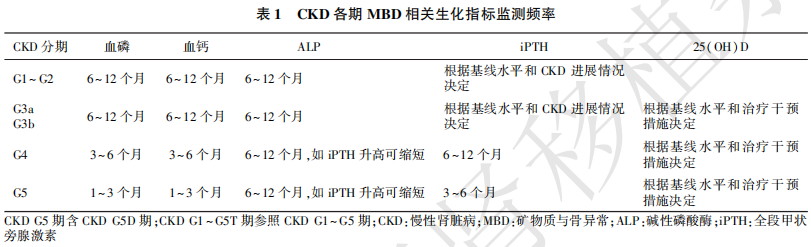
2.1.2 对于CKD G3~G5D期患者,可根据血清钙、磷、ALP、iPTH和25(OH)D水平是否异常及其严重程度,以及CKD进展速度来决定监测频率。建议合理的监测频率如下(表1):(未分级)
(1)CKD G3a~G3b期:建议每6~12个月检测血清钙、磷、ALP;根据iPTH基线水平和CKD进展情况决定iPTH的检查间隔时间。
(2)CKD G4期:建议每3~6个月检测血清钙、磷、ALP水平;每隔6~12个月检测iPTH水平。
(3)CKD G5期和G5D期:建议每1~3个月检测血清钙、磷、ALP水平;每3~6个月检测iPTH水平。
(4)CKD G4~G5D期:建议每6~12个月检测ALP;如iPTH水平升高,则可增加检测频率。
(5)CKD G3a~G5D期:建议检测25(OH)D的水平,并根据基线水平和治疗干预措施决定重复检查的频率。
对于接受针对CKD-MBD治疗或已经出现血清生化检查异常的CKD患者,建议合理增加检测频率,从而监测病情变化趋势、疗效及药物不良反应。
2.1.3 对于CKD G3a~G5D期患者,需根据生化指标变化趋势及对CKD-MBD相关评估结果综合考虑而非单个实验室检测结果来制订治疗决策。(1C)
2.1.4 对于CKD G3a~G5D期患者,建议分别对血清钙和磷水平进行评估,指导临床治疗,而不以钙磷乘积(CaxP)结果指导临床。(2D)
2.1.5 在CKD G3a~G5D期患者的实验室检查报告中,临床实验室应该向临床医师提供关于实际使用检测方法的信息,并报告关于操作规范、样本来源(血浆或血清)及样本处理细节等方面的任何变更,以协助临床医师对生化检查结果做出合理解读。(1B)
2.2 骨病变的评价
2.2.1 对于有CKD-MBD证据的CKD G3a~G5期患者,骨密度(BMD)不能预测肾性骨营养不良的类型。对CKD G3a~G5期患者骨折发生风险的预测价值还需要进一步评估。在可能需要根据BMD结果选择治疗措施时,建议行BMD检测。(2B)
2.2.2 骨活检是诊断CKD-MBD的金标准,但由于临床实施困难,数据缺乏,对于有CKD-MBD证据的CKD G3a~G5期患者,目前尚不能推荐骨活检作为常规检查项目。(未分级)
具备以下指征的患者,在有条件的情况下建议行骨活检以明确诊断:不明原因骨折、持续性骨痛、不明原因高钙血症、不明原因低磷血症、可能存在铝中毒及使用双膦酸盐治疗CKD-MBD前。(未分级)
2.2.3 CKD G3a~G5期患者,建议用血清iPTH和ALP来评价骨病的严重程度,上述指标显著升高或降低可预测可能的骨转化类型。(2B)
2.2.4 CKD G3a~G5期患者,有条件的情况下可检测骨源性胶原代谢转换标志物,来评估骨病的严重程度。(2C)
2.3 血管钙化的诊断和评估
2.3.1 对于显著高磷血症需要个体化高剂量磷结合剂治疗者、等待肾移植受者、CKD G5D期患者和医师评估后认为需要检查的患者,建议进行心血管钙化评估。(未分级)
2.3.2 CKD G3~G5D期患者,可采用侧位腹部X光片检查是否存在血管钙化,并使用超声心动图检查是否存在心脏瓣膜钙化,有条件的情况下可采用电子束CT及多层螺旋CT评估心血管钙化情况。(2C)
2.3.3 建议6~12月进行一次心血管钙化评估。(未分级)
2.3.4 当CKD G3~G5D期患者合并存在血管和(或)心脏瓣膜钙化时,建议将其心血管疾病风险列为最高级别。(2A)并可据此指导CKD-MBD患者管理。(未分级)
3.1降低高血磷,维持正常血钙
CKD G3a~G5D期患者,CKD-MBD治疗应基于对钙、磷及iPTH的综合评估。(未分级)
3.1.1 CKD G3a~G5D期,建议尽可能将升高的血清磷降至接近正常范围。(2C)
3.1.2 成年CKD G3a~G5D期患者,建议尽可能避免高钙血症。(2C)
3.1.3 CKD G3a~G5D期患者,血磷超过目标值,建议应限制饮食磷摄入(800~1000 mg/d),或联合其他降磷治疗措施。(2D)
建议限制摄入蛋白质的总量,选择磷/蛋白比值低、磷吸收率低的食物,限制摄入含有大量磷酸盐添加剂的食物。(未分级)
3.1.4 CKD G5D期患者,建议采用专业化的强化教育,改善血磷控制。(2B)
3.1.5 CKD G5D期患者,建议透析液钙离子浓度为1.25~1.50 mmol/L(血液透析)或1.25mmol/L(腹膜透析)。(2C)
3.1.6 CKD G5D期血液透析患者,应充分透析,并考虑延长透析时间或增加透析频率,以更有效地清除血磷。(2C)
3.1.7 CKD G3a~G5D期患者,应当在血磷进行性、持续性升高时,开始降磷治疗。(未分级)
3.1.8 CKD G3a~G5D期患者,应限制含钙磷结合剂的使用。(2B)
3.1.9 CKD G3a~G5D患者,应强调磷结合剂使用的个体化。(未分级)
3.1.10 CKD G3a~G5D患者,在管理血清钙、磷的同时,应重视对继发性甲状旁腺功能亢进(SHPT)的控制。(未分级)
3.2 SHPT的治疗
3.2.1 非透析CKD G3a~G5期患者最佳iPTH水平目前尚不清楚。iPTH水平进行性升高或持续高于正常上限的患者,建议评估是否存在以下可干预因素:高磷血症、低钙血症、高磷摄入、维生素D缺乏。(2C)
3.2.2 建议CKD G5D期患者的iPTH水平应维持在正常值上限的2~9倍。(2C)
3.2.3 CKD G3a~G5期未接受透析的成年患者,不建议常规使用活性维生素D及其类似物。(2C)
伴严重、进行性甲状旁腺功能亢进的CKD G4~G5期患者,可使用活性维生素D及其类似物。(未分类)
儿童患者可考虑使用活性维生素D及其类似物,以维持患儿血钙水平在相应年龄的正常范围。(未分类)
3.2.4 CKD G5D期需要降PTH治疗的患者,建议使用活性维生素D及其类似物、拟钙剂,或使用活性维生素D及其类似物联合拟钙剂治疗。(2B)
3.2.5 甲状旁腺切除术(PTX)指征:CKDG3a~G5D期合并药物治疗无效的严重SHPT患者,建议行PTX。(2B)
3.2.6 当出现下列情况,建议行PTX:(未分级)
(1)iPTH持续>800 pg/ml;
(2)药物治疗无效的持续性高钙和(或)高磷血症;
(3)具备至少一枚甲状旁腺增大的影像学证据,如高频彩色超声显示甲状旁腺增大,直径>1cm并且有丰富的血流;
(4)既往对活性维生素D及其类似物药物治疗抵抗。
严重SHPT定义为:血清iPTH持续>800pg/ml。
3.2.7 PTX手术方式主要有三种:甲状旁腺全切除+自体移植术(tPTX+AT)、甲状旁腺次全切除术(sPTX)和甲状旁腺全切除术(tPTX)。(未分级)
3.3 CKD患者血管钙化的防治
3.3.1 建议控制CKD患者的高磷血症以降低血管钙化风险,防治措施包括限制饮食磷的摄入,选择合适的磷结合剂,充分透析或增加透析对磷的清除及有效控制SHPT。(未分级)
3.3.2 需要磷结合剂治疗的CKD G3a~G5D患者,建议限制含钙磷结合剂的使用。(2B)
3.3.3 建议CKD患者避免发生高钙血症以降低血管钙化风险。建议使用钙浓度为1.25~1.5mmol/L的透析液。(2C)建议准确掌握含钙药物与活性维生素D及其类似物的适应证。(未分级)
3.3.4 建议治疗SHPT并防止甲状旁腺功能低下,合理使用活性维生素D及其类似物、拟钙剂,或实施PTX。治疗过程中应监测血钙和血磷水平,避免高钙血症和高磷血症。(未分级)
4.1 骨质疏松的诊断和评估
4.1.1 建议生化指标监测的频率:(未分级)
(1)每6~12个月检查血清钙、磷、ALP水平;
(2)根据iPTH基线水平和CKD进展情况决定iPTH的检查间隔时间;
(3)有条件时,建议检测25(0H)D水平,并根据基线水平和治疗干预措施决定重复检测的频率。
4.1.2 建议对CKD G1~G2期患者定期测定腰椎及髋关节骨密度以评估是否合并骨质疏松。(未分级)
4.1.3 建议对CKD G3a~G5D期有CKD-MBD证据和(或)有骨质疏松风险患者测定BMD以评估骨折风险。(2B)
4.1.4 建议对CKD患者进行骨质疏松骨折风险预测。较为常用的预测方法是亚洲人骨质疏松自我筛查工具(osteoporosis self-screening tool, OSTA)和WHO骨折风险预测简易工具(WHO fracture riskassessment tool,FRAX)。(未分级)
4.2 骨质疏松的基础治疗
调整生活方式对骨质疏松的预防和治疗具有重要意义,主要措施包括:均衡膳食,合理运动,避免嗜烟、酗酒,慎用影响骨代谢的药物,防止跌倒,加强自身和环境的保护措施等。
4.3 骨质疏松的治疗时机
4.3.1 具备以下情况之一者,需考虑药物治疗:(未分级)
(1)确诊骨质疏松者(BMD:T值≤-2.5),无论是否有过骨折;
(2)骨量低下患者(BMD:-2.5<T值≤-1.0),并且存在一项以上骨质疏松危险因素,无论是否有过骨折;
(3)无测定BMD条件时,具备以下情况之一者,也需考虑药物治疗:①已发生过脆性骨折;②OSTA筛查为高风险;③ FRAX工具计算出髋骨骨折概率≥3%,或任何重要部位的骨质疏松性骨折发生概率≥20%。
4.4 骨质疏松的药物治疗
4.4.1 CKD患者双膦酸盐使用指征:
(1)CKD C1~G2期患者,如果出现骨质疏松和(或)高骨折风险,建议按照普通人群治疗方案使用双膦酸盐;(2B)
(2)CKD G3~G4期患者,如果出现CKD-MBD生化指标异常及低BMD和(或)脆性骨折,建议根据生化指标改变的幅度、可逆性及CKD进展情况选择是否加用双膦酸盐或其他骨质疏松药物治疗,同时考虑进行骨活检;(未分级)
(3)CKD G5期患者使用双膦酸盐治疗时需特别注意根据生化指标或骨活检情况排除无动力骨病。(2B)
4.4.2 建议双膦酸盐使用方法如下:(未分级)
(1)第一代双膦酸盐以氯屈膦酸盐为代表,口服400mg/d;依替膦酸钠口服200 mg/次,2次/d;
(2)第二代双膦酸盐目前最常用,以阿仑膦酸钠、帕米膦酸二钠为代表。阿仑膦酸钠,口服75mg,1次/周;帕米膦酸二钠,口服150 mg/d,或静脉滴注30~90 mg/d,1次/3~4周,静脉滴注时间不少于2h;
(3)第三代双膦酸盐以唑来膦酸钠、伊班膦酸钠、利噻膦酸为代表。唑来膦酸钠5mg/d,静脉滴注,1次/年,连续用3年;伊班膦酸钠2mg/d,静脉滴注1次;利噻膦酸钠,口服5mg/d或35mg/周。
4.4.3 CKD患者双膦酸盐使用注意事项包括:(未分级)
(1)无动力性骨病是使用双膦酸盐的禁忌证,因此使用双膦酸盐前应考虑骨活检或临床及生化检查指标,排除无动力性骨病。
(2)双膦酸盐主要经肾脏排泄,CKD G1~G3期患者无需调整剂量,但eGFR<35 ml/(min·1.73m2)时不推荐使用唑来膦酸钠。eGFR<30 ml/(min·1.73m2)时需适当调整剂量并短期使用,eGFR<15ml/(min·1.73m2)时,可口服双膦酸盐,优先选择利噻膦酸钠35mg,隔周1次,使用不超过3年。如患者不能耐受口服双膦酸盐,可考虑使用静脉制剂,但需要注意水化。
(3)双膦酸盐药物口服安全性良好,但存在明显的胃肠道不良反应及一过性“流感样”症状。下颌骨坏死和肾毒性是此类药物较严重的不良反应。建议使用双膦酸盐前动态监测血清肌酐水平,同时在使用过程中定期检查尿蛋白。
4.4.4 对于CKD患者,如果合并骨质疏松和(或)高骨折风险,可予活性维生素D及其类似物和钙剂治疗:
(1)CKD G1~G2期患者,合并骨质疏松和(或)骨折风险高,推荐参照普通人群的治疗方案。(2B)
(2)CKD G3a~G3b期,iPTH在正常值范围合并骨质疏松和(或)骨折风险高的患者,建议参照普通人群的治疗方案。(2B)
(3)CKD G3a~G5D期患者,如果出现CKD-MBD相关生化异常和(或)低BMD和(或)脆性骨折,建议根据生化指标改变的程度和可逆性及CKD的进展情况来选择治疗方案,并考虑进行骨活检。
(1A)
4.4.5 CKD患者降钙素治疗的指征包括:
(1)其他药物治疗无效的骨质疏松症患者,如高转化骨质疏松、老年骨质疏松、皮质激素治疗引起的骨质疏松。为防止骨量进行性丢失,建议根据个体需要适量补充钙和维生素D;(2B)
(2)由于骨质溶解或骨质减少引起的骨痛;(未分级)
(3)伴严重高钙血症的CKD患者。(2B)
4.4.6 对于骨折风险高的女性绝经后骨质疏松症、男性原发性或性功能减退性骨质疏松症及糖皮质激素诱导性骨质疏松症,尤其是抗骨吸收药物治疗无效的患者,重组PTH能够增加BMD,改善骨重构,建议使用重组PTH进行治疗。(2C)
4.4.7 CKD G1~G2期合并性激素减少相关骨质疏松的患者,如60岁以前围绝经期和绝经后妇女,特别是有绝经相关症状及泌尿生殖道萎缩症状的妇女,可使用雌激素类药物治疗骨质疏松。(2B)
4.4.8 CKD G1~G2期患者,确诊为绝经后骨质疏松的女性,可使用雌激素受体调节剂治疗(2B);CKD G3~G5D期绝经后女性患者,若在iPTH控制良好时仍有严重骨质疏松或骨折,可考虑使用。(未分级)
5.1 肾移植受者相关骨病的诊断
5.1.1 在肾移植术后初期,建议至少每周测定血清钙、磷水平,直至两者达到稳定。(1B)
5.1.2 在肾移植术后初期过后,血清钙、磷及iPTH水平的监测频率取决于以上生化指标的异常程度和CKD的进展速度。(未分级)
建议的检测间隔为:
1 CKD GIT~G3T期患者:每6~12个月检测血清钙、磷水平;在首次检测iPTH之后根据其基线水平和CKD进展情况决定iPTH的检查频率;
2 CKD G4T期患者:每3~6个月检测血清钙、磷水平;每6~12个月检测iPTH水平;
3 CKD G5T期患者:每1~3个月检测血清钙、磷水平;每3~6个月检测iPTH水平;
4 CKD G3T~G5T期患者:每6~12个月检测ALP活性;如存在iPTH水平升高,则可增加检测频率。
对于接受CKD-MBD治疗或出现生化指标异常的肾移植受者,可合理增加检测的频率,以监测疗效和药物不良反应。(未分级)
5.1.3 CKD GIT~G5T期患者,建议测定25(0H)D水平,并根据基线值和治疗措施决定重复检测的频率。(2C)
5.1.4 CKD G1T~G5T且有骨质疏松风险的患者,由于BMD能够改变治疗策略,建议检测BMD来评估骨折的风险。(2C)
5.2 对相关生化指标异常的处理
对出现生化指标异常患者的处理,包括钙、磷、iPTH等水平异常,建议根据CKD G3~G5期患者的处理方案执行。(未分级)
5.3 维生素D缺乏与不足
对于肾移植受者中出现的维生素D缺乏和不足,建议参照CKD相应分期人群的治疗策略加以纠正。(2C)
5.4 BMD过低的处理
5.4.1 接受肾移植术12个月内,eGFR>30ml/(min·1.73m2),且BMD过低的受者,建议使用维生素D、活性维生素D及其类似物或双膦酸盐治疗。(2D)
(1)选择治疗药物时应该考虑是否存在CKD-MBD;可通过血钙、磷、iPTH、ALP和25(OH)D水平加以判断。(2C)
(2)可考虑进行骨活检以指导治疗。(未分级)
(3)目前尚无足够的数据对肾移植术后12个月后的治疗进行指导。
5.4.2 对于BMD减低的CKD G4T~G5T期患者,建议的治疗方案与CKD G4~G5期且未行透析的患者类似。(2C)
5.5 预防和治疗方案
5.5.1 肾移植术后应用维生素D(含活性维生素D)可能对预防患者BMD降低有利。(未分级)
5.5.2 目前还不能确定应用双膦酸盐对预防肾移植受者相关骨病是否有益处。
5.6 肾移植术后甲状旁腺功能亢进症的手术治疗
5.6.1 建议在肾移植术后发生持续高钙血症
5.6.2 对于肾功能稳定暂不需要透析的患者,不建议行tPTX+AT,而建议仅切除甲状旁腺腺瘤或腺瘤样增生的组织,或sPTX。(未分级)
来源:东部战区总医院供稿,摘自《肾脏病与透析肾移植杂志》
查看更多